- Pulmonalen Hypertonie bei Linksherzerkrankungen
Die pulmonale Hypertonie (PH) bei Linksherzerkrankungen (pulmonary hypertension in left heart diseases; PH-LHD) ist die mit Abstand häufigste Form der PH (1). Bei Patienten mit Linksherzerkrankungen, das heisst Herzinsuffizienz (HF) mit dem ganzen Spektrum der Auswurffraktion (left ventricular ejection fraction, LVEF) und Klappenerkrankungen, ist das Vorliegen einer PH mit besonders schwerer Symptomatik, stark reduzierter Leistungsfähigkeit und ungünstiger Prognose assoziiert (2, 3). In der vorliegenden Übersicht werden Definition, aktuelle pathophysiologische Konzepte, Diagnostik und die Prinzipien der Therapie kurz zusammengefasst.
Abstract: Pulmonary hypertension in left heart diseases (PH-LHD) is by far the most common form of PH (1). In patients with left heart disease, that is, heart failure (HF) with the full spectrum of left ventricular ejection fraction (LVEF) and valvular disease, the presence of PH is associated with particularly severe symptoms, severely reduced exercise capacity, and unfavorable prognosis (2, 3). This review briefly summarizes the definition, current pathophysiological concepts, diagnosis, and principles of therapy. Key Words: Pulmonary hypertension in left heart diseases (PH-LHD), heart failure, left ventricular ejection fraction (LVEF)
Key Words: Pulmonale Hypertonie bei Linksherzerkrankungen, Herzinsuffizienz, left ventricular ejection fraction (LVEF
Definition
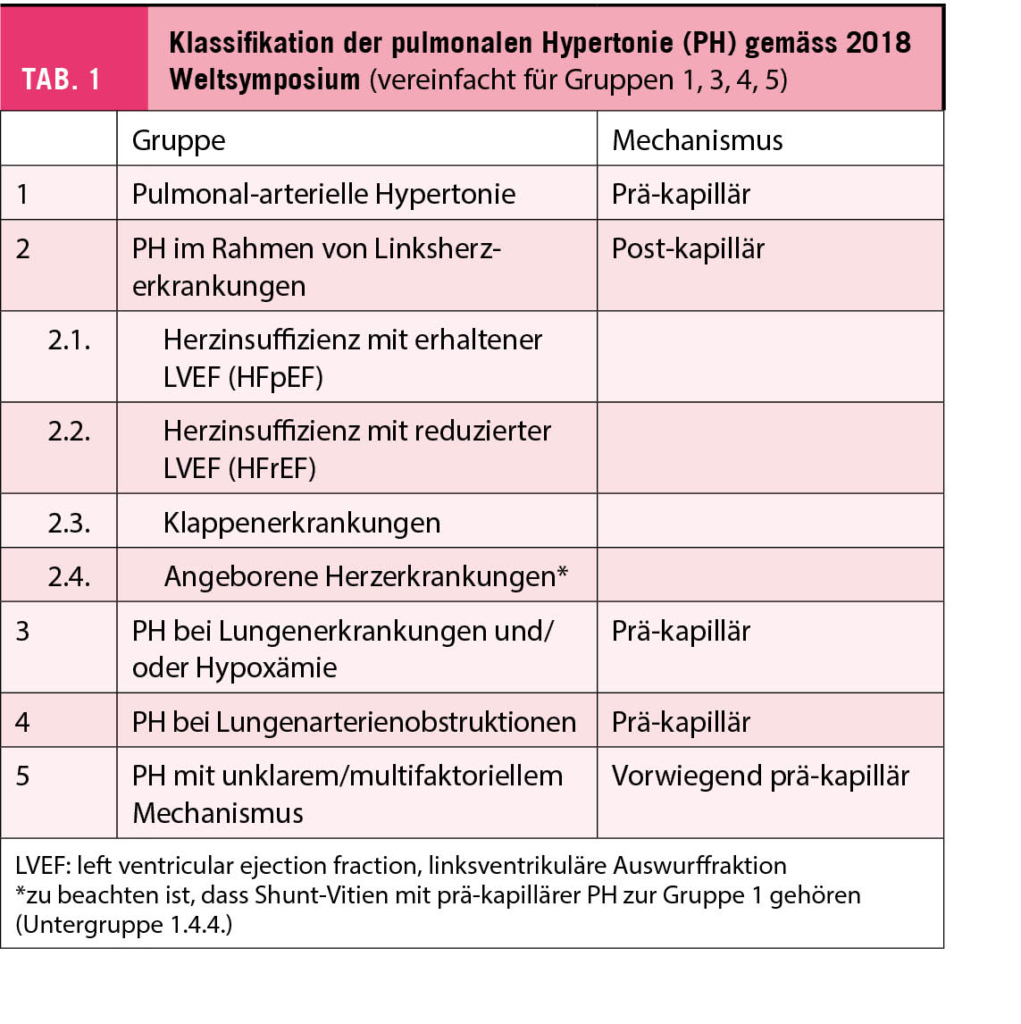
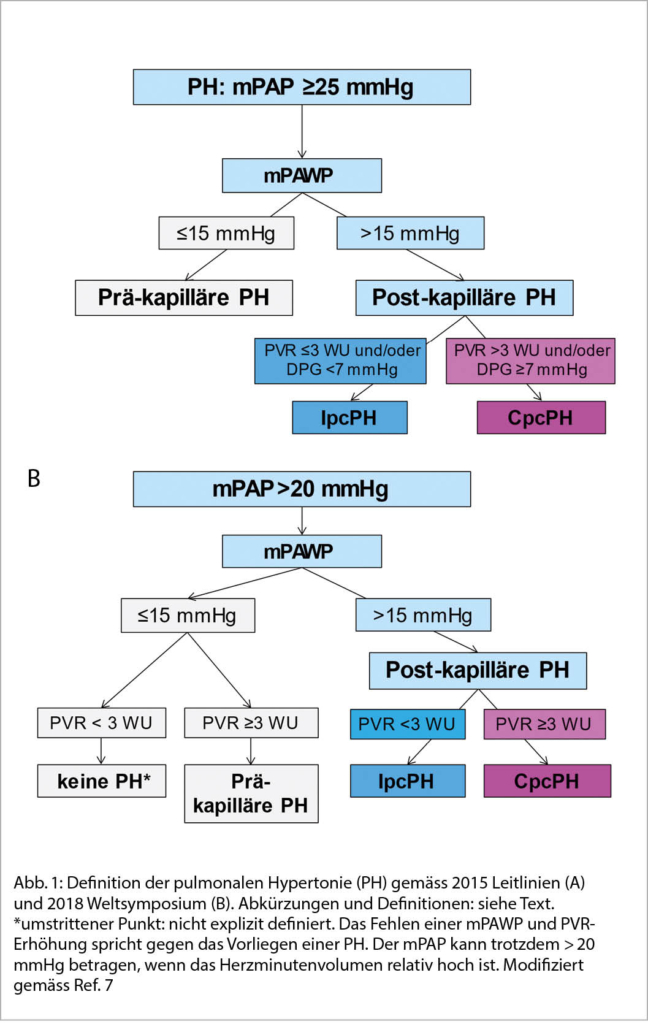
Gemäss den 2015 Leitlinien der Europäischen Gesellschaft für Kardiologie (ESC) und der Europäischen Pneumologie Gesellschaft (ERS) ist jede PH definiert als ein mittlerer Druck in der Arteria pulmonalis (mean pulmonary artery pressure; mPAP) ≥25 mmHg (4). Die PH-LHD ist die einzige relevante PH mit einem post-kapillären Mechanismus (Tab. 1). Eine post-kapilläre PH wird durch einen mittleren pulmonalarteriellen Verschlussdruck (mean pulmonary artery wedge pressure; mPAWP) >15 mmHg von einer prä-kapillären PH abgegrenzt (Abb. 1A). Die post-kapilläre PH wird basierend auf dem Vorliegen einer pulmonal-vaskulären Komponente zusätzlich differenziert in kombiniert prä- und post-kapillär (combined pre- and post-capillary PH; CpcPH) und isoliert post-kapillär (isolated post-capillary PH; IpcPH). Eine CpcPH ist definiert durch einen pulmonalvaskulären Widerstand [pulmonary vascular resistance, PVR; PVR = (mPAP minus mPAWP) / Cardiac Output] > 3 Wood units (WU) und/oder einen diastolischen Druckgradienten (diastolic pressure gradient; DPG; DPG = diastolischer pulmonaler Druck minus mPAWP) ≥ 7 mmHg. Die IpcPH ist definiert als PVR ≤3 WU und/oder DPG < 7 mmHg (Abb. 1A). Diese Definition ist problematisch, da PVR und DPG oft diskordant sind, was viele PatientInnen mit dieser Definition unklassifizierbar macht. Am 2018 Weltsymposium für PH wurde eine neue PH Definition vorgeschlagen (5, 6), welche vermutlich auch in den nächsten ESC/ERS Leitlinien (erwartet 2022) übernommen werden wird: die post-kapilläre PH ist neu definiert als mPAP > 20 mmHg (statt ≥25 mmHg) und mPAWP ≥ 15 mmHg (Abb. 1B). Für die Unterscheidung zwischen CpcPH und IpcPH wird aufgrund der Problematik des DPG (oft negative Werte, oft diskordent zu PVR, Daten über prognostischen Wert nicht konsistent) nur noch das PVR-Kriterium verwendet: CpcPH: PVR ≥ 3 WU (statt > 3), IpcPH: PVR < 3 WU (statt ≤ 3 WU).
Pathophysiologie
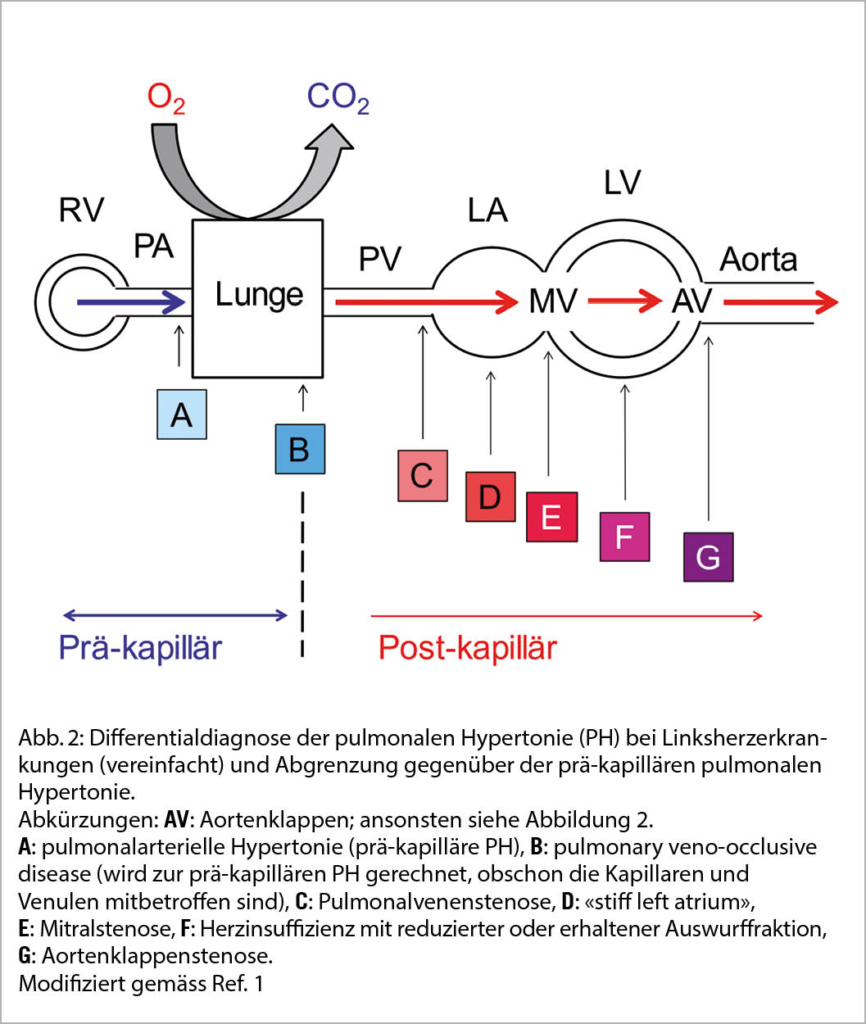
Die PH im Rahmen von Linksherzerkrankungen ist immer eine post-kapilläre PH, also eine Situation, wo ein erhöhter mPAP die Folge eines erhöhten mPAWP ist (Tab. 1) (1). Die Erhöhung des mPAWP kann verschiedene Mechanismen mit den hauptsächlichen «Hindernissen» auf verschiedenen Ebenen der Zirkulation haben, wie dies in Abbildung 2 schematisch dargestellt ist. Die Einteilung der PH-LHD gemäss 2018 Weltsymposium umfasst HFrEF, HFpEF, Klappenerkrankungen und angeborene Kardiopathie (ausser Shuntvitien) (5). Untenstehend werden einige spezifische Aspekte von verschiedenen zugrundeliegenden Entitäten diskutiert. In Abhängigkeit vom Ausmass und der Chronizität der linksatrialen Druckerhöhung bzw. der Erhöhung des mPAWP kann es sekundär zu Veränderungen der pulmonalen Vaskulatur mit Anstieg des PVR kommen, d.h. aus einer IpcPH kann sich eine CpcPH entwickeln. Dies ist sehr wichtig, da das Vorliegen einer CpcPH ein prognostisch sehr ungünstiger Marker ist. Die zugrundliegende Pathophysiologie ist sehr unvollständig verstanden. Die Gefässveränderungen scheinen primär die Venulen zu betreffen, während die pulmonalarterielle Hypertonie durch Läsionen der Arteriolen gezeichnet ist. Die Kombination eines erhöhten mPAWP mit einem erhöhten PVR führt zu einer oft ausgeprägten Erhöhung des mPAP und einer starken Belastung des rechten Ventrikels (RV). Der RV ist schlecht geeignet eine Druckbelastung zu bewältigen, und die Güte der Adaption des RV (d. h. die RV-Funktion in Relation zur Nachlast, RV to pulmonary artery coupling) ist prognostisch sehr wichtig (2).
Herzinsuffizienz mit reduzierter LVEF (HFrEF)
Patienten mit HFrEF bei Koronarer Herzkrankheit oder nicht-ischämischer Kardiomyopathie haben aufgrund einer eingeschränkten systolischen und diastolischen linksventrikulären Funktion, einer funktionellen Mitralinsuffizienz und einer linksatrialen Funktionsstörung im Rahmen einer Dekompensation sehr häufig eine PH. Diese ist nach Optimierung der medikamentösen Therapie und Erreichen der Euvolämie häufig regredient bzw. nicht mehr nachweisbar. Patienten mit fortgeschrittener HFrEF haben aber oft eine chronische PH, wobei sich aufgrund der chronischen Erhöhung des mPAWP dann eine CpcPH etablieren kann.
Herzinsuffizienz mit erhaltener LVEF (HFpEF)
Patienten mit HFpEF haben in Ruhe oft normale oder nur wenig erhöhte Füllungsdrücke, zeigen aber unter Belastung aufgrund der steilen end-diastolischen Druck-Volumen-Beziehung des linken Ventrikels einen schnellen Anstieg von linksventrikulärem end-diastolischem Druck (LVEDP) und mPAWP. Bei fortgeschrittener HFpEF ist eine PH aber nicht selten. Die Vorhofsdilatation bei HFpEF ist typischerweise weniger ausgeprägt als bei HFrEF. Andererseits ist die linksatriale Compliance bei HFpEF schlechter. Bei HFpEF kann sich ebenfalls eine funktionelle Mitralinsuffizienz entwickeln, welche im Gegensatz zur linksventrikulären Dilatation und Geometriestörung bei HFrEF durch die Vorhofsdilatation und Dilatation des Mitralannulus bedingt ist («atriale Mitralinsuffizienz»). Auch eine dynamische Komponente der Mitralinsuffizienz ist bei HFpEF möglich. Interessanterweise scheinen HFpEF-PatientInnen eine stärkere Neigung zur Entwicklung einer CpcPH zu haben, indem der PVR für einen bestimmten mPAWP bei HFpEF höher ist als bei HFrEF. Auch HF mit leicht reduzierter LVEF (HFmrEF) kann mit PH assoziiert sein, wobei detaillierte Studien fehlen (2).
Klappenerkrankungen
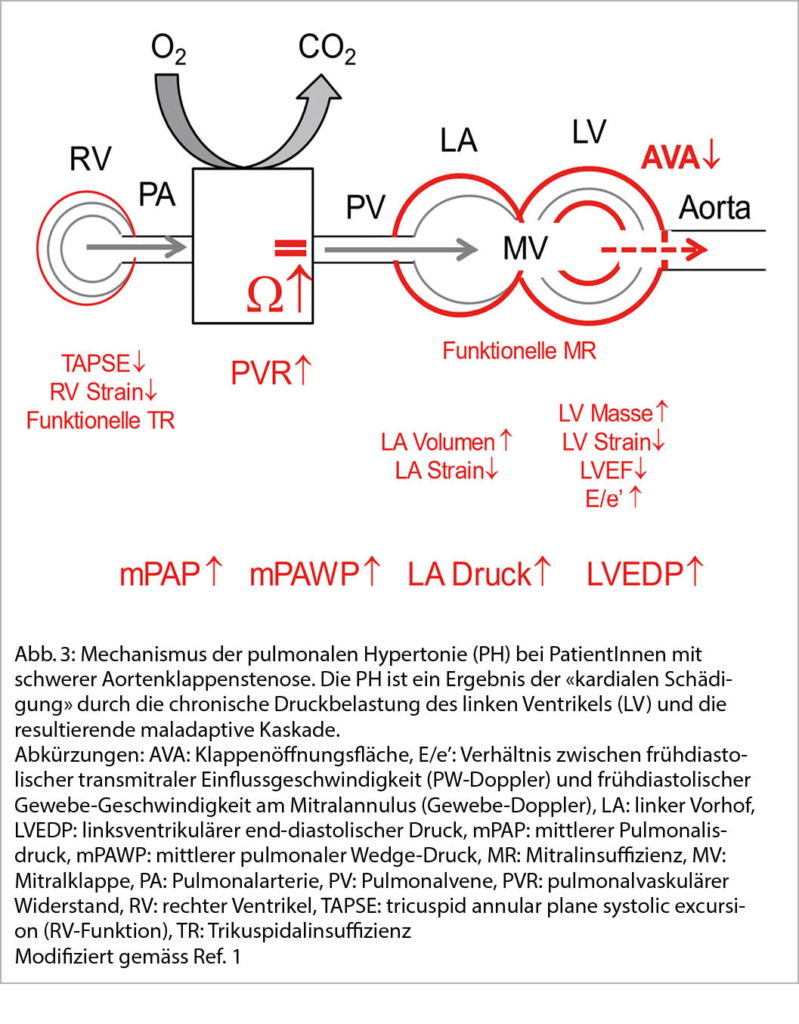
Alle Vitien der Aorten- und Mitralklappe können mit einer PH assoziiert sein (3). Das aktuell am besten untersuchte Setting ist die schwere Aortenklappenstenose (Abb. 3). Die chronische Druckbelastung des linken Ventrikels führt zu initial kompensatorischen, später maladaptiven Veränderungen des linken Ventrikels, des linken Vorhofs, der Mitralklappe und schliesslich auch der Lungenstrombahn (7). Eine PH ist ein spätes Stadium dieses «kardialen Schadens», und eine CpcPH bzw. eine rechtsventrikuläre Dysfunktion sind prognostisch sehr ungünstig, auch wenn ein Aortenklappenersatz durchgeführt wird. Das Ausmass der PH und insbesondere das Vorliegen einer CpcPH vor Klappenersatz sind prädiktiv für die Persistenz einer PH nach Klappenersatz (8).
Diagnostik
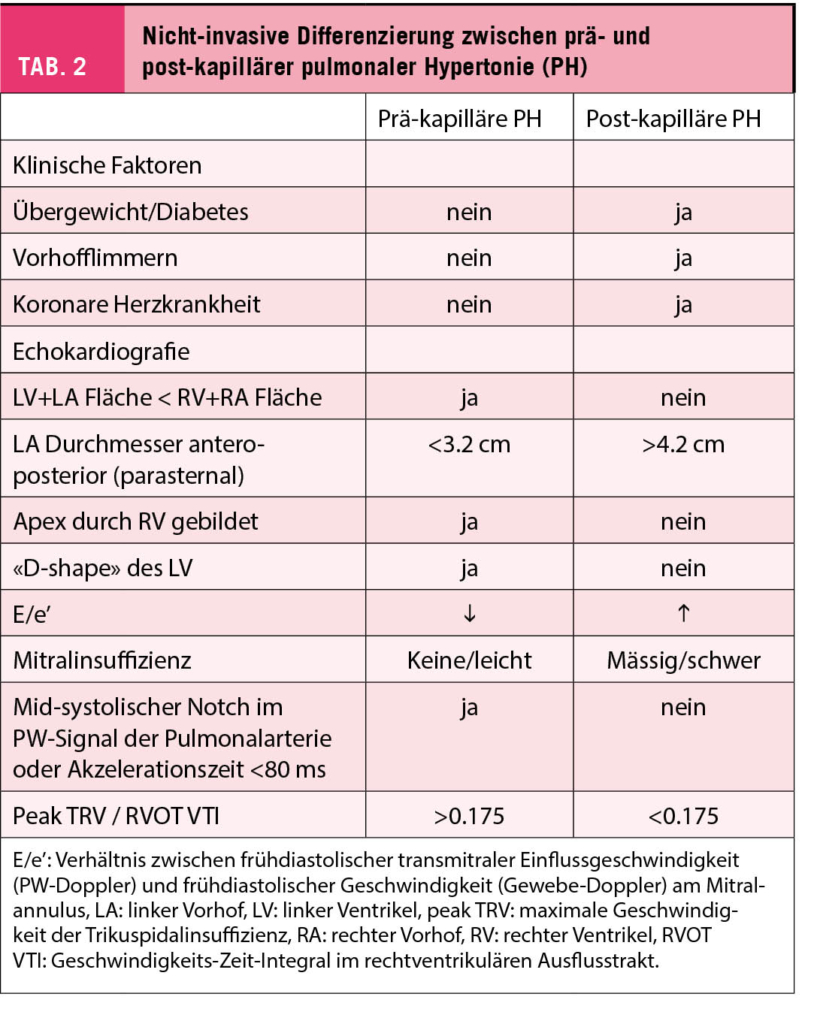
Während jede Gruppe 1 PH als Grundlage für eine (teure) spezifische Therapie mittels Rechtsherzkatheter dokumentiert werden muss, trifft dies für PatientInnen mit PH-LHD nicht zu. Wie weiter unten ausgeführt, gibt es aktuell keine Indikation für eine spezifische Therapie bei PH-LHD (1). Die Diagnose einer PH-LHD kann oft nicht-invasiv, d.h. echokardiografisch gestellt werden, auch wenn dies wie oben ausgeführt definitiv nur mittels invasiver Hämodynamik erfolgen kann. Gemäss 2015 ESC/ERS Leitlinien (4) liegt eine hohe Wahrscheinlichkeit einer PH vor, wenn die maximale Geschwindigkeit der Trikuspidalinsuffizienz (peak tricuspid regurgitant velocity, peak TRV) > 3.4 m/s beträgt, oder wenn die peak TRV 2.9-3.4 m/s beträgt, und gleichzeitig indirekte Zeichen einer relevanten PH (RV Dilatation, rechtsatriale Dilatation, «D-shape» des linken Ventrikels, kurze pulmonale Akzelerationszeit) vorliegen. Es gibt verschiedene nicht-invasive Hinweise, die bei der Differenzierung einer prä-kapillären versus einer post-kapillären pulmonalen Hypertonie helfen können (Tab. 2).
Falls die Gesamtkonstellation suggestiv ist für eine PH-LHD, kann auf einen Rechtsherzkatheter zunächst verzichtet werden, und die mutmasslich zugrunde liegende Linksherzerkrankung kann behandelt werden. Der Verlauf der PH kann nicht-invasiv verfolgt werden, und eine Regredienz der PH wird die Hypothese bzw. Diagnose indirekt bestätigen. Die einzige Klasse I-Indikation für einen Rechtsherzkatheter bei Herzinsuffizienz ist die Abklärung vor Transplantation/Assist Device-Implantation (9). Nicht immer ist die Situation aber offensichtlich, und die Abgrenzung einer PH-LHD von einer prä-kapillären PH (z.B. PH im Rahmen einer Lungenerkrankung/einer chronischen Hypoxämie oder PH bei chronischen Lungenembolien) ist bei Vorliegen mehrerer Pathologien schwierig. In solchen Situationen ist ein Rechtherzkatheter zur Identifizierung des führenden hämodynamischen Mechanismus hilfreich, insbesondere wenn eine Gruppe 1 PH (pulmonarterielle Hypertonie) differentialdiagnostisch im Raum steht (therapeutische Konsequenzen). Gemäss den 2021 ESC Leitlinien zur Diagnostik und Behandlung der Herzinsuffizienz ist ein Rechtherzkatheter auch bei Patienten mit Klappenvitien oder anderen strukturellen Defekten und gemäss Echokardiografie wahrscheinlicher PH indiziert (9). Im Kontext der schweren Aortenklappenstenose ist der prognostische Wert der invasiven Hämodynamik bei PatientInnen, die sich einem Aortenklappenersatz unterziehen, nun gut belegt (7). Ein Rechtsherzkatheter ist eine sichere Untersuchung, welche oft via eine periphere Vene durchgeführt werden kann. Allerdings sind die Druckmessungen und deren Interpretation nicht trivial und erfordern Erfahrung. Zu beachten ist, dass mPAWP und mPAP im Katheterlabor bei nüchternen PatientInnen tiefer als im Alltag sein können. Bei grenzwertigen mPAWP-Werten um 12-14 mmHg kommt eine «okkulte» post-kapilläre PH in Frage, die durch eine Volumenbelastung (NaCl-Infusion) demaskiert werden kann. Falls der mPAWP nicht zuverlässig gemessen werden kann, muss eine Bestimmung des LVEDP (zusätzlicher arterieller Zugang) in Betracht gezogen werden, wobei zu beachten ist, dass mPAWP und LVEDP nicht das gleiche messen und insbesondere bei Vorhofflimmern deutlich differieren können. Auch weniger häufige Ursachen einer PH müssen gesucht werden, beispielsweise ein «stiff left atrium» (linksatriale Dysfunktion nach wiederholten Katheterablationen) oder eine Pulmonalvenenstenose (Abbildung 2). Um diese Konstellationen hämodynamisch zu erfassen muss neben dem mPAWP zwingend auch LVEDP gemessen werden (analog Mitralstenose). Zudem müssen immer auch unerkannte Shunt-Vitien (Vorhofseptumdefekt, falsch mündende Lungenvenen) als Ursache einer PH ausgeschlossen werden.
Therapie
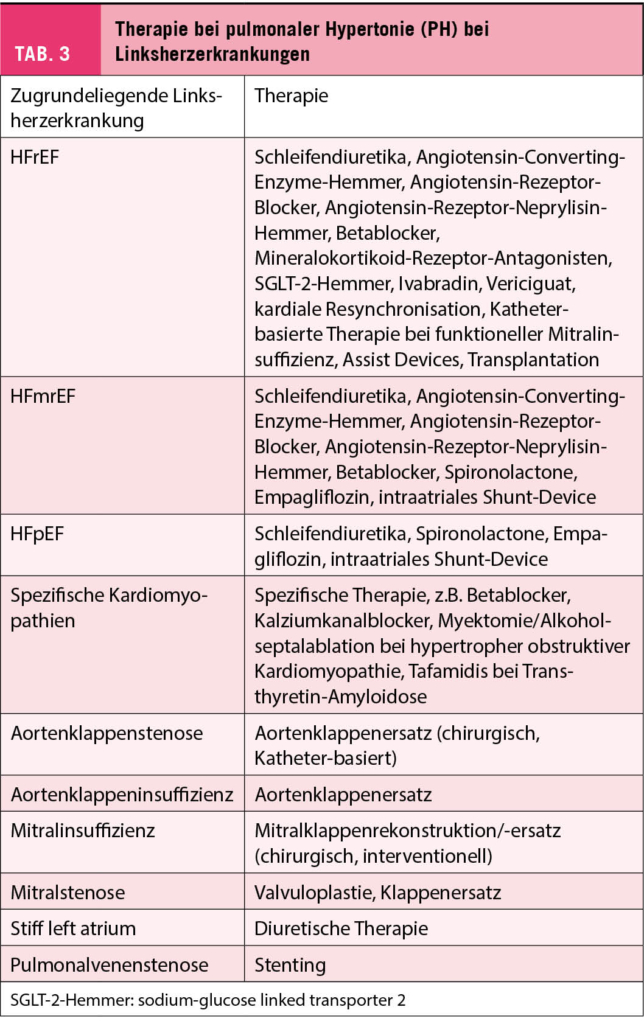
Die Therapie der PH-LHD ist grundsätzlich immer die Therapie der zugrundeliegenden Linksherzerkrankung (1, 2). Die optimale Behandlung der Grundkrankheit ist effektiv zur Behandlung und Prävention einer PH (zusammengefasst in Tabelle 3). Zu beachten ist aber, dass eine chronische PH bei später Therapie der Grundkrankheit gelegentlich nicht mehr beeinflusst werden kann. Ein klassisches Bespiel sind Klappenvitien mit CpcPH, wo auch nach Klappenersatz eine PH persistiert, da das pulmonalvaskuläre Remodeling nicht mehr voll reversibel ist. Angesichts der beschriebenen pulmonalvaskulären Komponente bei chronifizierter PH-LHD sind verschiedene Studien mit spezifischen Vasodilatatoren (spezifische Therapie der pulmonalarteriellen Hypertonie) durchgeführt worden (1, 2, 6). Diese Studien waren mehrheitlich neutral oder sogar negativ (Verschlechterung der Symptome, mehr Herzinsuffizienz-Ereignisse), so dass diese Therapien bei Patienten mit PH-LHD nicht indiziert sind. Allerdings ist die Datenlage immer noch kontrovers, vor allem für Phosphodiesterase-Inhibitoren.
Während Sildenafil in einer Studie bei PatientInnen mit HFpEF und IpcPH oder milder CpcPH keinen Effekt hatte gegenüber Plazebo, war die Substanz in einer anderen Studie bei HFpEF mit höherem PVR und eingeschränkter RV-Funktion effektiv. Andererseits hatte Sildenafil keinen Effekt bei PatientInnen mit persistierender PH nach Sanierung eines Aorten- und/oder Mitralvitiums. Eine weitere Studie zu Sildenafil bei HFpEF und CpcPH (PASSION) läuft aktuell und wird die Situation möglicherweise klären [Daten zusammengefasst in (2)]. Attraktive Daten liegen für das intraatriale Shunt-Device («Neo-Vorhofseptumdefekt») vor, welches bei selektionierten PatientInnen mit HFpEF und HFmrEF untersucht wurde: Diese Therapie führt zu einer Reduktion des mPAWP in Ruhe und unter Belastung und somit auch des mPAP. Interessanterweise war der erhöhte pulmonale Blutfluss mit einer Reduktion des PVR verbunden.
Copyright bei Aerzteverlag medinfo AG
Klinik für Kardiologie
Kantonsspital St. Gallen
Rorschacherstrasse 95
9007 St. Gallen
Der Autor hat im Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
◆ Die PH-LHD ist die häufigste Form der PH und die einzig relevante post-kapilläre PH.
◆ Die Diagnose erfolgt primär nicht-invasiv. Bei unklarer hämodynamischer Konstellation ist ein Rechtsherzkatheter aber sinnvoll.
◆ Das Vorliegen einer prä-kapillären Komponente (kombiniert prä- und post-kapilläre PH) ist prognostisch ungünstig.
◆ Die Therapie der PH-LHD besteht immer aus der optimalen Therapie der primären zugrunde liegenden kardialen Erkrankung. Eine Indikation für spezifische PAH-Therapeutika bei PH-LHD existiert aktuell nicht.
1. Maeder MT, Schoch OD, Kleiner R, Joerg L, Weilenmann D, Swiss Society For Pulmonary H. Pulmonary hypertension associated with left-sided heart disease. Swiss Med Wkly. 2017;147:w14395.
2. Maeder MT, Weber L, Buser M, Brenner R, Joerg L, Rickli H. Pulmonary Hypertension in Patients With Heart Failure With Mid-Range Ejection Fraction. Front Cardiovasc Med. 2021;8:694240.
3. Maeder MT, Weber L, Buser M, Gerhard M, Haager PK, Maisano F, et al. Pulmonary Hypertension in Aortic and Mitral Valve Disease. Front Cardiovasc Med. 2018;5:40.
4. Galie N, Humbert M, Vachiery JL, Gibbs S, Lang I, Torbicki A, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur Heart J. 2016;37(1):67-119.
5. Simonneau G, Montani D, Celermajer DS, Denton CP, Gatzoulis MA, Krowka M, et al. Haemodynamic definitions and updated clinical classification of pulmonary hypertension. Eur Respir J. 2019;53(1).
6. Vachiery JL, Tedford RJ, Rosenkranz S, Palazzini M, Lang I, Guazzi M, et al. Pulmonary hypertension due to left heart disease. Eur Respir J. 2019;53(1).
7. Maeder MT, Weber L, Rickli H. Pulmonary hypertension in aortic valve stenosis. Trends Cardiovasc Med. 2020.
8. Weber L, Rickli H, Haager PK, Joerg L, Weilenmann D, Chronis J, et al. Hemodynamics Prior to Valve Replacement for Severe Aortic Stenosis and Pulmonary Hypertension during Long-Term Follow-Up. J Clin Med. 2021;10(17).
9. McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Bohm M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-726.
info@herz+gefäss
- Vol. 12
- Ausgabe 2
- März 2022