- Zentrale Rolle der systemischen Inflammation
Nach weiteren neutralen Studienergebnissen mit pharmakologischen Hoffnungsträgern wie Sacubitril/Valsartan oder den Guanylat-Zyklase Aktivatoren bleibt die Herzinsuffizienz mit erhaltener Auswurffraktion (HFpEF) ein Sorgenkind.
Bisher konnten lediglich Sport und Gewichtsreduktion die Leistungsintoleranz und Lebensqualität verbessern. Ein besseres Verständnis der Pathophysiologie dieser heterogenen Erkrankung ist deshalb dringend von Nöten. Neuste Erkenntnisse der Pathophysiologie der HFpEF untermauern die zentrale Rolle der systemischen Inflammation und erweitern den Bogen von der reinen diastolischen Dysfunktion zum Multiorgan-Syndrom.
Selon d’ autres résultats d’ études neutres portant sur des produits pharmacologiques prometteurs comme le sacubitrile/valsartan ou les activateurs de la guanylate cyclase, l’ insuffisance cardiaque avec fraction d’ éjection préservée (HFpEF) reste un problème. Jusqu’ à présent, seuls le sport et la réduction du poids ont permis d’ améliorer l’ intolérance à la performance et la qualité de vie. Une meilleure compréhension de la physiopathologie de cette maladie hétérogène est donc nécessaire de toute urgence. De récentes découvertes dans la physiopathologie de la HFpEF soulignent le rôle central de l’ inflammation systémique et élargissent l’ arc du dysfonctionnement diastolique pur au syndrome multi-organes.
Bei über 50% aller Patienten, die sich mit einer symptomatischen Herzinsuffizienz in der Praxis/Klinik vorstellen, liegt eine Herzinsuffizienz mit erhaltener Auswurffraktion (HFpEF) zugrunde. Aufgrund der immer älter werdenden Bevölkerung und den pandemisch verbreiteten kardiovaskulären Risikofaktoren (Hypertonie, Diabetes, Dyslipidämie, Adipositas, körperlicher Inaktivität) wird die Prävalenz der HFpEF auch in den kommenden Jahren weiter ansteigen. Diese Aussichten sind umso besorgniserregender, da die Morbidität und Mortalität bei HFpEF nur unwesentlich geringer als bei HFrEF sind und bis heute keine prognostisch wirksamen pharmakologischen Therapien zur Behandlung der HFpEF zur Verfügung stehen.
Für die Diagnose einer HFpEF müssen folgende Kriterien erfüllt sein: 1) Klinische Zeichen und Symptome einer Herzinsuffizienz;
2) Linksventrikuläre Ejektionsfraktion (LVEF) > 50% zusammen mit funktionellen / strukturellen Veränderungen in der Echokardiografie; 3) Nachweis von erhöhten Füllungsdrücken (1). Die erhöhten linksseitigen Füllungsdrücke können entweder direkt durch eine Rechtsherzkatheteruntersuchung (Wedge-Druck) oder Linksherzkatheteruntersuchung (Enddiastolischer LV Füllungsdruck) gemessen werden (Goldstandard). Im klinischen Alltag werden meist nichtinvasive Techniken mittels Echokardiografie und/oder Bestimmung der natriuretischen Peptide (NT-proBNP, BNP) zur indirekten Abschätzung der Füllungsdrücke verwendet.
Eine HFpEF ist mehr als eine diastolische Dysfunktion
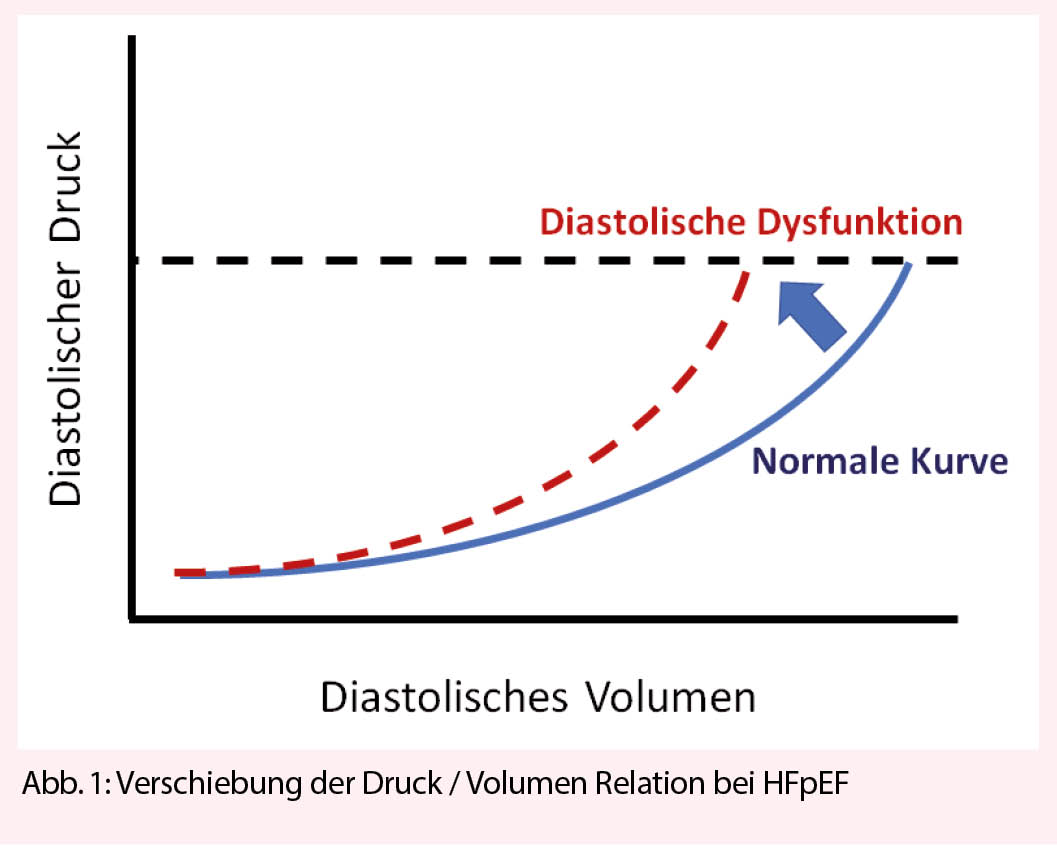
Die Pathophysiologie der HFpEF ist sehr heterogen und noch nicht abschliessend geklärt. Während Jahrzehnten wurde der pathophysiologische Fokus ausschliesslich auf die diastolische Dysfunktion des linken Ventrikels gelegt. Die erhöhte Steifigkeit und verminderte Compliance des linken Ventrikels stehen dabei mechanisch im Zentrum der diastolischen Füllungsstörung. Physiologisch lässt sich die Diastole in drei Phasen unterteilen: 1) Aktive isovolumetrische, ventrikuläre Relaxation (energieabhängig); 2) Passive LV-Füllung entlang des transmitralen Druckgradienten; 3) Atriale Kontraktion. Eine Störung einer einzelnen oder mehrerer dieser Komponenten führt zu einer unvollständigen Ventrikelfüllung. Um eine vollständige Ventrikelfüllung und damit ein adäquates Schlagvolumen zu gewährleisten, muss der Füllungsdruck ansteigen. Deshalb ist der enddiastolische Füllungsdruck für ein vorgegebenes Volumen im Vergleich zum Herzgesunden erhöht. In der klassischen Druck-Volumenkurve zeigt sich dieser Effekt in einer Verschiebung der Kurve nach links oben (Abb. 1). Durch die chronisch erhöhten LV-Füllungsdrücke steigen auch die Füllungsdrücke im linken Atrium und im benachbarten pulmonal-venösen System, was wiederum zur pulmonal-venösen (postkapillären) Hypertonie und schlussendlich zur Dyspnoe führt.
Obwohl dieser traditionelle Erklärungsansatz im Grundsatz nachvollziehbar und richtig ist, greift er in Bezug auf die komplexe Pathophysiologie der HFpEF zu kurz. Eine isolierte diastolische Dysfunktion ist noch lange nicht ein Garant für eine Herzinsuffizienz. Deshalb muss die exklusive Rolle des Myokardes in der Pathogenese der HFpEF hinterfragt werden. Ausserdem hat die neuro-hormonelle Inhibition und Modulation mit ACE-Hemmern, ARNI, Betablockern und Mineralocorticoid-Rezeptor Blockern, welche bei der Therapie der Herzinsuffizienz mit reduzierter Auswurffraktion (HFrEF) ausnahmslos erfolgreich war, zu keiner wesentlichen Verbesserung der Symptomatik und Prognose bei HFpEF geführt. Es ist deshalb anzunehmen, dass sich die zugrunde liegenden pathophysiologischen Mechanismen und Signalwege bei HFrEF und HFpEF, sowohl systemisch als auch im Myokard, deutlich unterscheiden.
Chronische systemische Inflammation: Primum movens der HFpEF
Eine HFpEF ist typischerweise mit Komorbiditäten wie Adipositas (84%), arterielle Hypertonie (60-80%), Diabetes Mellitus Typ II (20-45%), Niereninsuffizienz und dem Schlaf-Apnoe Syndrom vergesellschaftet (2). Diese Komorbiditäten unterhalten eine chronische systemische sterile Inflammation durch Aktivierung von Zytokin-produzierenden Prozessen, unabhängig von einer eigentlichen Infektion. Obwohl auch bei HFrEF erhöhte inflammatorische Zytokine gemessen werden, ist deren Erhöhung bei HFpEF noch ausgeprägter. In der Health, Aging and Body Composition (ABC) Studie waren erhöhte Tumor Nekrose Faktor alpha (TNFa) Werte deutlich mit einer Entwicklung einer HFpEF innerhalb von 10 Jahren assoziiert, wohingegen eine solche Assoziation mit HFrEF fehlte (3). Dieser chronische Entzündungsprozess und die darin involvierten Signal-Kaskaden konnten in den letzten Jahren von verschiedenen Arbeitsgruppen aufgeschlüsselt und direkt in Verbindung mit der Pathogenese der HFpEF gebracht werden. Die Entzündung des mikrovaskulären Endothels spielt dabei eine zentrale Rolle. Durch das entzündlich aktivierte Endothel wandern aktivierte Makrophagen in das Myokard und stören die parakrine Balance zwischen Endothelzellen und Kardiomyozyten. Dies führt zu einer Unterversorgung von Stickstoffmonoxid (NO) und zyklischem Guanosinmonophosphat (cGMP). Die NO-cGMP-Signal Kaskade ist sowohl für die Endothelfunktion als auch für den Kardiomyozyten essentiell. Ein Mangel führt zur Hypertrophie und Versteifung des Myokards (4). Die extramyokardiale Genese der HFpEF wurde in einem parabiotischen Experiment untermauert, indem junge Mäuse durch chronische Transfusion von Blut von alten Tieren einen HFpEF Phänotyp entwickelten. Andererseits konnte der HFpEF Phänotyp von alten Mäusen durch die Transfusion von Jungblut revertiert werden (5). Somit unterscheidet sich die Pathogenese des myokardialen Remodellings bei HFpEF grundsätzlich von derjenigen der HFrEF. Während bei HFrEF hauptsächlich intramyokardiale Prozesse wie der Ischämie-bedingte oder toxische Zelluntergang ein Remodelling triggern, sind es bei der HFpEF extramyokardiale systemisch-entzündliche Prozesse, welche über die Kommunikation zwischen Endothel und Myokard Remodellingprozesse anstossen. Diese Unterschiede wiederspiegeln sich auch in markanten strukturellen und ultrastrukturellen Unterschieden der jeweiligen Myokardbeschaffenheit.
Viszerale und epikardiale Adipositas
Die Adipositas ist die häufigste mit HFpEF assoziierte Komorbidität. Insbesondere die viszerale Adipositas potenziert eine systemische Inflammation und prädisponiert so Patienten mit Hypertonie oder Diabetes für eine HFpEF. Eine Adipositas fördert die Natrium Resorption in den Nieren und vermindert die Kapazitäten für ein venöses Blut-Pooling. Dies resultiert in einer Expansion des zentralen Blutvolumens, was von einem kleinen, steifen linken Ventrikel äusserst schlecht toleriert wird. In den letzten Jahren wurde auch das epikardiale Fettgewebe als wichtiger Mediator einer HFpEF identifiziert (6). Die Adipositas und andere für eine HFpEF prädisponierende entzündliche und metabolische Erkrankungen gehen mit einer Zunahme des epikardialen Fettgewebes einher. Das epikardiale Fettgewebe ist ein inflammatorisch-sekretorisch äusserst aktives Gewebe. Durch die unmittelbare Nähe zum Myokard mit gemeinsamer Mikrozirkulation wirkt das epikardiale Fettgewebe wie ein Resonanzkörper der systemischen Inflammation direkt auf das Myokard. Das epikardiale Fettvolumen ist direkt mit dem Schweregrad der koronaren mikrovaskulären Dysfunktion und der LV-Hypertrophie assoziiert und korreliert mit dem Ausmass der diastolischen Dysfunktion und dem links-atrialen Volumen. Auch Vorhofflimmern ist mit dem Ausmass der «epikardialen Adipositas» assoziiert.
Geschlechterunterschiede bei HFpEF
Es ist allgemein bekannt, dass Frauen ein höheres Risiko haben, eine HFpEF zu entwickeln als Männer. Frauen verfügen über ein kleineres linksventrikuläres Volumen (auch indexiert auf die Körperoberfläche). Umso mehr ist das Schlagvolumen abhängig von einer höheren Ejektionsfraktion. Weitere Gründe für diese geschlechtsspezifische Prädominanz lassen sich gut durch die oben erwähnten pathophysiologischen Mechanismen herleiten. Einerseits ist die Prävalenz inflammatorischer und metabolischer Erkrankungen, sowie die Ausprägung des epikardialen Fettgewebes grösser bei Frauen, andererseits verfügen vor allem ältere Frauen über eine geringere diastolische Reserve und einen steileren Anstieg des pulmonal-venösen Druckes im Verhältnis zur Volumenüberlastung als Männer. Auch führen die beiden Hauptkatalisatoren einer inflammatorisch-metabolischen HFpEF, Adipositas und Diabetes, zu ausgeprägteren kardialen Veränderungen bei Frauen. Im Gegensatz zu Männern sind Adipositas und Diabetes wesentliche Determinanten einer erhöhten Myokardmasse bei älteren Frauen. Auch die zentrale Adipositas wirkt sich geschlechterspezifisch unterschiedlich aus, indem sie bevorzugt bei Frauen die altersabhängige vaskuläre Steifigkeit akzeleriert.
Chronotrope Inkompetenz und gestörtes ventrikulär-arterielles Coupling
Das Herzminutenvolumen in Ruhe ist bei HFpEF Patienten meist erhalten. Die Steigerungsreserven unter körperlicher Belastung sind aber oft deutlich reduziert. Einerseits gelingt es dem steifen Ventrikel nicht, das Schlagvolumen adäquat zu steigern, andererseits verhindert eine chronotrope Inkompetenz, den Anforderungen des Körpers an die Belastung gerecht zu werden. Die Herzfrequenz-Antwort steht in direkter Beziehung zur maximalen Sauerstoffaufnahme und ist deshalb zentral für eine normale körperliche Leistungsfähigkeit. Eine zusätzliche Hemmung der Chronotropie durch Betablocker oder Ivabradin wirkt sich deshalb oft besonders limitierend auf die körperliche Leistungsfähigkeit bei HFpEF Patienten aus (7).
HFpEF ist auch durch eine erhöhte Steifigkeit der grossen zentralen Arterien gekennzeichnet. Die steifen Arterienwände führen zu einer vermehrten retrograden Reflexion von Pulswellen in Richtung Ventrikel. Diese reflektierten Pulswellen treffen noch während der Systole auf den Ventrikel und potenzieren so dessen Nachlast, was wiederum die Hypertrophie und Fibrosierung des Ventrikels fördert.
HFpEF als Multiorganerkrankung mit unterschiedlichen klinischen Phänotypen
Die durch die chronische Inflammation verursachten mikrovaskulären Störungen betreffen nicht nur die Mikrovaskulatur des Herzens, sondern auch in unterschiedlicher Ausprägung Lunge, Niere und Skelettmuskulatur. Die Involvierung dieser Organsysteme trägt wesentlich zum HFpEF Syndrom und der damit verbundenen Leistungsintoleranz bei. Zusätzlich zu den erhöhten Füllungsdrücken potenziert bei manchen Patienten eine inadäquate Vasokonstriktion des pulmonalen Gefässbettes die postkapilläre pulmonale Hypertonie (7). Eine verminderte Vasodilatation der Kapillaren der peripheren Muskulatur reduziert die maximale arterio-venöse Sauerstoffausschöpfung (8). Dadurch werden die Metabolik und Leistungsfähigkeit der Skelettmuskulatur verschlechtert. Schliesslich führen die inflammatorischen Prozesse in den Nieren zu einer verminderten Kochsalzausscheidung, was wiederum die Hypervolämie unterhält.
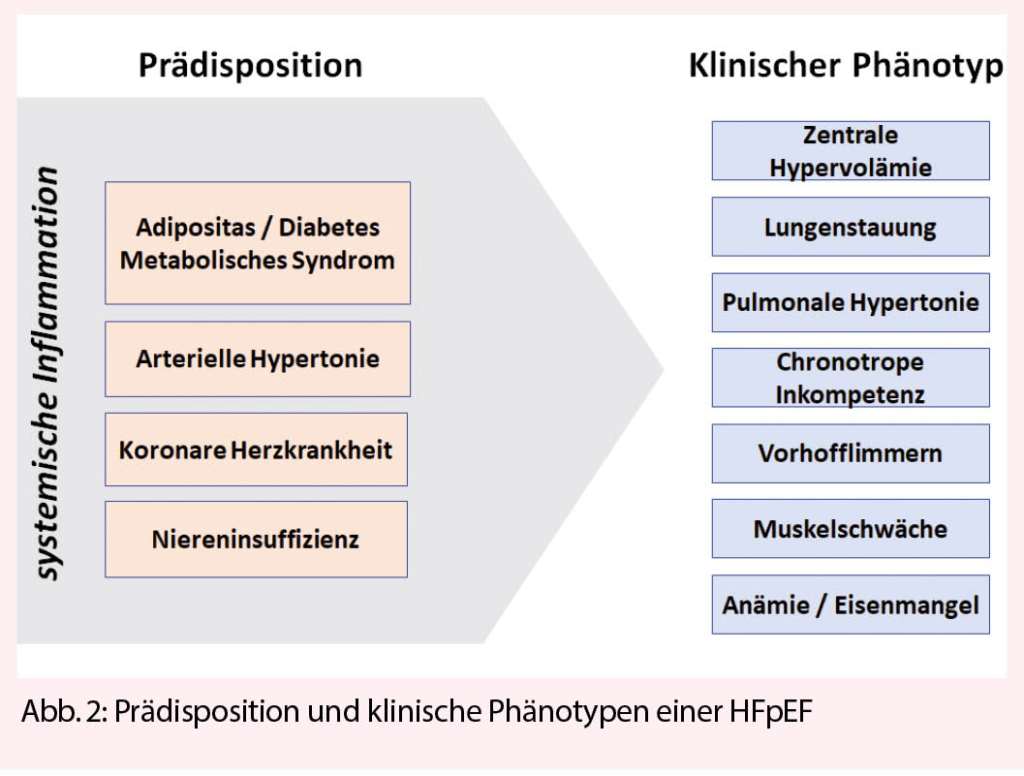
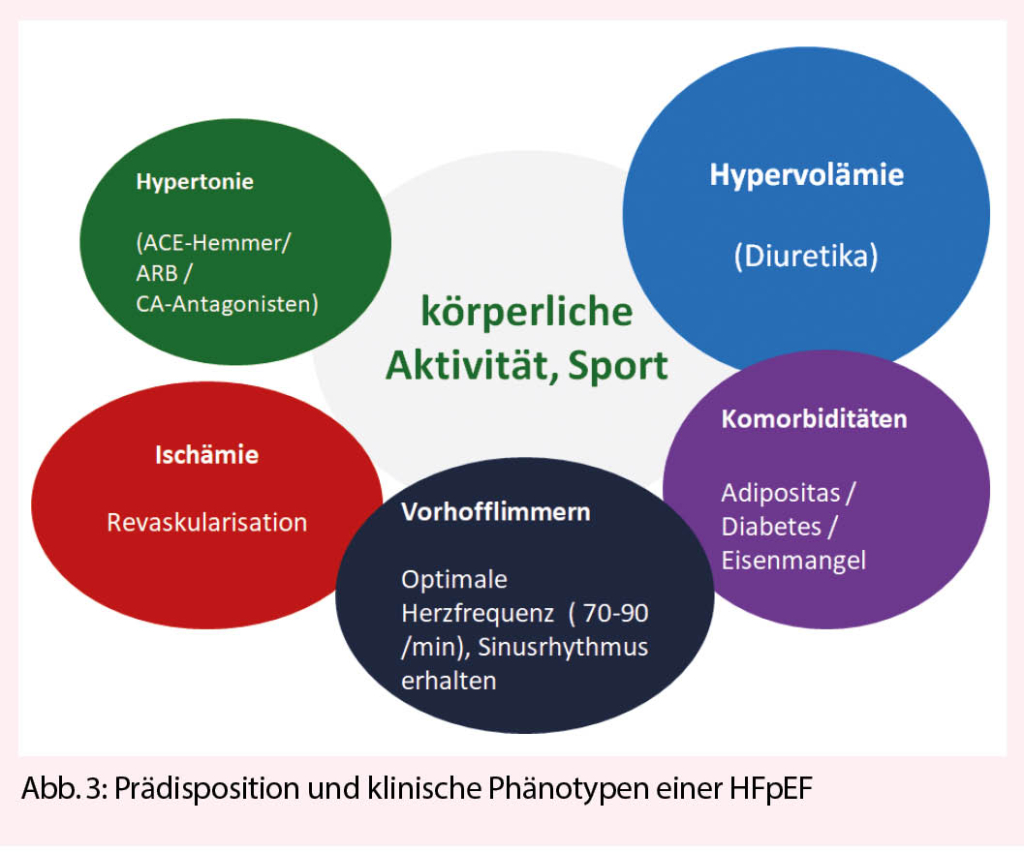
Aufbauend auf diesen Beobachtungen können je nach Auslöser einer HFpEF und Ausprägung der kardialen und extrakardialen mikrovaskulären Störungen verschiedene klinische HFpEF Phänotypen unterschieden werden (Abb. 2). Es bleibt zu hoffen, dass in absehbarer Zukunft doch noch ein universales HFpEF Therapeutikum gefunden wird. Bis es soweit ist, müssen wir uns mit der optimalen Therapie der prädisponierenden Faktoren und des dominierenden klinischen Phänotypen begnügen (Abb. 3). Besonderes Augenmerk gilt der Prävention einer HFpEF. Ganz nach dem Motto von Benjamin Franklin: An ounce of prevention is worth a pound of cure.
Copyright bei Aerzteverlag medinfo AG
Klinik für Kardiologie
Universitätsspital Basel
Petersgraben 4
4031 Basel
otmar.pfister@usb.ch
Die Autoren deklarieren keinen Interessenskonflikt im Zusammenhang mit der vorliegenden Arbeit.
◆ Die Herzinsuffizienz mit erhaltener Auswurffraktion (HFpEF) ist eine inflammatorische Systemerkrankung mit multiplen pathophysiologischen Manifestationen und klinischen Phänotypen
◆ Das myokardiale Remodelling bei HFpEF wird wesentlich durch extramyokardiale Entzündungsprozesse mitverursacht
◆ Viszerales und epikardiales Fett spielen bei der Pathogenese einer HFpEF eine wichtige Rolle
◆ Die chronotrope Inkompetenz, der dysproportionale Anstieg des pulmonal-venösen Drucks sowie eine verminderte Sauerstoffextraktion der Skelettmuskulatur tragen wesentlich zur Leistungsintoleranz bei HFpEF bei
Messages à retenir
◆ L’ insuffisance cardiaque avec fraction d’ éjection préservée (HFpEF) est une maladie systémique inflammatoire présentant de multiples manifestations physiopathologiques et phénotypes cliniques
◆ Le remodelage du myocarde dans la HFpEF est principalement causé par des processus inflammatoires extramyocardiques
◆ La graisse viscérale et épicardique joue un rôle important dans la pathogenèse de l’ HFpEF
◆ L’ incompétence chronotropique, l’ augmentation dysproportionnelle de la pression veineuse pulmonaire et une extraction réduite d’ oxygène de la musculature squelettique contribuent de manière significative à l’ intolérance aux performances de la HFpEF
1. Pieske B, Tschope C, de Boer RA, Fraser AG, Anker SD, Donal E, Edelmann F, Fu M, Guazzi M, Lam CSP, Lancellotti P, Melenovsky V, Morris DA, Nagel E, Pieske-Kraigher E, Ponikowski P, Solomon SD, Vasan RS, Rutten FH, Voors AA, Ruschitzka F, Paulus WJ, Seferovic P and Filippatos G. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur Heart J. 2019;40:3297-3317.
2. Shah SJ, Kitzman DW, Borlaug BA, van Heerebeek L, Zile MR, Kass DA and Paulus WJ. Phenotype-Specific Treatment of Heart Failure With Preserved Ejection Fraction: A Multiorgan Roadmap. Circulation. 2016;134:73-90.
3. Kalogeropoulos A, Georgiopoulou V, Psaty BM, Rodondi N, Smith AL, Harrison DG, Liu Y, Hoffmann U, Bauer DC, Newman AB, Kritchevsky SB, Harris TB, Butler J and Health ABCSI. Inflammatory markers and incident heart failure risk in older adults: the Health ABC (Health, Aging, and Body Composition) study. J Am Coll Cardiol. 2010;55:2129-37.
4. van Heerebeek L, Hamdani N, Falcao-Pires I, Leite-Moreira AF, Begieneman MP, Bronzwaer JG, van der Velden J, Stienen GJ, Laarman GJ, Somsen A, Verheugt FW, Niessen HW and Paulus WJ. Low myocardial protein kinase G activity in heart failure with preserved ejection fraction. Circulation. 2012;126:830-9.
5. Loffredo FS, Steinhauser ML, Jay SM, Gannon J, Pancoast JR, Yalamanchi P, Sinha M, Dall’Osso C, Khong D, Shadrach JL, Miller CM, Singer BS, Stewart A, Psychogios N, Gerszten RE, Hartigan AJ, Kim MJ, Serwold T, Wagers AJ and Lee RT. Growth differentiation factor 11 is a circulating factor that reverses age-related cardiac hypertrophy. Cell. 2013;153:828-39.
6. Packer M. Epicardial Adipose Tissue May Mediate Deleterious Effects of Obesity and Inflammation on the Myocardium. J Am Coll Cardiol. 2018;71:2360-2372.
7. Pal N, Sivaswamy N, Mahmod M, Yavari A, Rudd A, Singh S, Dawson DK, Francis JM, Dwight JS, Watkins H, Neubauer S, Frenneaux M and Ashrafian H. Effect of Selective Heart Rate Slowing in Heart Failure With Preserved Ejection Fraction. Circulation. 2015;132:1719-25.
8. Dhakal BP, Malhotra R, Murphy RM, Pappagianopoulos PP, Baggish AL, Weiner RB, Houstis NE, Eisman AS, Hough SS and Lewis GD. Mechanisms of exercise intolerance in heart failure with preserved ejection fraction: the role of abnormal peripheral oxygen extraction. Circ Heart Fail. 2015;8:286-94.
info@herz+gefäss
- Vol. 11
- Ausgabe 3
- Mai 2021