- Zirrhotische Kardiomyopathie
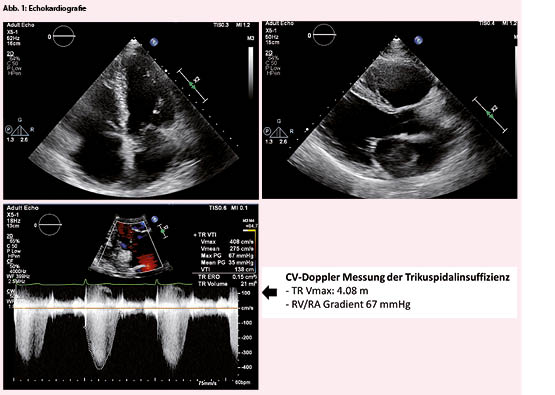
Klinisch präsentierte sich eine adipöse Patientin (BMI 34) mit hochnormalen Blutdruckwerten (BD 138/72 mmHg), einem 2/6 Holosystolikum über Erb und leichten peripheren Oedemen sowie gestauten Halsvenen. Im EKG konnte ein bradykarder Sinusrhythmus (59/min) sowie eine Linkslage bei unauffälligem Erregungsablauf und normwertigen Zeitintervallen dokumentiert werden. Das NT-proBNP war mit 464 ng/L erhöht. Echokardiografisch zeigte sich ein beginnend exzentrisch hypertropher linker Ventrikel mit normaler systolischer Pumpfunktion (LVEF 65%), ein leicht dilatierter rechter Ventrikel mit guter Funktion, dilatierte Vorhöfe beidseits, Hinweise für ein pseudonormales Füllungsmuster (diastolische Dysfunktion Grad II) sowie eine mittelschwere Mitral- und Trikuspidalinsuffizienz bei Anulusdilatation. Neu im Vergleich zum Vorbefund vor 3 Jahren imponierte ein deutlich erhöhter RV/RA Gradient (67 mmHg) über der Trikuspidalklappe als Hinweis für eine pulmonale Hypertonie (PH) (Abb. 1). Die Vena Cava inferior war dilatiert und reduziert atemvariabel.
Differentialdiagnostische Überlegungen und weitere Diagnostik
Aufgrund der echokardiografischen Befunde muss von einer pulmonalen Hypertonie und/ oder einer Herzinsuffizienz mit erhaltener systolischer Pumpfunktion (HFpEF) ausgegangen werden. Angesichts der langjährigen Leberzirrhose mit etablierter portaler Hypertonie wäre eine porto-pulmonale Hypertonie denkbar. Diese kommt bei ca. 5-10% der Patienten mit fortgeschrittener Leberzirrhose vor. Ebenso könnten chronische Lungenembolien vorliegen. Sowohl die porto-pulmonale Hypertonie als auch chronische Lungenembolien würden zu einer präkapillären «pulmonal-arteriellen» PH führen. Andererseits sind die Befunde unserer Patientin differentialdiagnostisch auch mit einer HFpEF vereinbar, welche eine postkapilläre «pulmonal-venöse» PH verursachen kann.
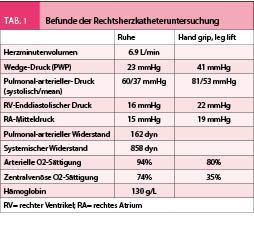
Da weder die Klinik noch die echokardiografischen Befunde oder die NT-proBNP Werte in dieser Situation diagnostisch wegweisend sind, wurde als nächster Schritt eine Rechtsherzkatheter-Untersuchung veranlasst. Dabei zeigte sich ein deutlich erhöhter Wedge-Druck (23 mmHg) mit entsprechender postkapillärer pulmonaler Hypertonie (PAPsyst 60mmHg; PAPmean 37mmHg). Das Herzminutenvolumen war mit 7 Litern erhöht bei tiefem Systemwiderstand (858 dyn). Hinweise für eine präkapilläre Komponente ergaben sich nicht. Unter leichter körperlicher Belastung konnte ein starker Anstieg des Wedge-Drucks (41 mmHg), sowie der pulmonalen Druckwerte begleitet von stark einsetzender Dyspnoe dokumentiert werden (Tab. 1). Eine koronare Herzkrankheit konnte bei normalen Koronararterien im Linksherzkatheter ausgeschlossen werden.
Aufgrund der vorliegenden Befunde wurde bei dieser Patientin mit Leberzirrhose CHILD A und Status nach TIPS Implantation die Diagnose einer zirrhotischen Kardiomyopathie mit HFpEF gestellt.
Diskussion
Die zirrhotische Kardiomyopathie (CCM) bezeichnet eine kardiale Dysfunktion bei Patienten mit fortgeschrittener Lebererkrankung nach Ausschluss vorbestehender Herzerkrankungen. Eine CCM kann sowohl als Herzinsuffizienz mit reduzierter systolischer Auswurffraktion (HFrEF) als auch als HFpEF auftreten (1). Das durch die zirrhotische Leber begünstigte porto-systemische Shunting führt zur Ausschwemmung von vasodilatatorischen Leberstoffen, welche durch Reduktion des Systemwiderstandes und Erhöhung des Herzminutenvolumens zu einer hyperdynamen Kreislaufsituation führen. Typisch für die CCM ist, dass trotz dieser hyperdynamen Situation eine Herzinsuffizienz mit ausgeprägter Belastungsintoleranz besteht. Ursächlich sind die im Rahmen der Leberinsuffizienz zirkulierenden inflammatorischen Faktoren verantwortlich, welche sich negativ auf die diastolische und systolische Reserve des Myokardes auswirken. Nach einer TIPS Implantation kommt es zu zusätzlichen hämodynamischen Veränderungen, indem durch den porto-systemischen Shunt der Leberwiderstand abnimmt und die kardiale Vorlast zunimmt. Dadurch kommt es in bis zu 20% der Patienten nach TIPS Einlage zu einer kardialen Dekompensation. Da eine vormals kompensierte CCM durch eine TIPS Einlage dekompensieren kann, sollte vor jeder TIPS Einlage eine kardiologische Evaluation und Risikostratifizierung stattfinden (2).
Copyright bei Aerzteverlag medinfo AG
Klinik für Kardiologie
Universitätsspital Basel
Petersgraben 4
4031 Basel
otmar.pfister@usb.ch
Der Autor deklariert keinen
Interessenskonflikt im Zusammenhang mit der vorliegenden Arbeit.
1. Izzy M et al. Redefining cirrhotic cardiomyopathy for the modern era. Hepatology 2020; 71: 334-345
2. Billey C et al. A prospective study identifying predictive factors of cardiac decompensation after transjugular portosystemic shunt: The Toulouse Algorithm. Hepatology 2019; 70; 1928-1941
info@herz+gefäss
- Vol. 11
- Ausgabe 2
- März 2021






