- Akute myeloische Leukämie im Kindes- und Jugendalter
Die pädiatrische AML ist seltener aber aggressiver als die ALL. Heutzutage können ca. 60% der Patienten geheilt werden. Dieser Erfolg konnte erreicht werden, einerseits durch die Intensivierung der konventionellen Chemotherapie, eine umfassende supportive Therapie und eine sorgfältige Behandlung von Komplikationen und Rezidiven, andererseits durch eine zunehmend individualisierte prognostische Einordnung zum optimalen Einsatz verfügbarer Therapieoptionen.
La leucémie myéloïde aiguë pédiatrique est plus rare mais plus agressive que la leucémie lymphoblastique aigüe (LLA). Aujourd’ hui, environ 60 % des patients peuvent être guéris. Ce succès a été obtenu d’ une part par l’ intensification de la chimiothérapie conventionnelle, une thérapie de soutien complète et un traitement soigneux des complications et des récidives et, d’ autre part, par une classification pronostique de plus en plus individualisée pour une utilisation optimale des options thérapeutiques disponibles.
Epidemiologie
Die akute myeloische Leukämie (AML) gilt allgemein als Erkrankung des älteren Menschen. Bei jungen Leuten unter 20 Jahren hat sie eine Inzidenz von etwa 0,7 / 100.000 / Jahr (1). Wie bei den Erwachsenen wird zwischen primären und sekundären AML unterschieden. Die primären (oder «de novo») AML sind beim Kind deutlich häufiger und zeigen sich als akutes Krankheitsbild. Sekundäre AML entwickeln sich auf der Basis eines myelodysplastischen Syndroms (MDS) oder im Verlauf einer angeborenen (Fanconi Anämie, schwere kongenitale Neutropenie, Shwachman-Diamond Syndrom, Dyskeratosis congenita, u.a.) oder erworbenen aplastischen Anämie. Kinder mit Trisomie 21 haben ein 15-fach erhöhtes Risiko an Leukämie zu erkranken und entwickeln typischerweise ein transientes myeloproliferatives Syndrom als Neugeborene oder später das Vollbild einer AML, i.d.R. einer akuten megakaryozytischen Leukämie (AMKL-DS) (2).
Therapieinduzierte AML (t-AML) oder MDS (t-MDS) entstehen klassischerweise als Zweitmalignome einige Jahre nach Einsatz gewisser Zytostatika, die bekanntermassen kanzerogen wirken, insbesondere Anthrazykline und Epipodophyllotoxine (FAB M4 oder M5 Morphologie, typischerweise mit MLL-Rearrangement 11q23), Alkylantien (häufig mit Monosomie 7 oder Deletion 5q-) oder nach Radiotherapie.
Pathologie
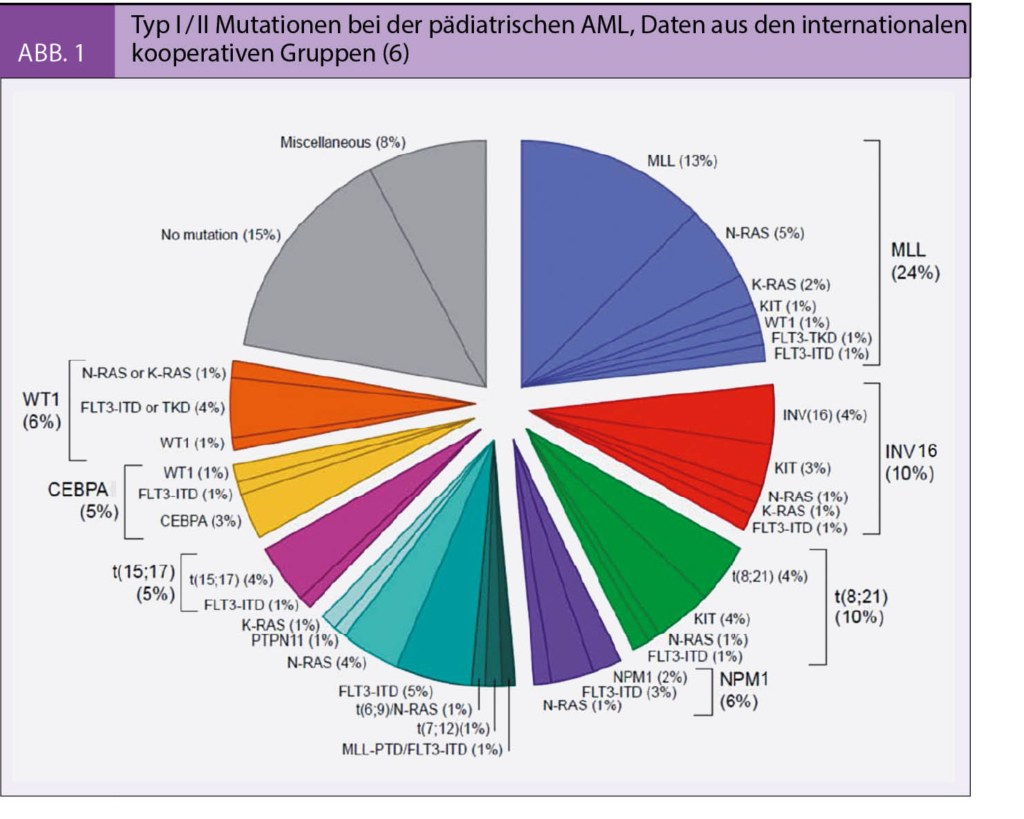
Bei der AML kommt es in frühen Progenitoren der Myelopoese oder in hämatopoetischen Stammzellen zur malignen Entartung. Zum Auftreten der offenen Leukämie sind wahrscheinlich mindestens zwei genetische Ereignisse in einem Zellklon erforderlich, die auch in grösserem zeitlichem Abstand auftreten können (3). Zudem spielen weitere Faktoren wie vulnerable Phasen der Immunentwicklung oder Veränderungen des Knochenmark-Mikroenvironments eine Rolle (4). Es gilt als gesichert, dass eine Differenzierungshierachie vorliegt, das heisst, dass sich der Grossteil der leukämischen Blasten aus der originären leukämischen Stammzelle (Stammzellklon) entwickelt (5). Bei der Mehrzahl der AML können leukämieassozierte zyto- und molekulargenetische Veränderungen nachgewiesen und entsprechend der Einteilung von Gilliland et al. als Typ I oder Typ II Mutationen (Abb. 1) eingeordnet werden, die entweder isoliert oder kombiniert nachweisbar sind (6). In einer umfassenden europäischen Kollaboration zur AML bei Kindern und Jugendlichen konnten die Häufigkeit und prognostische Relevanz dieser Mutationen belegt werden (7, 8, 9). Heutzutage sind diese Erkenntnisse ans Licht der Entwicklung molekular wirkender Substanzen, die als individualisierte, rationale Therapieoptionen infrage kommen, von besonderer Bedeutung.
Therapie
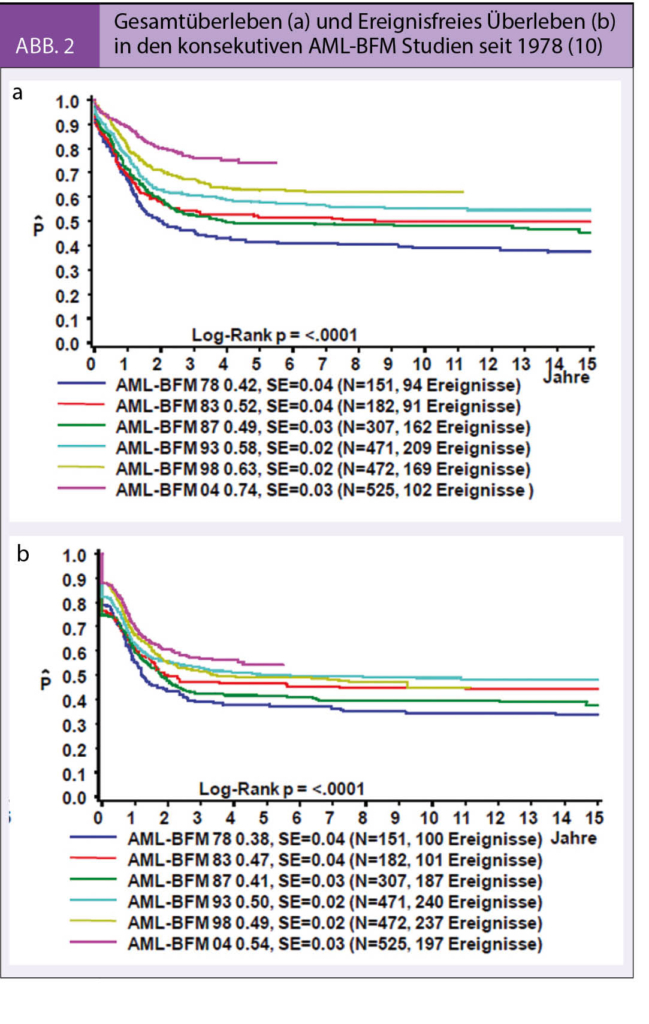
Die Prognose der pädiatrischen AML hat sich im Laufe der letzten 40 Jahre dank der Entwicklung und Umsetzung internationaler Therapieoptimierungsstudien (u. a. AML-BFM Gruppe in Europa, POG / COG in Amerika) kontinuierlich verbessert. Die 10-Jahres-Überlebensrate lag Ende der 70-er Jahre bei 42% und konnte bis heute auf 74% verbessert werden (Abb. 2) (10). Dieser Fortschritt wurde einerseits durch die Verbesserung der Kenntnisse der Molekularbiologie der AML mit anschliessender Verfeinerung der Therapiestratifizierung der Patienten, andererseits durch eine deutliche Intensivierung der Primärtherapie –insbesondere der Induktionstherapie – sowie durch verbesserte prophylaktische und supportive Massnahmen erreicht. Hinzu kommt eine konsequentere und verstärkte Behandlung der Rezidive (11). Weltweit wird aktuell die pädiatrische AML mit kurzen und intensiven Therapieblöcken behandelt, welche hauptsächlich aus Cytosinarabinosid (Ara-C) in verschiedenen Dosenintensitäten, Anthrazyklinen (Daunorubicin, liposomales Daunorubicin, Idarubicin und Mitoxantron) sowie Etoposid bestehen.
Wie in der ALL hat auch in der AML, neben den genetischen und biologischen Eigenschaften der Krankheit, das frühe Therapieansprechen einen sehr hohen prognostischen Stellenwert. Die Entwicklung hochsensitiver Methoden zur Erfassung der sogenannten minimal residuellen Erkrankung (minimal residual disease, MRD) und die entsprechende Anpassung der Therapieintensität, insbesondere früh in der Behandlung, haben somit eine zentrale Rolle in der Besserung der Resultate gespielt. Zur MRD-Bestimmung kommen prinzipiell methodisch die Morphologie, Immunphänotypisierung, Monitoring von genetischen Aberrationen (FISH) oder Fusionsgenen (qPCR), Monitoring ausgewählter Genexpressionen und die Nachverfolgung von klonspezifischen Mutationen (qPCR) infrage.
Die verschiedenen diagnostischen Methoden unterscheiden sich insbesondere hinsichtlich der Sensitivität (Morphologie <FISH < Immunphänotypisierung < qPCR) und Spezifität (Mutationen > Fusionsgene > FISH > Immunphänotypisierung > Morphologie) (12). Wichtige Aspekte der Anwendung dieser Technologien sind darüber hinaus die Zielsetzung und der Zeitpunkt innerhalb der einzelnen Therapiephasen. Für die Bestimmung des Therapieansprechens können prinzipiell alle Methoden herangezogen werden, da es in erster Linie auf die Kinetik ankommt. Für das spätere Monitoring, mit der Zielsetzung ein drohendes Rezidiv (molekulares Rezidiv) frühzeitig zu erkennen, kommen nur sehr spezifische und sensitive Methoden infrage.
Die zunehmenden Verbesserungen der diagnostischen Methoden (multi-color-Flowcytometry) und die Identifikation neuer Mutationen (FLT3-ITD/TDK, NPM1, c-kit, ras, CEBPΑ etc.) könnten die Aussagefähigkeit der MRD-Diagnostik entscheidend verbessern und eine noch geeignetere Therapiestratifizierung sowohl im Sinne der Therapiereduktion bei gutem Ansprechen als auch der Intensivierung bei ungünstigem Ansprechen ermöglichen (13).
Dieses bekommt einen umso höheren Stellenwert, als dass durch die Einführung einer Vielzahl neuer Inhibitoren/molekular wirksamer Substanzen, zusätzliche Werkzeuge zur Bestimmung des Therapieansprechens erforderlich werden.
Rolle der ZNS-Bestrahlung
Ein initialer ZNS-Befall der AML ist in ca. 5-15% der Kinder vorhanden. Verschiedene Studien haben gezeigt, dass eine intensive, wöchentliche intrathekale Therapie bis zur Klärung des Liquors genau so wirksam ist wie die ZNS-Bestrahlung. Dies gilt auch bei der Behandlung der meisten Chlorome. Auch die prophylaktische ZNS-Behandlung mit systemisch und intrathekal applizierter Chemotherapie hat sich gegen die Bestrahlung durchgesetzt. In der aktuellen AML-BFM 2012 Studie wird auf die prophylaktische ZNS-Bestrahlung verzichtet. Es erfolgen je nach Therapiearm 9 bzw. 11 intrathekale Tripletherapien (Prednison, Methotrexat und Cytarabin), ausser bei gleichzeitiger Applikation von intravenösem hochdosiertem Cytarabin, um unnötige Neurotoxizität zu vermeiden. Hier besteht die intrathekale Therapie aus einer Monotherapie mit Cytarabin.
Stellenwert der Erhaltungstherapie
International ist die Erhaltungstherapie umstritten. Aus Studien mit Erwachsenen ist bekannt, dass die Ergebnisse bei weniger intensiver Therapie mit Erhaltungstherapie für einen Teil der Patienten von Vorteil sind (14), jedoch bei Einsatz einer intensiven Anfangstherapie keinen Vorteil bringen (15).
Bei Kindern wurde in der französischen LAME-Studie 89/91 gezeigt, dass die Ergebnisse mit und ohne Erhaltungstherapie für das erkrankungsfreie Überleben (DFS) im gleichen Bereich liegen, während die Wahrscheinlichkeit des Gesamtüberlebens (OS) sogar besser war, wenn keine Erhaltungstherapie durchgeführt wurde – begründet durch eine höhere Salvage-Rate nach Rezidiven ohne vorherige Erhaltungstherapie (16). Ebenso zeigte die amerikanische CCG-Studie 213, dass die Erhaltungstherapie nach einer Intensivierung mit Hochdosis-Cytarabin nicht notwendig war. Andererseits spielte sie eine Rolle im Zweig mit Standardintensität in der Induktion (17). Aufgrund der Heterogenität der AML und der unterschiedlichen Proliferationskinetik ist es auch denkbar, dass nur für bestimmte Subtypen der AML eine Erhaltungstherapie von Vorteil sein kann.
Stellenwert der allogenen Stammzelltransplantation
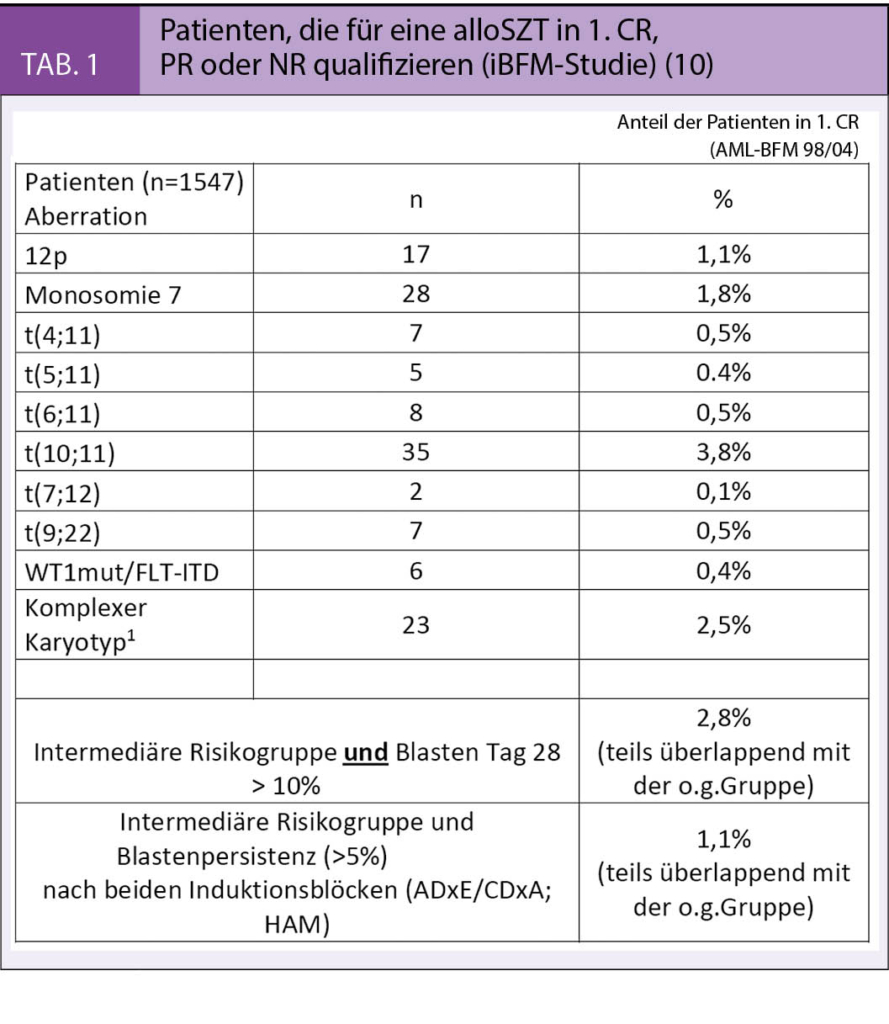
Der Stellenwert der allogenen Stammzelltransplantation (alloSZT) in erster kompletter Remission (1. CR) wird nach wie vor diskutiert. Die prospektive Analyse der alloSZT von einem Geschwisterspender für die Hochrisikogruppe der AML-BFM 98 Studie konnte keinen signifikanten Vorteil belegen. Dieses deckt sich mit den Ergebnissen der britischen MRC-Studie und der skandinavischen NOPHO Studie. Andererseits ergab eine Metaanalyse bei Kindern und Jugendlichen einen Vorteil der alloSZT in 1. CR (18). Die Aufarbeitung der verschiedenen Studien weist daraufhin, dass die Ergebnisse der alloSCT in den verschiedenen Gruppen ähnlich sind in Bezug auf das Rezidivrisiko, die Morbidität und das Überleben. Deutlichere Unterschiede treten eher beim Vergleich der jeweiligen Chemotherapiearme auf. Hinzu kommt, dass ein möglicher Vorteil der SZT auch in den unterschiedlichen Risikogruppen sehr unterschiedlich ist (19).
Die Tabelle 1 stellt die aktuellen Indikationen der iBFM AML Gruppe für eine alloSZT sowohl vom Geschwister- als auch vom passenden Fremdspender in der Frontline Therapie dar. Alle prognostisch ungünstigen molekular-biologischen Subtypen sind dabei vertreten, sowie die Patienten mit fehlendem Ansprechen auf die Induktionstherapie (sog. Non-Responders, ca. 4% der Hochrisikopatienten) für welche die alloSZT die einzige kurative Option bietet.
Unumstritten ist die SZT jedoch im Rezidiv Fall.
Neue Therapien
Trotz allen Fortschritten bleibt die Prognose der pädiatrischen AML deutlich unter jener der ALL. Patienten mit refraktärer AML (non-responders), diejenigen mit Rezidiv nach allogener Stammzelltransplantation aber auch einige Patienten mit bestimmten sehr Hoch-Risiko Mutationen haben alle noch sehr eingeschränkte Überlebenschancen. Deshalb sind neue, wenn möglich gezielte, Therapieeinsätze notwendig. Dank der oben erwähnten Fortschritte in der molekular-biologischen Charakterisierung der AML konnten eine Vielzahl neuer Mutationen (Typ I / II, Abb. 1) nachgewiesen werden, die sowohl bei der Leukä-mogenese als auch für Proliferation, Differenzierungsgrad oder Phänotyp relevant sind, aber auch therapeutisch genutzt werden können. Es wurden spezifische Substanzen (Tyrosin-Kinase Inhibitoren, «small molecules» etc.) entwickelt, die einzelne Signalkaskaden blockieren können. Trotz der meist guten Effektivität in vitro, ergaben die klinischen Studien als Monotherapien in der Regel eher begrenzte Behandlungserfolge. In Kombination mit konventionellen Chemotherapien ergeben sich allerdings zunehmend Hinweise, dass bei einem gezielten Einsatz dieser Substanzen, die Ansprechraten von AML-Patienten verbessert werden können.
Sorafenib (als Beispiel einer gezielten Therapie)
Sorafenib ist ein Arzneimittel aus der Gruppe der Tyrosin-Kinase-Inhibitoren (TKI) mit Wirkung auf multiple Tyrosinkinasen (multi-TKI) und hat somit mehrere Angriffspunkte: i) Inhibition der Rezeptor-Tyrosinkinasen (FLT-3,c-kit, VEGFR-2, VEGFR-3, PDGFR-b) mit Blockade der entsprechenden Signalkaskaden und reduzierter Tumor-Angiogenese; ii) Inhibition der Serin/Threonin-Kinasen (Raf-Kinasen: CRAF, BRAF, V600EBRAF) mit Hemmung der Raf-Signalkaskade. In beiden Fällen führt Sorafenib zu einer verminderten Zellteilung und Proliferation. Vorläufige Ergebnisse in Fallberichten und Studien bei Erwachsenen zeigen, dass eine gezielte Therapie mit Sorafenib bei AML mit FLT3-ITD eine vielversprechende Option anbieten könnte (20). Weitere experimentelle Daten zeigen, dass Inhibitoren wie Sorafenib, die die FLT3-ITD spezifischer hemmen als andere multi-TKI (Lestaurtinib[CEP701], Midostaurin [PKC412]), effektiver für FLT3-ITD/TDK positive AML sein können und weniger Nebenwirkungen zeigen (21).
Das gegenwärtige Therapieprotokoll der iBFM Gruppe (International Relapsed AML 2010/01) wird die Wirkmechanismen dieses TKI bei Patienten mit einer FLT3-ITD berücksichtigen. Durch die sequenzielle Gabe von Sorafenib (3 Tage Intervall zwischen Sorafenib und Chemotherapiestart) wird die gleichzeitige Applikation mit der Chemotherapie vermieden und somit das Risiko einer möglichen Wirkminderung der Chemotherapie durch Änderung des Zellzyklus reduziert. Zudem werden die mehrfach in vitro nachgewiesenen schnellen aber transienten Resistenzentwicklungen vermieden, die höchstwahrscheinlich nicht auf einen resistenten Klon zurückzuführen sind.
Abteilungsleiter päd. Hämatologie-Onkologie
Universitätskinderspital beider Basel UKBB
Spitalstrasse 33
4056 Basel
nicolas.vonderweid@ukbb.ch
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Beitrag deklariert.
- Die pädiatrische AML ist eine seltene, molekularbiologisch sehr
heterogene Erkrankung - Die Behandlung beruht auf kurze, intensive und sehr myelotoxische Chemotherapieblöcke
- Wie bei der ALL ist eine Stratifizierung der Patienten auf der Basis der Molekularbiologie und des frühen Ansprechens unentbehrlich
- Der Stellenwert der alloSZT in der initialen Therapie ist umstritten, für bestimmte Subtypen der AML aber sicher relevant
- Neue Therapien, insbesondere TKI, könnten die düstere Prognose bestimmter Patientengruppen verbessern
Messages à retenir
- La leucémie myéloïde aiguë pédiatrique est une maladie rare, moléculairement très hétérogène
- Le traitement repose sur des blocs de chimiothérapie courts, intensifs et très myélotoxiques
- Comme pour la LLA, la stratification des patients sur la base de la biologie moléculaire et de la réponse précoce est indispensable
- Le rôle de la transplantation de cellules souches allogéniques en traitement initial est controversé, mais certainement pertinent pour certains sous-types de leucémie myéloïde aiguë
- De nouvelles thérapies, en particulier les ITK, pourraient améliorer le pronostic sombre de certains groupes de patients
1. Kaatsch P, Spix C. Jahresbericht / Annual Report 2005. Book. 2008.
2. Zwaan MC, Reinhardt D, Hitzler J, Vyas P. Acute leukemias in children with Down syndrome. Pediatr Clin North Am. 2008;55:53-70,x.
3. Greaves M. Childhood leukaemia. BMJ. 2002;324:283-287.
4. Rubnitz JE, Gibson B, Smith FO. Acute myeloid leukemia. Pediatr Clin North Am. 2008;55:21-51, ix.
5. Appelbaum FR, Rowe JM, Radich J, Dick JE. Acute myeloid leukemia. Hematology (Am Soc Hematol Educ Program ). 2001;:62-86.
6. Lane SW, Gilliland DG. Leukemia stem cells. Semin Cancer Biol. 2009.
7. Goemans BF, Zwaan CM, Miller M, Zimmermann M, Harlow A, Meshinchi S, Loonen AH, Hahlen K, Reinhardt D, Creutzig U, Kaspers GJ, Heinrich MC. Mutations in KIT and RAS are frequent events in pediatric core-binding factor acute myeloid leukemia.
8. Hollink IHIM, Zwaan CM, Zimmermann M, Arentsen-Peters TCJM, Pieters R, Cloos J, Kaspers GJL, de Graaf SSN, Harbott J, Creutzig U, Reinhardt D, Heuvel-Eibrink MM, Thiede C. Favorable prognostic impact of NPM1 gene mutations in childhood acute myeloid leukemia, with emphasis on cytogenetically normal AML. Leukemia. 2009;23:262-270.
9. Zwaan CM, Meshinchi S, Radich JP, Veerman AJ, Huismans DR, Munske L, Podleschny M, Hahlen K, Pieters R, Zimmermann M, Reinhardt D, Harbott J, Creutzig U, Kaspers GJ, Griesinger F. FLT3 internal tandem duplication in 234 children with acute myeloid leukemia: prognostic significance and relation to cellular drug resistance. Blood. 2003;102:2387-2394.
10. Creutzig U, Zimmermann M, Ritter J, Reinhardt D, Hermann J, Henze G, Jurgens H, Kabisch H, Reiter A, Riehm H, Gadner H, Schellong G. Treatment strategies and long-term results in paediatric patients treated in four consecutive AML-BFM trials. Leukemia. 2005;19:2030-2042.
11. Sander A, Zimmermann M, Dworzak M, Fleischhack G, von Neuhoff C, Reinhardt D, Kaspers GJ, Creutzig U. Consequent and intensified relapse therapy improved survival in pediatric AML: results of relapse treatment in 379 patients of three consecutive AML-BFM trials. Leukemia. 2010;24:1422-1428.
12. Reinhardt D, Langebrake C, Creutzig U, Vormoor J, Brune C, Thorwesten M, Ingiliz P, Hrusak O, Dworzak M, Griesinger F. Minimal residual disease in acute myeloid leukemia in children – standardization and evaluation of immunophenotyping in the AML-BFM-98 study. Klinische Padiatrie. 2002;214:179-187.
13. Kern W, Haferlach C, Haferlach T, Schnittger S. Monitoring of minimal residual disease in acute myeloid leukemia. Cancer. 2008;112:4-16.
14. Büchner T, Hiddemann W, Löffler H, Nowrousian MR, Maschmeyer G, Aul HC, Straif K, Hossfeld D, Heinecke A, for the AMLCG. Long-term results in adult AML: maintenance versus no maintenance, and double versus standard induction. Blood. 1990;74, Suppl. 1:105.
15. Mandelli F, Vegna ML, Avvisati G, et al. A randomized study of the efficacy of postconsolidation therapy in adult acute nonlymphocytic leukemia: a report of the Italian Cooperative Group GIMEMA. Ann Hematol. 1992;64:166-172.
16. Perel Y, Auvrignon A, Leblanc T, Vannier JP, Michel G, Nelken B, Gandemer V, Schmitt C, Lamagnere JP, de Lumley L, Bader Meunier B, Couillaud G, Schaison G, Landman-Parker J, Thuret I, Dalle JH, Baruchel A, Leverer, and for the Group LAME of the French Society of Pediatric Hematology and Immunology. Impact of addition of maintenance therapy to intensive induction and consolidation chemotherapy for childhood acute myeloblastic leukemia: results of a prospective randomized trial, LAME 89/91 [abstract]. J Clin Oncol. 2002;20:2774-2782.
17. Wells RJ, Woods WG, Lampkin BC, Nesbit ME, Lee JW, Buckley JD, Versteeg C, Hammond GD. Impact of high-dose cytarabine and asparaginase intensification on childhood acute myeloid leukemia: a report from the Children’s Cancer Group. J Clin Oncol. 1993;11:538-545.
18. Bleakley M, Lau L, Shaw PJ, Kaufman A. Bone marrow transplantation for paediatric AML in first remission: a systematic review and meta-analysis. Bone Marrow Transplant. 2002;29:843-852.
19. Horan J, Korones D. Intensive chemotherapy and bone marrow transplantation for children with acute myeloid leukemia. Blood. 2001;97:3672-3673.
20. Metzelder S, Wang Y, Wollmer E, Wanzel M, Teichler S, Chaturvedi A, Eilers M, Enghofer E, Neubauer A, Burchert A. Compassionate use of sorafenib in FLT3-ITD-positive acute myeloid leukemia: sustained regression before and after allogeneic stem cell transplantation. Blood. 2009;113:6567-6571.
21. Stone RM, DeAngelo DJ, Klimek V, Galinsky I, Estey E, Nimer SD, Grandin W, Lebwohl D, Wang Y, Cohen P, Fox EA, Neuberg D, Clark J, Gilliland DG, Griffin JD. Patients with acute myeloid leukemia and an activating mutation in FLT3 respond to a small-molecule FLT3 tyrosine kinase inhibitor, PKC412. Blood. 2005;105:54-60.
info@onco-suisse
- Vol. 8
- Ausgabe 4
- August 2018