- ASCO 2019 CHICAGO
Wie jedes Jahr pilgerten wir mit Prof. Cerny und Prof. von Moos, zusammen mit weiteren 35 000 Onkologie-Interessierten zum Amerikanischen Onkologie Kongress in Chicago, um einmal mehr für unsere Leser die spannenden Neuigkeiten – Innovationen, positive wie auch negative Studienergebnisse – vom ASCO für Sie zusammenzustellen. Aktuelle Diskussionen drehten sich oft um folgende Fragen:
• Einsatz der Checkpoint-Inhibitoren in First- oder Second-Line?
• Genügt eine Monotherapie oder hat der Patient mehr Effekt bei einer Kombinationstherapie?
• Biomarker – welche können eine zuverlässige Therapie voraussagen?
EDITORIAL «Step by step – Fortschritt für Alle»
Wie jedes Jahr pilgerten wir mit Prof. Cerny und Prof. von Moos, zusammen mit weiteren 35 000 Onkologie-Interessierten zum Amerikanischen Onkologie Kongress in Chicago, um einmal mehr für unsere Leser die spannenden Neuigkeiten – Innovationen, positive wie auch negative Studienergebnisse – vom ASCO für Sie zusammenzustellen. Aktuelle Diskussionen drehten sich oft um folgende Fragen:
• Einsatz der Checkpoint-Inhibitoren in First- oder Second-Line?
• Genügt eine Monotherapie oder hat der Patient mehr Effekt bei einer Kombinationstherapie?
• Biomarker – welche können eine zuverlässige Therapie voraussagen?
Viele weitere Fragen stehen im Raum und wir haben wieder versucht aus der Fülle der Beiträge für Sie die wichtigsten News und Erkenntnisse vom ASCO, ergänzt mit Interviews von Schweizer Experten, in unserer ASCO-Kongresszeitung darzustellen. Da kurz danach auch der EHA-Kongress in Amsterdam statt fand, haben uns die Hämato-Onkologie Spezialisten ihre Highlights zusammen getragen. Diese finden Sie im hinteren Teil unserer Kongressausgabe.
Fortschritte bei der Krebsbehandlung sind nur so gut, wie Patienten Zugang zu ihnen erhalten. Dabei soll nicht nur die onkologische Medizin einen wichtigen Stellenwert erhalten, sondern auch das Problem des gerechten Zugangs zur Behandlung und Betreuung. Dies stand dieses Jahr in den USA prominent im Fokus des ASCO-Kongresses, was ein absolutes Novum darstellte und die enorme mediale Aufmerksamkeit dieser Thematik betonte. Das Motto: «Cancer treatment advances are only as good as patients’ ability to access them.» In Europa ist das Thema schon seit vielen Jahren virulent, in der Schweiz als «gleicher Zugang für alle» das Ziel Nr. 1 der Nationalen Strategie gegen Krebs NSK.
Die Auswirkungen des in den USA 2012 eingeführten und für die Bundesstaaten fakultativen sog. «Affordable Care Act» (ACA), welche Menschen unter einem gewissen Einkommensniveau finanzielle Unterstützung zu ihren Gesundheitsausgaben leistet, wurden untersucht. Es zeigte sich, dass diese – aus Europäischer Sicht ja letztlich bescheidene Hilfe – eindeutig positive Effekte hat:
Mehr zeitgerechte Diagnosen, den rascheren und qualitativ besseren und gerechteren Therapiezugang und auch bessere Behandlungsresultate. Auch der Zugang zu Früherkennung und Prävention konnte wirksam verbessert werden.
Auch wenn Fakten den amtierenden Präsidenten nicht zwingend beeindrucken, bleibt zu hoffen, dass das Engagement am ASCO für dieses wichtige Anliegen Früchte trägt.
Viel Spass und Gewinn beim Durchstöbern unserer Kongresszeitung
Ihre
Eleonore E. Droux
Prof. Dr. med. Thomas Cerny
Olaparib-Maintenance verlängert das PFS auch beim BRCA+ Pankreaskarzinom
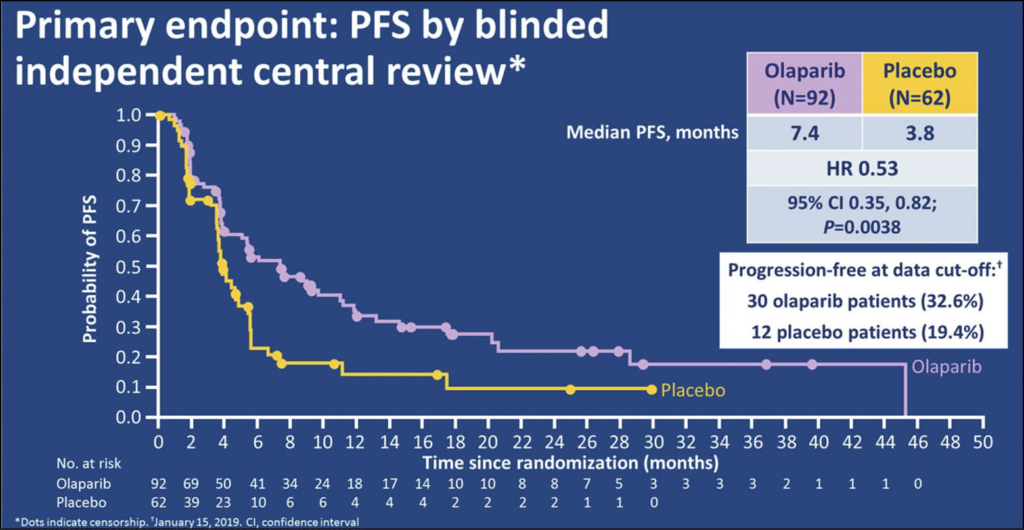
Für diese randomisierte, doppelblinde und Placebo-kotrollierte Phase-3-POLO-Studie wurden 3315 Patienten mit Pankreaskarzinom auf BRCAness gescreent! Dabei fanden sich 247 Patienten mit Mutationen in BRCA1 oder 2. Nach einer platinbasierten Erstlinientherapie mit FOLFIRINOX oder Gem/Nab-Paclitaxel wurden schliesslich 164 Patienten in stabiler Tumorsituation 3:2 randomisiert in eine Olaparib-Erhaltungstherapie (N:92) oder Placebo (N:62). Alle Patienten hatten Keimbahnmutationen in BRCA1 oder BRCA2. Das PFS wurde durch Olaparib 2 x 300mg täglich deutlich verbessert von 3.8 auf 7.2 Monate (HR 0.53, p= 0.004). Das Gesamtüberleben allerdings blieb kaum verändert (HR = 0.91, P = 0.68): eine Interims-OS-Analyse bei 46% «Maturity of Study» zeigte nämlich noch keinen Überlebensvorteil.
Die Lebensqualitäts-Messungen nach EORTC (100 Punkte Skala) waren für beide Arme vergleichbar. Die Inzidenz an Grad > 3 Toxizität wurde im Behandlungsarm mit Olaparib mit 40% und in der Kontrollgruppe mit 23% angegeben. 5% der Patienten im Behandlungsarm und 2% im Placeboarm haben deshalb ihre Behandlung abgebrochen. Somit zeigt sich zusammenfassend, dass die Olaparib-Erhaltungstherapie nach einer wirksamen Induktions-Chemotherapie mit FOLFIRINOX oder Gem/Nab-Pacliaxel das PFS mehr als verdoppelt, dass aber ein OS-Vorteil z.Z. noch nicht dokumentiert werden kann.
Da es sich letztlich nur um eine kleine, aber wohl meist übersehene Gruppe von Patienten beim notorisch refraktären Pankreaskarzinom handelt, ist diese Studie bereits zeitgleich zum ASCO im NEJM publiziert worden.
Die NCCN-Richtlinien haben die Empfehlung zur BRCA-Testung auf Mutationen von Patienten mit fortgeschrittenem Pankreaskarzinom bereits aufgenommen, was konsequenterweise für alle Pankreaskarzinom-Patienten eine entsprechende genetische Beratung erfordert.
ThC
ASCO 2019, LBA4, Quelle. Kindler HL et al J. Clin Oncol 2019, 37
CNS-Malignomen auf Entrectinib
Hohes Ansprechen von Kindern mit refraktären soliden Tumoren
Die Wichtigkeit der Identifikation von medikamentös beeinflussbaren molekularen Zielstrukturen im pädiatrischen Setting wird auch durch die NCI-COG-Match Trial unterstrichen.
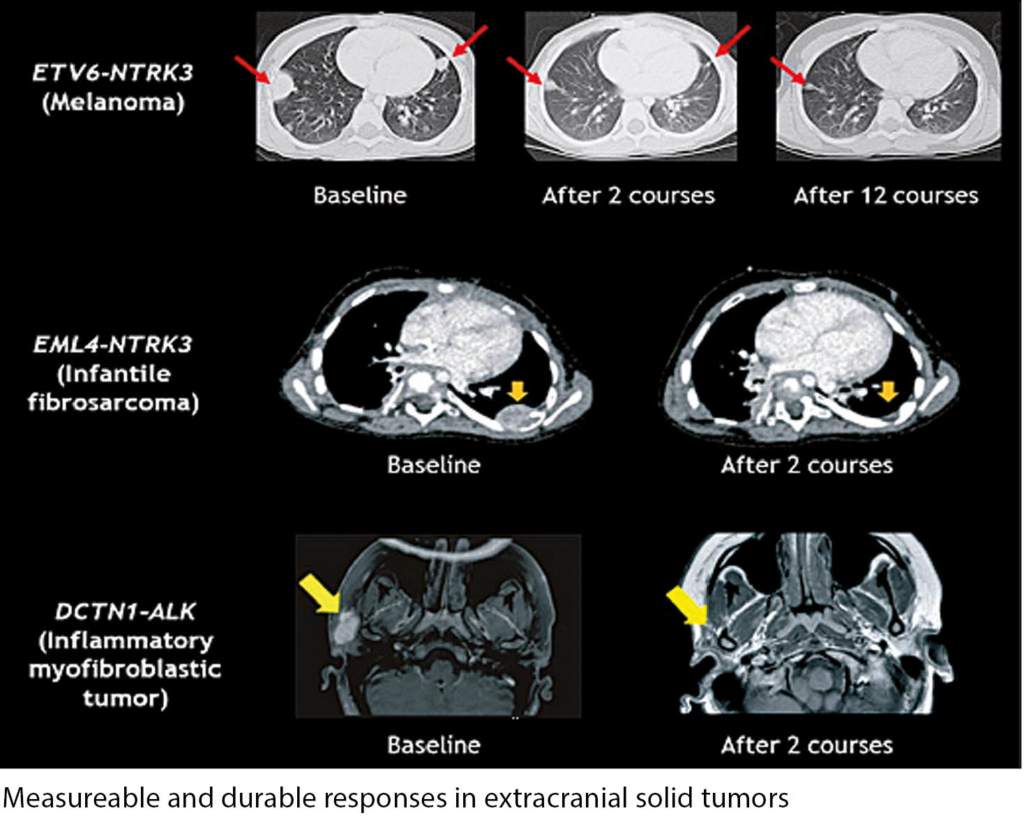
In dieser Studie mit 29 Patienten (Alter 5 Monate bis 20 Jahre) mit refraktären Soliden Tumoren oder CNS-Malignomen wurde Entrectinib, ein oraler CNS-gängiger TrkA/B/C, ROS1 und ALK Tyrosin-Kinase-Inhibitor untersucht. Entrectinib wurde generell gut toleriert. Dosis-limitierend waren erhöhtes Kreatinin, Dysgeusie, Fatigue und Lungenödem. Die empfohlene tägliche Dosis betrug 550 mg/m2. Alle Responders hatten eine Tagesdosis ≥ 400 mg/m2. Alle 11 Kinder und Adoleszenten mit einer NTRK1/2/3, ROS1 oder ALK Fusion sowie ein Fall von Neuroblastom mit einer ALK-Mutation zeigten ein Ansprechen! Patienten ohne Nachweis des Targets von Entrectinib zeigten kein Ansprechen.
Von den 6 Patienten mit dem Entrectinib-Target und Solidem Tumor wurden eine CR und 5 PRs dokumentiert. Bei den 6 Patienten mit ZNS-Malignomen zeigte ebenfalls einer eine CR, 3 zeigten eine PR, ein Patient eine 2PR «unconfirmed» und bei einem Patienten ist es noch zu früh für die Response-Evaluation. Die Zeit bis zum Ansprechen betrug median 57 Tage. Entrectinib ist bei dieser Zielpopulation ein sehr wirksamer neuer Tyrosinkinase-Inhibitor, der nun prioritär weiter untersucht werden muss.
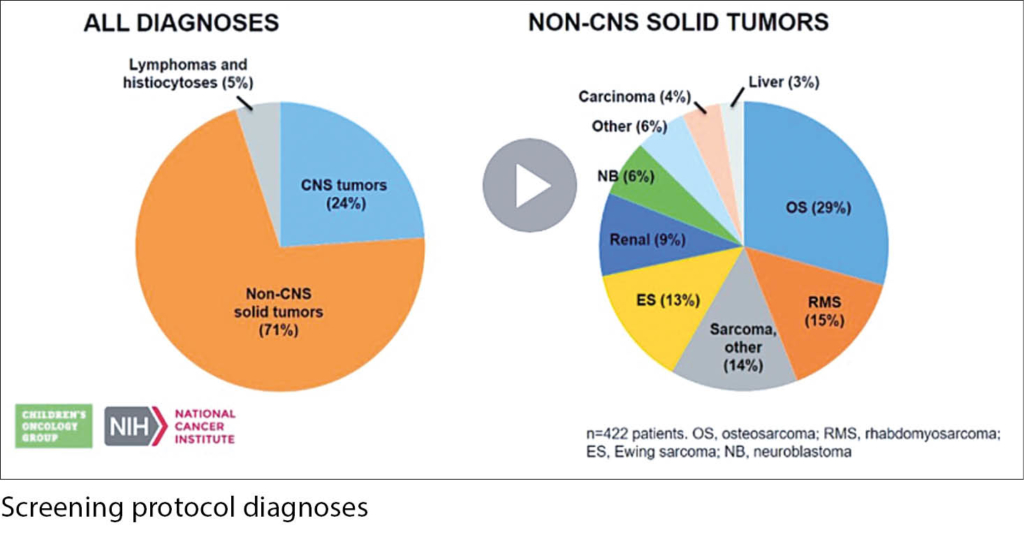
Diese Studie zeigt auch, dass das Finden von therapeutisch beeinflussbaren molekularen Zielstrukturen ein Königsweg ist, um bei seltenen Malignomen wie in der Pädiatrie Fortschritte zu erzielen. Letzteres beabsichtigt genau die NCI-COG-Pediatric Match Trial der Children‘s Oncology Group des NCI. Hier wurden in einem kurzen Zeitraum von 17 Monaten 422 Kinder mit Soliden Tumoren (71%) und ZNS-Tumoren in 24% sowie 6% mit Lymphomen und Histiozytären Malignomen untersucht. Es standen 10 zielspezifische Behandlungsarme zur Verfügung. Von den Kindern unter 12 Jahren konnten 35% einem Behandlungsarm zugewiesen werden, von den Kindern >12 Jahre 25%. Dabei fanden sich HRAS/KRAS/NRAS Mutationen (n = 16), BRAF Mutationen oder Fusionen (n = 14), oder NF1 Mutationen (n = 11). Andere Gene betrafen SMARCB1 (n = 14), ALK (n = 8), CDK4 (n = 8), PIK3CA (n = 7), PTEN (n = 7), FGFR1 (n = 5), und BRCA1/BRCA2 (n = 5). Insgesamt konnte somit in gut einem Viertel der Kinder eine behandelbare molekulare Zielstruktur gefunden werden und es wird sich im weiteren Verlauf zeigen, inwieweit diese Strategie der Personalisierten Onkologie in der Pädiatrie das klinische Ansprechen beeinflussen wird.
ThC
Robinson GW et al J Clin. Oncol. 2019, 37; (Suppl. Abstracts 10 009) Parsons DW et al J Clin. Oncol. 2019, 37; (Suppl. Abstracts 10 011)
Myelom: Neue Optionen für smoldering und 1.Linien Therapie
Gleich drei wichtige positive randomisierte Phase 3 Studien sind am ASCO vorgestellt worden:
1. die Phase2/3 Studie mit Lenalidomid versus Observation beim High-risk Smoldering Myeloma (SSM, abstract 8001).
2. die Studie mit 1.Linien Daratumumab/Lenalidomid-Dex versus Len/Dex für nicht transplantierbare MM Patienten (abstract 8035).
3. die Cassiopeia-Studie, welche die Erstlinientherapie bei transplantierbaren Patienten mit Daratumumab + VTd versus VTd (Bortezomib-Thalidomid und Dex) untersuchte (abstract 8003).
1. Für Patienten mit einem «smoldering Myeloma (SMM)» ist bisher die Observation die standardmässige Vorgehensweise. Die Option einer klinisch bedeutsamen signifikanten Verzögerung des Auftretens eines Multiplen Myeloms mit einer die Patienten wenig belastenden Mono-Therapie wie Lenalidomid ist eine sinnvolle Fragestellung. Eine spanische Gruppe hatte bereits 2013 Resultate einer Phase 3 Studie publiziert, welche mit Len/Dex sowohl eine signifikante Verzögerung des Auftretens eines MM sowie auch einen OS-Vorteil gezeigt hatte (Mateos, NEJM 2013). Es blieb aber unklar, ob dieser positive Effekt nun durch Len oder Dex oder der Kombination erzeugt wurde. In dieser neuen randomisierten Intergroup Phase 3 Intergroup Study E3A06 mit 182 Patienten wurde nun die Hypothese untersucht, dass Lenalidomid alleine für diese Wirkung verantwortlich sei. Zuerst wurde Lenalidomid Monotherapie in einer Phase 2 Studie mit 44 «high risk SMM» getestet und dann die Phase 3 mit 182 Patienten begonnen welche Len gegen alleinige Observation verglich, mit dem primären Endpunkt des PFS. Patienten erhielten 25mg Len d1-21 alle 4 Wochen sowie prophylaktisch Aspirin 325mg täglich. In der Phase 2 Gruppe zeigte sich mit einer medianen Beobachtungszeit von 5 Jahren, dass 78% keine Progression zu einem MM aufwiesen. In der Phase 3 (vgl. Tabelle) zeigte sich im Behandlungsarm nach 2 Jahren eine Risikoreduktion des Auftretens eines MM von 72%. OS Daten liegen noch keine vor. Grad 4 Toxizitäten waren selten und es hat keine neuen Sicherheits-Signale gegeben. Wir sind nun gespannt auf die volle Publikation der reifen Daten.
2. Die grosse offene randomisierte Phase 3 Studie mit 737 nicht transplantierbaren Myelom-Patienten in der 1.Linie verglich Daratumumab + Len/Dex versus Len/Dex als Kontrollarm. Diese Studie ist im NEJM gleichzeitig zum ASCO publiziert worden (Facon, NEJM 2019). Die CR Rate betrug 47.6% versus 24.9% für den Kontrollarm. Neutropenien grad 3-4 (50% versus 35%) und Pneumonien (13.7 versus 7.9%) waren häufiger im Verum-Arm, Anämien Grad 3-4 häufiger im Kontrollarm (11.8.5 versus 19.7%). Es zeigte sich nach einer medianen Beobachtungszeit von 28 Monaten ein hoch-signifikant verbessertes errechnetes PFS nach) 30 Monaten von 70.6 % versus 55.6% für den Kontrollarm. Reife OS Daten liegen noch nicht vor.
3. Die Phase 3 Intergroup Cassiopeia-Studie der IFM und HOVON, welche die Erstlinientherapie bei 1082 transplantierbaren Patienten mit Daratumumab + VTd versus VTd (Bortezomib-Thalidomid und Dex) untersuchte, wurde zeitgleich im Lancet publiziert (Moreau, Lancet 2019). Das Risiko von Progression oder Tod wurde im Behandlungsarm hoch-signifikant um 53% reduziert und die mediane Beobachtungszeit von 18.8 Monate ist noch etwas zu früh um das OS schlüssig zu beurteilen.
ThC
Quelle: ASCO 2019 1.Moreau P et al J Clin. Oncol 2019, 37 (suppl.abstract 8003) 2.Usmani S Z et al J Clin. Oncol 2019, 37 (suppl.abstract 8035) 3.Lonial S et al J Clin. Oncol 2019, 37 (suppl.abstract 8001)
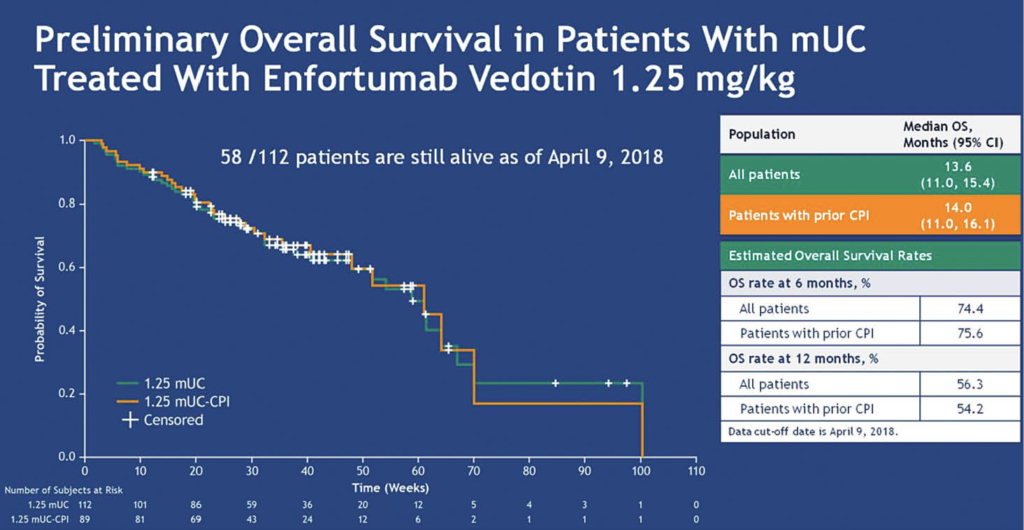
Enfortumab Vedotin EV zeigt eindrückliche und anhaltende Aktivität bei Patienten mit refraktärem Blasenkarzinom
Platine und Checkpointinhibitoren (CPI) sind beim Urothelkarzinom bewährte wirksame Therapien. Danach gibt es keine überzeugenden Optionen mehr. In dieser «unmet need»-Situation kommen nun wirklich eindrückliche Phase-2-Daten, deren Update mit einer Fallzahl von 112 Patienten am ASCO präsentiert wurde (Safety-Population N:155).
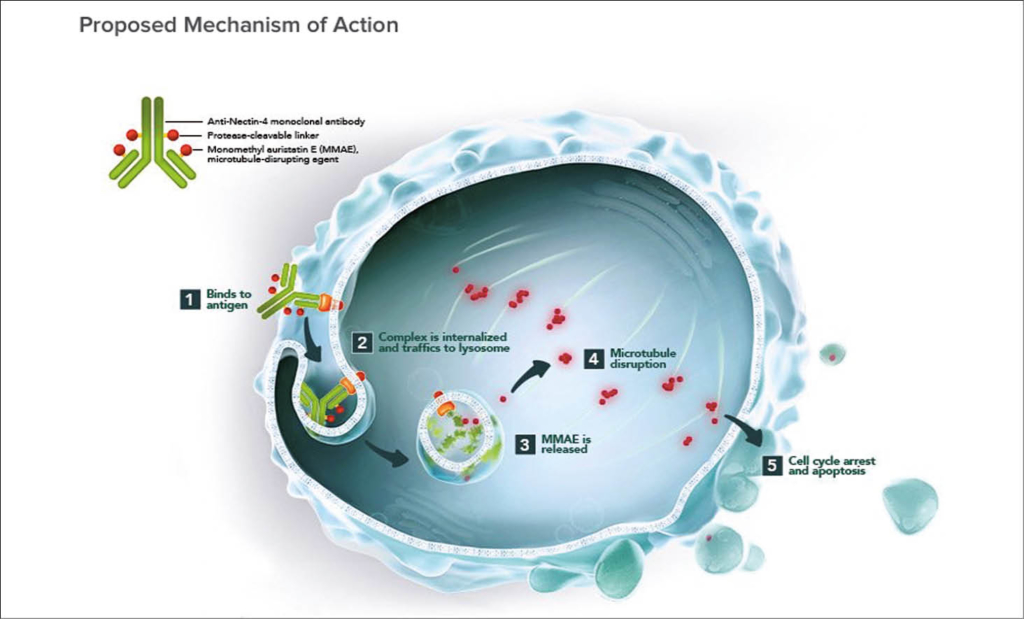
Enfortumab Vedotin ist ein Antikörper-Drug-Konjugat mit Vedotin, das als mikrotubuläres Spindelgift an Nektin-4, welches beim Urothelkarzinom und auch anderen Tumoren überexprimiert wird, andockt und über die Blockade der Zellteilung die Apoptose auslöst. Wir kennen das Wirkprinzip bereits von Brentuximab Vedotin (Adcetris), welches ja beim Morbus Hodgkin und bei T-Zell-Malignomen wirksam ist.
Nun wurden die klinischen Daten der Kohorte 1 von 112 vorgestellt, welche mit einem metastasierenden Urothelkarzinom mindestens eine Platin- und CPI-Therapie erhalten hatten. Es wurden 2 Kohorten unterschieden: in Kohorte 1 wurden Patienten mit Platin und CPI-Vorbehandlung, in Kohorte 2 nur Patienten mit CPI-Vorbehandlung eingeschlossen. Die Daten hier betreffen ausschliesslich die Kohorte 1.
Die 112 Patienten waren median 69 Jahre alt (24-86J), 73% waren Männer. 84 Patienten hatten ein Blasenkarzinom und 32 Patienten hatten Lebermetastasen. 94% Patienten waren Platin-refraktär, 73% Patienten hatten bereits eine CPI erhalten. 63% der Patienten hatten mindestens 2 Vorbehandlungen erhalten. Enfortumab Vedotin (EV) wurde als 30-minütige Infusion an den Tagen 1, 8 und 15 alle 4 Wochen verabreicht. Die Therapie wurde soweit gut vertragen, wobei Fatigue mit 54% am häufigsten auftrat. AEs Grade > 3 waren Anämie (8%), Hyponatriämie (7%), Harnwegsinfekt (7%) und Hyperglykämie (6%). Es wurden 4 therapieassoziierte Todesfälle dokumentiert: Lungenversagen, Multiorganversagen, Ketoazidose und Harnwegsobstruktion. Die OR betrug 41% mit 3% CR, und auch bei Patienten mit Lebermetastasen war die OR vergleichbar gut mit 39%. Das PFS betrug 5.4 Monate, die mediane Dauer des Ansprechens 5.7 Monate. Das OS ist mit 13.6 Monaten angesichts der Vorbehandlungen als aussergewöhnlich hoch zu beurteilen. Es darf erwartet werden, dass die FDA mit diesen Daten wohl bald die Zulassung erteilen wird. Eine grosse Phase-3-Studie ist bereits unterwegs und weitere Tumorentitäten wie z.B. Lungen- und HNO-Karzinome sind mögliche weitere Studien-Kandidaten.
ThC
ASCO 2019, abstract LBA 4505, Petrylak DP et al J Clin Oncol 2019, 37 (Suppl abstract)
«Die rechten ins Töpfchen»
Basket Trial findet Therapie für Speicheldrüsen-Karzinom
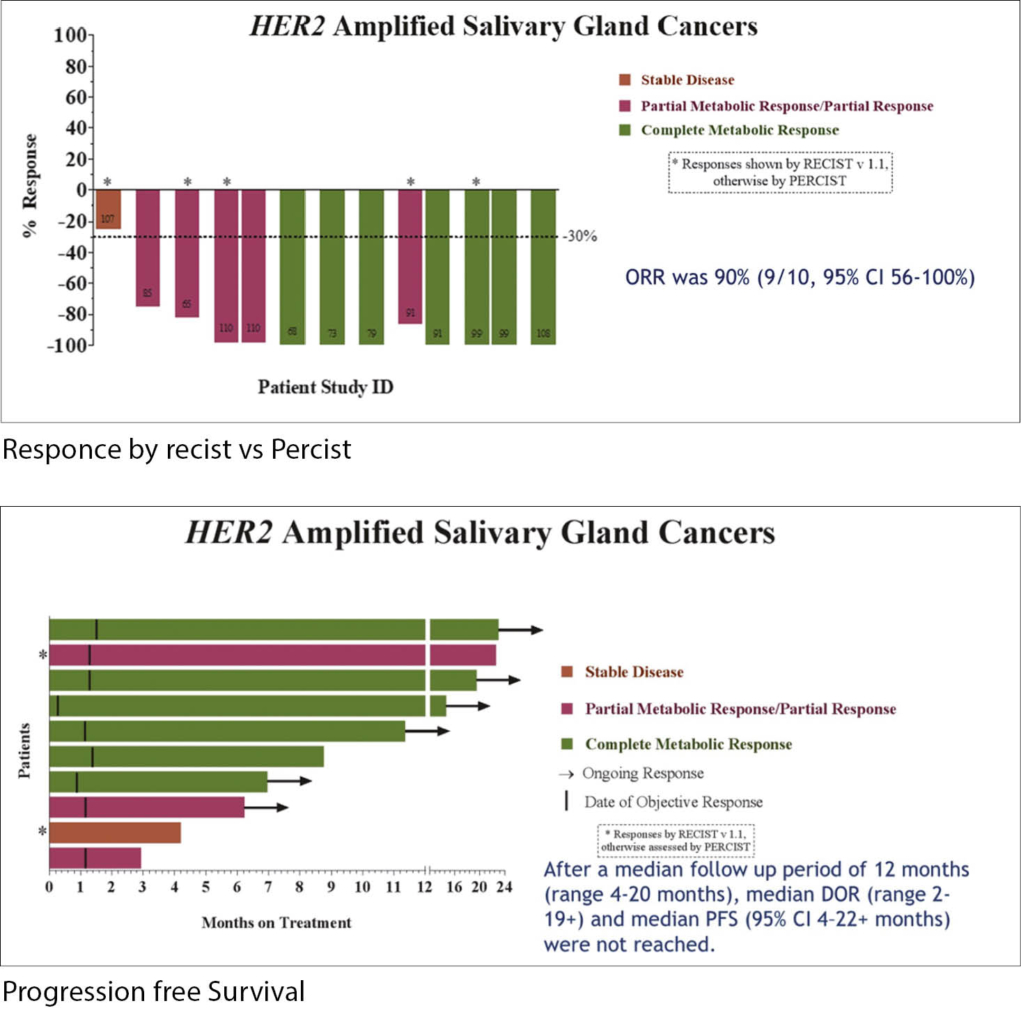
Bisher gibt es noch gar keine zugelassene Therapie für die sehr seltenen Fälle mit fortgeschrittenem Speicheldrüsen-Karzinom, einer echten «Orphan Disease». Das ändert sich nun für eine kleine Subgruppe dieser Patienten mit dem duktalen Typ (SDC), der besonders aggressiv und in ca. einem Drittel der Fälle HER2-positiv ist. So war die Hypothese auf der Hand, dass eine HER2-gerichtete Therapie hier eine Therapieoption darstellen könnte. In diesem Basket Trial wurden 10 Patienten mit metastasierendem SDC behandelt und erhielten Ado-Trastuzumab Emtansine 3.6mg/kg i.v. alle 3 Wochen. Der primäre Endpunkt war ORR. Weitere Endpunkte waren Ansprechdauer, Toxizität und PFS.
Das mediane Alter der 10 Patienten betrug 65 Jahre (36-90J), 90% waren Männer. Die Anzahl der systemischen Vorbehandlungen betrug median 2 (bis 3). Die ORR betrug 90% (9/10, 95% CI 56-100%) davon 5 CRs. Nach einem Follow-up von 12 Monaten wurden die Endpunkte der Ansprechdauer sowie das PFS noch nicht erreicht. Die Toxizität war mild mit G1 or G2-Infusions-Reaktionen, Thrombozytopenie und Transaminitis; Todesfälle gab es keine.
Diese Studie wird nun mit einer höheren Fallzahl als Extension-Study weitergeführt.
ThC
ASCO 2019, Li B. et al. Abstrac 6001
Saul-Studie
Klinische Ergebnisse nach PD-L1 Status und Alter in der prospektiven internationalen SAUL-Studie mit Atezolizumab (Atezo) bei lokal fortgeschrittenem oder metastasiertem Urothelkarzinom (UC) oder Nicht-UC der Harnwege.
Atezolizumab, ein monoklonaler Antikörper gegen PD-L1, ist eine zugelassene Therapie für lokal fortgeschrittenes/metastatisches Urothelkarzinom auf der Basis der Phase-II- und -III-Studien IMvigor210 und IMvigor211. Die einarmige SAUL-Studie mit einer breiteren Patientenpopulation zeigte ein medianes Gesamtüberleben (OS) von 8,7 Monaten und ein Sicherheitsprofil, das mit früheren Atezoversuchen übereinstimmt.
Patienten mit lokal fortgeschrittenem/metastasiertem UC oder Nicht-UC der Harnwege erhielten alle 3 Wochen Atezo 1200 mg bis zur Progression der Erkrankung oder inakzeptabler Toxizität. Von der IMvigor211-Studie ausgeschlossene Populationen (Niereninsuffizienz, ECOG PS 2, behandelte asymptomatische ZNS-Metastasen, stabil kontrollierte Autoimmunerkrankungen, begleitende Steroide, HIV-positiv, nicht-UC) waren wählbar. Der primäre Endpunkt war Sicherheit. OS und allgemeine Ansprechrate (ORR) waren sekundäre Endpunkte. Vordefinierte Subgruppenanalysen umfassten Ergebnisse nach PD-L1-Status (VENTANA SP142) und Alter in der Gesamtbevölkerung (und die IMvigor211-ähnliche Subgruppe für PD-L1).
Zwischen Nov. 2016 und März 2018 waren 1004 Patienten eingeschlossen; 997 erhielten Atezo. Die Wirksamkeit wird im Folgenden zusammengefasst. Die Häufigkeit von behandlungsbedingten Nebenwirkungen von Grad ≥3 war ähnlich unabhängig vom PD-L1-Status (Gesamt-IC 0/1 vs. 2/3: 11% vs. 16%; IMvigor211-ähnlicher IC 0/1 vs. 2/3: 11% vs. 15%) oder Alter (≥65 y: 13%; ≥75 y: 12%; ≥80 y: 10%).
OS und ORR erscheinen in IC 2/3 gegenüber IC 0/1 Untergruppen günstiger (insgesamt und in der IMvigor211-ähnlichen Bevölkerung). Atezo war effektiv und gut verträglich in allen Untergruppen, auch bei älteren Menschen.
WFR
Quelle: Adams S et al Clinical outcomes according to PD-L1 status and age in the prospective international SAUL study of atezolizumab (atezo) for locally advanced or metastatic urothelial carcinoma (UC) or non-UC of the urinary tract. J Clin Oncol 37, 2019 (suppl; abstr 1067)
Nivolumab (NIVO) + Ipilimumab (IPI
Kombinationstherapie bei Patienten mit fortgeschrittenem hepatozellulärem Karzinom (aHCC): Resultate von CheckMate 040.
m Rahmen der SELECT-D-Studie konnte gezeigt werden, dass Rivaroxaban dem NMH Dalteparin hinsichtlich Wirksamkeit und Sicherheit bei Patienten mit einer Krebsassoziierten Thrombose nicht unterlegen ist.
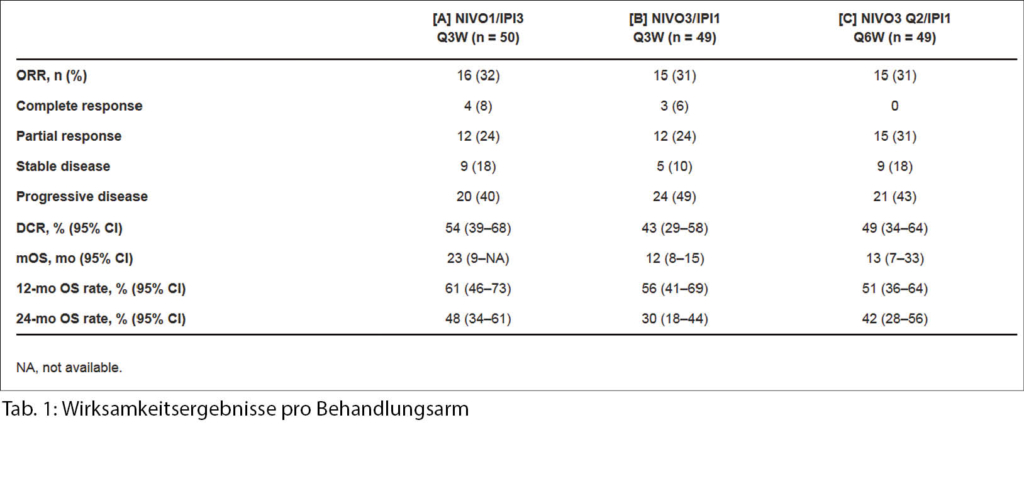
NIVO-Monotherapie (mono) ist bei mit Sorafenib (SOR)-behandelten Patienten mit HCC basierend auf den Daten von CheckMate 040 zugelassen. Dabei zeigten die Patienten eine objektive Ansprechrate (ORR) von 14% und ein medianes Gesamtüberleben (mOS) von 16 Monaten. Die vorliegende Studie ist der erste Bericht über die Wirksamkeit und Sicherheit der Kombination NIVO + IPI bei mit SOR-behandelten Patienten mit aHCC.
Die Patienten wurden zu 3 Armen randomisiert: [A] NIVO 1 mg/kg + IPI 3 mg/kg q3w (4 Dosen) oder [B] NIVO 3 mg/kg + IPI 1 mg/kg Q3W (4 Dosen), jeweils gefolgt von NIVO 240 mg q2w oder [C] NIVO 3 mg/kg Q2W + IPI 1 mg/kg Q6W. Die Behandlung wurde bis zur unerträglichen Toxizität oder zur Progression der Erkrankung fortgesetzt. Zu den primären Endpunkten gehörten Sicherheit und Verträglichkeit, zu den sekundären Endpunkten ORR (BICR gemäss RECIST v1.1), Dauer der Reaktion (DOR), Krankheitskontrollrate (DCR) und OS. Cut-off war der 25.9.2018.
148 mit SOR behandelte Patienten wurden randomisiert. Die minimale Nachverfolgung für das OS des letzten Patienten vom Randomisierungsdatum bis zum Datenschluss betrug 24 Monate. Zu Studienbeginn hatten 88% eine vaskuläre Invasion oder extrahepatische Ausbreitung, 91% hatten ein BCLC-Stadium C, 84% stellten die SOR-Therapie aufgrund des Krankheitsverlaufs ein und 14% aufgrund der Toxizität. Insgesamt betrug die ORR 31% (7 hatten eine vollständige Antwort[CR]) mit einem medianen DOR von 17 Monaten; DCR war 49% und 24 Monate, die OS-Rate betrug 40%. Patienten in Arm A hatten ein mOS von 23 Monaten und 4 Patienten eine CR. Die Tabelle 5 zeigt zusätzliche Wirksamkeitsergebnisse pro Arm. Insgesamt war NIVO + IPI gut verträglich; 37% der Patienten hatten ein behandlungsbedingtes Nebenwirkungsereignis von Grad 3-4 (TRAE; am häufigsten: Juckreiz und Ausschlag); 5% hatten Klasse 3-4 TRAEs, die zum Abbruch führten.
Die Kombination NIVO + IPI führte zu klinisch aussagekräftigen Reaktionen und hatte ein akzeptables Sicherheitsprofil bei SOR-behandelten Patienten, mit einem doppelt so hohen ORR wie bei NIVO mono (31% bzw. 14%). Patienten in Arm A hatten ein vielversprechendes mOS von 23 Monaten.
WFR
Quelle: Yau Th. et al. Nivolumab (NIVO) + ipilimumab (IPI) combination therapy in patients with advanced hepatocellular carcinoma (aHCC): Results from CheckMate 040. J Clin Oncol 37, 2019 (suppl; abstr 4012)
Wie ist die Prognose nach 5 Jahren?
Pembrolizumab-Therapie beim lokal metastasierenden NSCLC
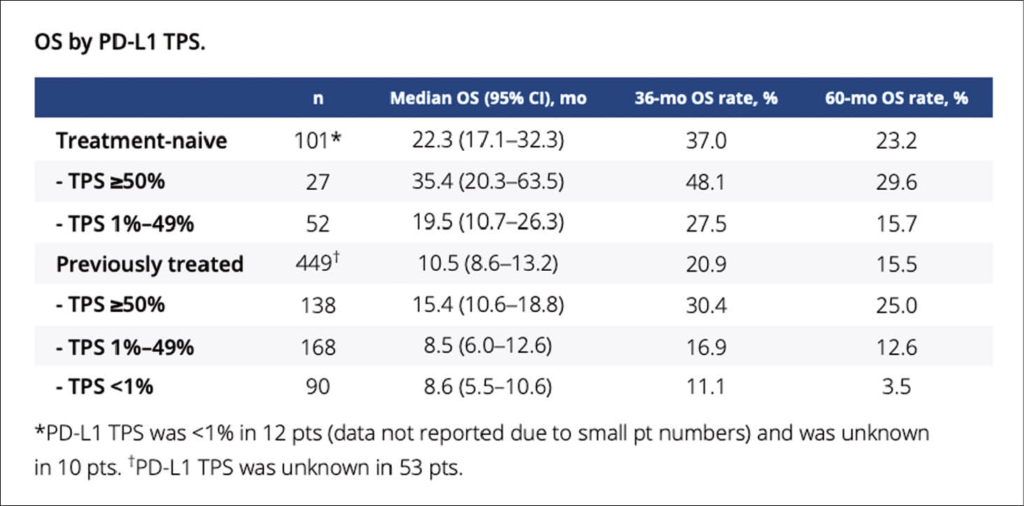
Bisher war die Chance eines Patienten mit metastasierendem Nichtkleinzelligem Lungenkarzinom, der häufigsten Art von Lungenkrebs, nach 5 Jahren noch zu leben bei 5-6%. Nun liegen die 5-Jahres-Daten aus der ersten Phase-1b-Studie mit Pembrolizumab (Keytruda) bei Patienten mit lokal fortgeschrittenem oder metastasiertem Nichtkleinzelligem Lungenkarzinom NSCLC vor. Zu beachten ist dabei, dass zu diesem Zeitpunkt weder die optimale Dosis noch die optimale Behandlungsdauer bekannt waren. Diese KEYNOTE-001 Studie hatte im Jahr 2011 mit der Aufnahme von Patienten begonnen. Von den insgesamt 550 Teilnehmern waren 449 vorbehandelt und 101 erhielten den PD-1-Inhibitor als Erstlinien-Therapie. Die Patienten erhielten 2 mg/kg Körpergewicht (KG) Pembrolizumab i.v. alle 3 Wochen oder 10mg/kg KG i.v. alle 2 oder 3 Wochen. Primärer Endpunkt war die Ansprechrate, sekundärer Endpunkt das Gesamtüberleben.
Nach einer medianen Beobachtungsdauer von 60,6 Monaten zeigt sich jetzt, dass noch 100 der insgesamt 550 Patienten am Leben sind (18%). Für die nicht vorbehandelten Patienten ist die 5-Jahres-Überlebensrate 23.2%, für die anderen 15.5% (vgl. Tabelle). Das Gesamtansprechen betrug 42% für die nicht vorbehandelte Gruppe und 23% für die vorbehandelten Patienten. Die mediane Dauer des Ansprechens betrug 38,9 Monate bez. 16,8 Monate. Immunologische Nebenwirkungen nach 5 Jahren wurden in 17% dokumentiert, wie bereits nach 3 Jahren Beobachtungsdauer. Die Patienten, welche nach 2 Jahren weiterhin in Remission waren, hatten in der Mehrheit die 5-Jahres-Überlebenszeit erreicht. Auch war die Expression von PD-L1 klar korreliert mit dem Ansprechen und der Prognose: d.h. von den nicht vorbehandelten Patienten mit einer PD-L1-Expression von > 50% war sogar fast jeder Dritte (29,6%) nach 5 Jahren noch am Leben, unter denjenigen mit einer niedrigeren PD-L1-Expression (PD-L1: 1-49%) war es nur jeder siebte (15,7%). Ebenso war die Dauer der Behandlung mit dem Resultat korreliert, indem von den 60 Patienten, welche Pembrolizumab 2 Jahre lang erhalten hatten, noch 46 nach 5 Jahren am Leben waren. Immunologische Nebenwirkungen wurden in 17% dokumentiert, am häufigsten wurden leichte Hypothyreosen diagnostiziert und die bedrohlichste Nebenwirkung war die Pneumonitis mit 4%.
Es gilt zukünftig, diese hochwirksame Therapie weiter zu optimieren, zu individualisieren und evt. auch zu kombinieren mit anderen wirksamen Therapien und die Patienten, die eine hohe Aussicht auf Erfolg haben, upfront so zu behandeln.
ThC
Quelle: CO 2019, Garon EB et al Five-year long-term overall survival for patients with advanced NSCLC treated with pembrolizumab. Results from KEYNOTE-001. J Clin Oncol 37, 2019 (suppl. abstr. LBA 9015)
Da Vinci mal anders:
Phase-3-Studie MONALEESA-7 bringt die Optionen bei hormonsensitiven, HER2-negativen prämenopausalen Brustkrebspatientinnen einen Schritt weiter
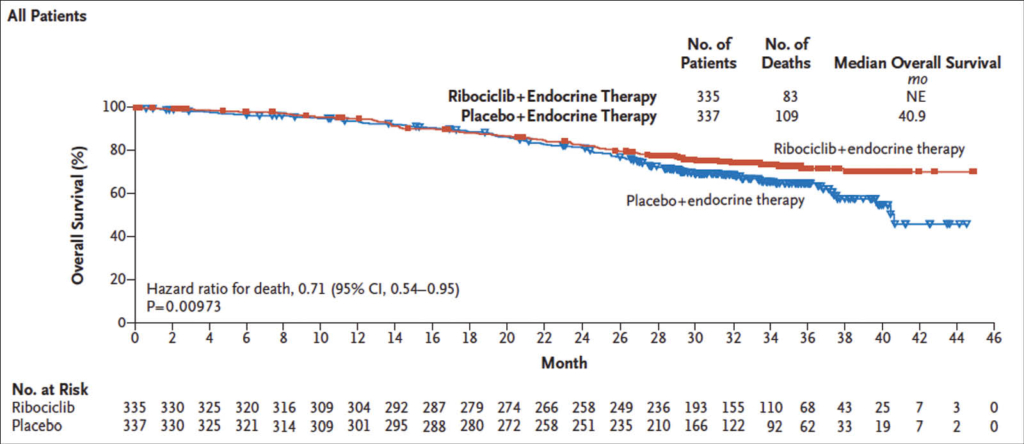
In dieser grossen Phase-3-Studie wurden 672 prämenopausale Frauen mit hormonsensitivem HER2-negativem Brustkrebs im fortgeschrittenen Stadium untersucht. Ribociclib, ein bereits auf dem Markt erhältlicher CDK4/6-Inhibitor, wurde in Kombination mit einer endokrinen Therapie (Goserelin, Tamoxifen oder einem Aromatase-Inhibitor) verabreicht und randomisert verglichen mit einem Placebo-kontrollierten Vergleichsarm. In dieser Studie, welche zeitgleich im NEJM publiziert wurde (Im, NEJM 2019), wurden nun die ersten OS-Daten der geplanten Interimsanalyse mit einer medianen Beobachtungsdauer von 42 Monaten vorgestellt. Es wurden im Behandlungsarm 83 (24.8%) und im Kontrollarm 109 (32.3%) Todesfälle registriert. Das errechnete OS nach 42 Monaten erreichte statistische Signifikanz mit 70.2% (95% CI, 63.5 bis 76.0) in der Ribociclib- und 46.0% (95% CI, 32.0 bis 58.9) in der Placebo-Gruppe (HR, 0.71; 95% CI, 0.54 bis 0.95; P = 0.0097).
Die nachfolgenden Systemtherapien, 68.9% in der Ribocylin- und 73.2% in der Placebo-Gruppe, waren in beiden Gruppen vergleichbar. Die erwähnten signifikanten OS-Resultate waren insbesondere für mit Aromatase-Hemmer behandelte Patientinnen dokumentiert, jedoch nicht (oder noch nicht) für die Tamoxifen-Gruppe. Hier gibt es Hinweise, dass es einen antagonistischen Effekt geben könnte und deshalb sollte in dieser Kombination Tamoxifen vorerst vermieden werden. Auch wurden in der mit Tamoxifen behandelten Ribocyclib-Gruppe vermehrt QT-Verlängerungen dokumentiert, allerdings ohne klinische Konsequenzen. Bezüglich Verträglichkeit sind keine neuen Beobachtungen gemacht worden und die Beobachtungszeit ist noch zu kurz, um unerwünschte Späteffekte ausschliessen zu können.
In Erinnerung rufen möchte ich hier die Paloma-3-Studie mit Palbociclib und endokriner Therapie in einer ähnlichen Population, welche trotz klarem PFS-Benefit bisher keinen OS-Vorteil zeigen konnte, auch nicht in der Subgruppe der prämenopausalen Frauen. Es darf erwartet werden, dass hier weitere klärende Datenanalysen und Follow-up-Ergebnisse noch folgen werden.
ThC
Hurvitz S. et al. ASCO 2019, LBA 1008
Neue Option bei der Erstbehandlung von CLL-Patienten mit Venetoclax und Obinutuzumab
In der Phase-3-Studie CLL14, initiiert von Köln, wurde untersucht, ob eine Erstlinientherapie mit Venetoclax und Obinutuzumab (VenG) gegenüber einem Kontrollarm mit Chlorambucil und Obinutuzumab (ClbG) bei Patienten mit therapiebedürftiger CLL und Komorbiditäten überlegen ist. Die Resultate dieser praxisrelevanten Studie wurden zeitgleich im NEJM publiziert (Fischer, NEJM 2019).
Die Patienten mit einem CIRS-Score >6 (Cumulative Illness Rating Scale), einer Kreatinin-Clearance <70 ml/min und mit unbehandelter CLL wurden 1:1 randomisiert zu einer je 12 Monate dauernden Therapie mit VenG versus ClbG, wobei Venetoclax in der Dosis von 400 mg täglich verabreicht wurde. Der primäre Endpunkt war das PFS, sekundärer Endpunkt war insbesondere MRD-Negativität im Blut und Knochenmark.
Es wurden 432 Patienten randomisiert. Die OR Rate betrug 84.7% für VenG versus 71.3% (p<0.001) für ClbG. Nach 29 Monaten medianer Beobachtungszeit zeigte sich das PFS im VenG-Arm gegenüber dem ClbG-Vergleichs-Arm deutlich verbessert. Dabei waren ein Jahr nach Abschluss der Therapie im VenG-Arm 88.2% und im ClbG-Arm noch 64.1% ohne Progression (HR 0.35; 95% CI 0.23-0.53; P<0.0001). Auch die MRD-Negativität war signifikant höher im Ven/O-Arm gegenüber dem Clb/O-Arm in both PB (76% vs. 35% [P<0.0001]) und BM (57% vs 17% [P<0.0001]) 3 nach Therapie Ende. Insgesamt 75% der Ven/O-Patienten, welche im Blut MRD-negativ waren, waren auch im Knochenmark negativ versus 49% in der ClbG-Kontroll-Gruppe. Der MRD-Status nach einem Jahr war stark korreliert mit dem PFS. Eine höhere MRD-Negativitäts-Rate wurde früher und anhaltend mit VenG in 81% versus 27% im ClbG-Kontrollarm erreicht. Die Toxizitäten (Grade 3-4) mit VenG und ClbG waren Leukopenien in 52.8% versus 48.1% und Infektionen in 17.5% versus 15.0%. Neue Sicherheitssignale wurden nicht beobachtet. Allerdings ist zu vermerken, dass die Gesamtmortalität in der Studie für VenG 9.3% betrug versus 7.9% für ClbG, was statistisch zwar nicht signifikant war, aber zur Vorsicht mahnen sollte. Langzeitresultate werden wichtig sein, um den Stellenwert dieser Therapie richtig einschätzen zu können neben den vielen anderen Optionen.
Diese neue Kombinationstherapie mit VenG wurde von der FDA in einem neuen Verfahren – «FDA’s Real-Time Oncology Review and Assessment Aid pilot programme» – bereits in den USA zugelassen und dürfte bald auch andernorts eine der Standard-Optionen werden.
ThC
Quelle: Fischer K et al. Effect of fixed-duration venetoclax plus obinutuzumab on progression-free survival, and rates and duration of minimal residual disease negativity in previously untreated patients with chronic lymphocytic leukemia and comorbidities. J Clin Oncol 2019; 37 (supp. abstr. 7502)
Wirksamkeit und Sicherheit der Kombination von Nivolumab (NIVO) plus Ipilimumab (IPI)
Patienten mit symptomatischen Melanom-Hirnmetastasen (CheckMate 204)
Über die Wirksamkeit und Sicherheit von NIVO+IPI bei Patienten mit unbehandelten, asymptomatischen Melanom-Hirnmetastasen (MBM) wurde bereits aus der CheckMate 204-Studie berichtet. Der folgende Bericht ist der erste zu NIVO+IPI bei Patienten mit symptomatischen MBM und es wird über aktualisierte Daten bei Patienten mit asymptomatischem MBM berichtet.
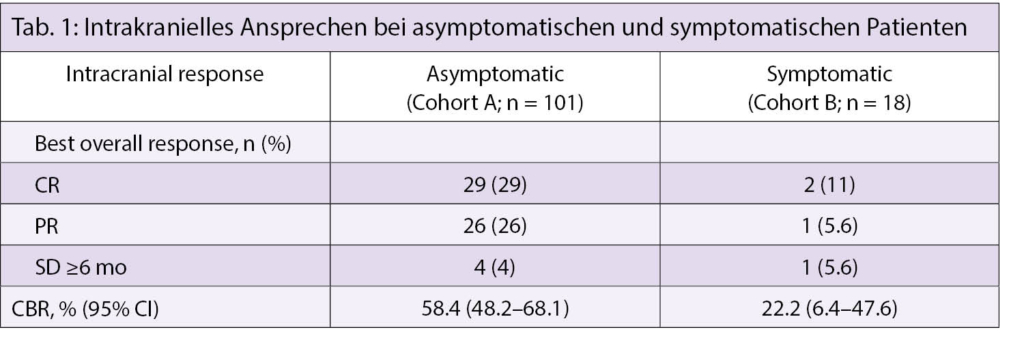
In diesePhase-II-Studie wurden Patienten mit ≥1 messbaren, nicht bestrahlten MBM 0,5-3,0 cm in zwei Kohorten aufgenommen: 1. diejenigen ohne neurologische Symptome oder Steroid-Therapie (asymptomatisch; Kohorte A); und 2. diejenigen mit neurologischen Symptomen, unabhängig davon, ob sie Steroide erhielten oder nicht (symptomatisch; Kohorte B). In beiden Kohorten erhielten die Patienten NIVO 1 mg/kg + IPI 3 mg/kg Q3W × 4, darauf NIVO 3 mg/kg Q2W bis zur Progression oder Toxizität. Der primäre Endpunkt war die intrakranielle klinische Nutzensrate (CBR; Anteil der Patienten mit kompletter Ansprache [CR] + partielle Ansprache [PR] + stabile Erkrankung [SD] ≥6 Monate). Am klinischen Stichtag, 1. Mai 2018, waren alle behandelten Patienten (101 in Kohorte A und 18 in Kohorte B) während 6 Monaten oder länger beobachtet worden.
In dieser aktualisierten Analyse der Kohorte A (medianes Follow-up von 20.6 Monaten) betrug die CBR 58,4% (Tab. 1). In Kohorte B erhielten die Patienten im Median 1 NIVO+IPI-Dosis, und 2 von 18 Patienten (11%) erhielten alle 4 Dosen. Bei einem medianen Follow-up von 5.2 Monaten in Kohorte B betrug die intrakranielle objektive Ansprechrate 16,7% und die CBR 22,2%. Nebenwirkungen vom Grad 3/4 traten in 54,5% der Patienten in der Kohorte A und in 55,6% der Patienten in der Kohorte B auf (6,9% bzw. 16,7% im Nervensystem), wobei ein Todesfall mit der Behandlung in der Kohorte A zusammenhängt (immunbedingte Myokarditis).
Bei Patienten mit asymptomatischem MBM zeigen die aktualisierten Ergebnisse eine hohe Rate an dauerhaftem intrakraniellem Ansprechen und unterstützen NIVO+IPI als Erstlinientherapie in dieser Population. Die intrakranielle Antitumoraktivität wurde mit NIVO+IPI bei Patienten mit symptomatischem MBM beobachtet. Es bedarf jedoch weiterer Studien, um die biologischen Mechanismen der Resistenz gegen die Immuntherapie zu verstehen und die Behandlungen in dieser herausfordernden Population zu verbessern.
WFR
Quelle: Hussein Abdul-Hassan Tawbi et al. Efficacy and safety of the combination of nivolumab (NIVO) plus ipilimumab (IPI) in patients with symptomatic melanoma brain metastases (CheckMate 204). J Clin Oncol 37, 2019 (suppl; abstr 9501) CheckMate 204_BMS Melanoma
Die Qual der Wahl
Was ist nun der Standard beim hormonsensitiven fortgeschrittenen Prostatakarzinom?
Nach Jahrzehnten Desinteresse der Pharmafirmen am Prostatakarzinom, folgen sich nun in hoher Kadenz gleich mehrere hochwirksame Medikamente als Ergänzung zur etablierten Hormonblockade mit LHRH-Medikamenten bei Patienten mit hormonsensitivem Prostatakarzinom. Das Ziel, die Krankheitsprogression gegenüber einer bisher etablierten Androgen-deprivierenden Therapie (ADT) weiter hinaus zu zögern und das Gesamtüberleben durch eine maximale Androgenblockade zu verlängern, wird damit klar erreicht.
Die positiven Daten aus diesen sehr grossen Studien mit neuen oder erweiterten Indikationen sind letztlich vergleichbar. Nun haben wir also, neben dem bewährten Abirateron (Zytiga), auch Apalutamid (Erleada), Enzalutamid (Xtandi) und bald auch Darolutamid zur Verfügung, um die Androgenblockade zu optimieren und die bisherige weniger wirksame ADT der nicht-steroidalen Anti-Androgene wie Bicalutamid, Nilutamid oder Fluatamid weiter zu verdrängen.
Am ASCO wurden zeitgleich mit der Publikation im NEJM die Daten der Phase-3-TITAN-Studie vorgestellt. Apalutamid plus ADT führte bei 1052 1:1 randomisierten Patienten, im Vergleich zu Placebo plus ADT, zu einer signifikanten Verlängerung des OS bei einer Reduktion des Mortalitätsrisikos um 33 Prozent (HR=0,67; 95 % CI, 0,51-0,89; P=0,0053). In beiden Studienarmen wurde das mediane OS noch nicht erreicht. Die Kombination aus Apalutamid plus ADT resultierte ausserdem in einer signifikanten Verbesserung des rPFS mit einer Reduzierung der radiologischen Progression oder der Mortalität um 52 Prozent im Vergleich zu Placebo plus ADT (HR=0,48; 95 % CI, 0,39-0,60; P<0,0001). Das mediane rPFS betrug 22,1 Monate bei dem Placebo-ADT-Arm und wurde im Apalutamid-ADT-Arm noch nicht erreicht. Die Zwei-Jahres-OS-Raten nach einer medianen Nachbeobachtungszeit von 22,7 Monaten betrugen 82 Prozent bei Apalutamid plus ADT im Vergleich zu 74 Prozent beim Placebo-ADT-Arm. Damit wird eine Indikationserweiterung für Patienten mit metastasierendem hormonsensitivem Prostatakarzinom erwartet.
Dass hier bereits weitere Substanzen am Horizont sind, zeigt die grosse randomisierte SAKK 08/16 Studie mit Darolutamid (einem weiteren 2.-Generations-Androgenrezeptor-Antagonist), nun als Erhaltungstherapie bei Patienten mit hormonrefraktärem metastasierendem Prostatakarzinom eingesetzt, welche nach einer Antigenrezeptortherapie und anschliessender Taxan-Therapie nicht progredient sind. Sie wurde als Poster von PD Dr. med. Richard Cathomas (ASCO 2018) vorgestellt. Sie rekrutiert seit 2017 in der Schweiz und in Italien und sucht weitere Partner.
In der Enzalutamid-Studie (ENZAMET-Trial), welche von Australien und Neuseeland geleitet wurde, wurden 1125 Patienten 1:1 randomisiert zu Enzalutamid und ADT oder ADT alleine. Nach median 34 Monaten wurde diese Auswertung gemacht: 80% der mit Enzalutamid behandelten Männer waren am Leben versus 72% der Männer im Kontrollarm. Von 596 Männern mit einem hohen Tumorvolumen lebten 71% versus 64% im Kontrollarm. Bei den 529 Männern mit kleinerem Tumorvolumen waren 90% versus 82% im Kontrollarm noch am Leben. Das Risiko zu versterben wurde im Behandlungsarm um 33% gegenüber dem Kontrollarm reduziert und ist praktisch identisch mit dem Resultat der oben angeführten TITAN-Studie. SAEs wurden im Enzalutamid Arm in 42% dokumentiert versus 34% im Kontrollarm.
Die Diskussion über die individualisierte Optimierung der Behandlung der Patienten mit hormonsensitivem metastasierendem Prostatakarzinom hat damit erst so recht begonnen. Auch Docetaxel ist weiterhin eine wichtige Alternative und die knochenschützenden Massnahmen müssen weiterhin strikt beachtet werden.
ThC
Chi KN et al J Clin. Oncol. 2019; 37: (suppl. Abstract 5006 (Titan-Trial) Sweeny Ch et al J Clin. Oncol.2019;37:suppl. Abstract LBA 2 (ENZAMET-Trial)
Endlich eine neue aktive Substanz bei Kleinzeller: Lurbinectidin!
Lurbinectidin ist ein synthetisches Analog von Trabectidine, also letztlich ein Abkömmling aus der faszinierenden Meeresbiologie. Lurbinectidin hemmt die RNA-Polymerase II und stört dadurch die transaktivierte Transkription, was zur Apoptose führt. Ein Synergismus mit Anthrazyklinen wird postuliert.
In dieser multizentrischen einarmigen Basket Studie wurden 105 vorbehandelte Patienten mit SCLC eingeschlossen (abstract 8506). Die Patienten erhielten 3.2 mg/m2 Lurbinectidin als 1-h iv Infusion alle 3 Wochen.
Grad 3-4 Toxizität wurde in 35% der Patienten registriert und bestand hauptsächlich aus Neutropenia (22.9%), Anämie (6.7%), Fatigue (6.7%), Thrombozytopenie (4.8%), febriler Neutropenie (4.8%), und Pneumonia (1.9%).
Die Ansprechrate betrug 35.2% (37/105) und ebenso bemerkenswert war, dass weitere 35 Patienten eine SD (stable disease) aufwiesen, so dass die Krankheits-Kontrollrate 68.6.% betrug. Eine Tumorregression wurde bei 65% der Patienten dokumentiert und 5 von 8 Patienten, welche auf eine Immuntherapie refraktär waren, haben angesprochen. Die mediane Dauer des Ansprechens betrug 5.8 Monate. Patienten, welche auf die vorgängige Therapie gut angesprochen hatten, zeigten eine Ansprechrate von 44% versus 22% für refraktäre Patienten.
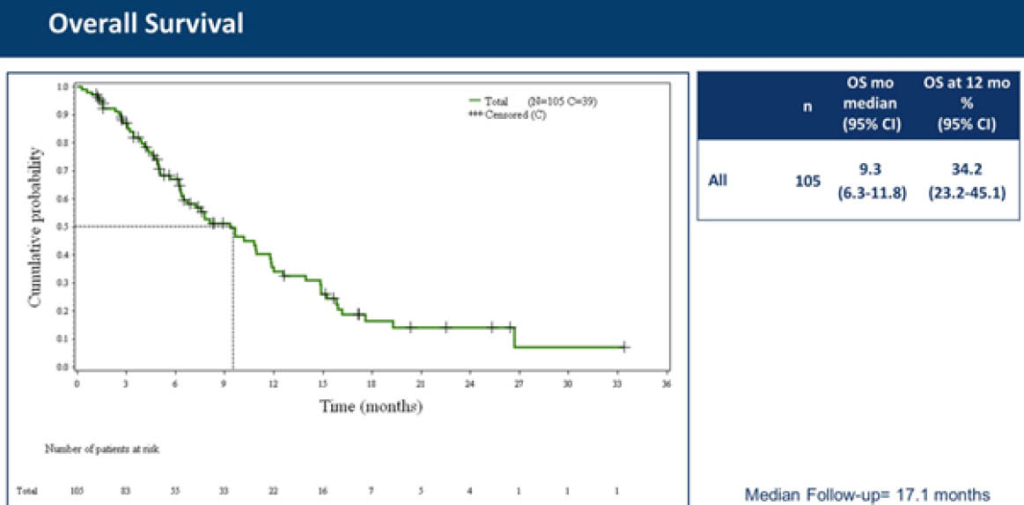
Nach einer medianen Beobachtungsdauer von 17.1 Monaten betrug das mediane OS 9.3 Monate und das 1 - Jahres OS betrug 34.2%. Für auf eine vorgängige Therapie ansprechende Patienten betrug das OS 11.9 Monate versus 5.0 Monate für primär resistente Patienten. Eine grosse Phase 3 Zulassungs-Studie («Atlantis» N:600) von Lurbinectdin+Doxorubicin versus Standardtherapie sollte Mitte Jahr die nötige Fallzahl erreicht haben. Nun endlich nach >20 Jahren wieder ein klar aktives Medikament beim Kleinzeller!
ThC
Quelle: Paz-Ares LG et al. Efficacy and safety profile of Lurbinectidin in second-line SCLC patients. Results from a phase II single-agent trial. J Clin Oncol 2019; 37 (supp. 8506)
Protokollspezifizierte Endanalyse der Phase-III-KEYNOTE-048-Studie
Protokollspezifizierte Endanalyse der Phase-III-KEYNOTE-048-Studie mit Pembrolizumab (Pembro) als Erstlinientherapie für rezidivierendes/metastasiertes Kopf- und Hals-Plattenzellkarzinom (R/M HNSCC).
KEYNOTE-048 ist eine Phase-III-Studie mit Pembrolizumab (Pembro) oder mit Pembro + Chemo (C) vs. EXTREM (E) als First-Line-Therapie bei R/M HNSCC. Bei der zweiten Zwischenanalyse (IA2) verbesserte Pembro das OS signifikant im PD-L1-kombinierten positiven Score (CPS) um ≥20 und in ≥1 Population und zeigte ein nicht-unterlegenes OS in der Gesamtbevölkerung mit günstiger Sicherheit; Pembro +Chemo verbesserte das OS in der Gesamtbevölkerung signifikant bei vergleichbarer Sicherheit. Die Autoren präsentierten die protokollspezifizierten Endergebnisse.
882 Patienten mit lokal unheilbarem R/M HNSCC und keiner vorherigen systemischen Therapie im R/M-Setting, die eine Tumorprobe für den PD-L1-Test lieferten, wurden randomisiert mit Pembro 200 mg Q3W während 24 Monaten (n = 301), Pembro für 24 Monate + 6 Zyklen C (Cisplatin 100 mg/m2 oder Carboplatin AUC 5 Q3W + 5-FU 1000 mg/m2/d während 4 Tagen Q3W) (n = 281), oder E (Cetuximab 400 mg/m2 Belastung/250 mg/m2 QW + 6 Zyklen Chemo) (n = 300) behandelt. Die OS-Überlegenheit wurde sequentiell auf Pembro + C vs. E in der CPS ≥20-Population, dann auf die CPS ≥1-Population und auf Pembro vs. E in der Gesamtbevölkerung getestet (Überlegenheitsgrenzen: einseitig P = 0.0023, 0.0026 und 0.0059). Der Datenschnitt erfolgte am 25. Februar 2019 (ca. 25 Monate nach Randomisierung des letzten Patienten).
Pembro + C verbesserte das OS vs. E deutlich in der CPS ≥20 (HR 0,60, 95% CI 0,45-0,82, P = 0.0004; Median 14,7 vs. 11,0 Monate) und der CPS ≥1 Population (HR 0,65, 95% CI 0,53-0,80, P< 0.0001; Median 13,6 vs. 10,4 Monate). Die HR (95% CI) für PFS betrug 0,76 (0,58-1,01) für CPS ≥20 und 0,84 (0,69-1,02) für CPS ≥1. ORR (Pembro + C vs. E) war 42,9% vs. 38,2% für CPS ≥20 und 36,4% vs. 35,7% für CPS ≥1; das mediane DOR betrug 7,1 vs. 4,2 Monate und 6,7 vs. 4,3 Monate. Pembro verbesserte das OS vs. E in der Gesamtbevölkerung nicht signifikant (HR 0,83, 95% CI 0,70-0,99, P = 0.0199; Median 11,5 vs. 10,7 Monate). Die HR (95% CI) für PFS betrug 1,29 (1,09-1,53). ORR (Pembro vs. E) betrug 16,9% vs. 36,0%; das mediane DOR lag bei 22,6 vs. 4,5 Monate. Grad 3-5 AE-Raten infolge jeglicher Ursache lagen bei 54,7% für Pembro, 85,1% für Pembro + C und 83,3% für E.
Fazit:
Insgesamt zeigte KEYNOTE-048, dass Pembro + C im Vergleich zu E ein überlegenes OS in der PD-L1 CPS ≥20, der CPS ≥1 und der Gesamtpopulationen mit vergleichbarer Sicherheit hatte und dass Pembro ein überlegenes OS in den CPS ≥20 und ≥1 Populationen, ein nicht unterlegenes Os in der Gesamtpopulation und eine günstige Sicherheit hatte . Diese Ergebnisse unterstützen Pembrolizumab und Pembrolizumab + Platin + 5-FU als neue 1L-Standards der Versorgung für R/M HNSCC.
WFR
Quelle: Rischin D et al. Protocol-specified final analysis of the phase 3 KEYNOTE-048 trial of pembrolizumab (pembro) as first-line therapy for recurrent/metastatic head and neck squamous cell carcinoma (R/M HNSCC). J Clin Oncol 37, 2019 (suppl; abstr 6000)
Immuntherapie beim Nierenzellkarzinom
Sicherheit und Wirksamkeit von Nivolumab plus Ipilimumab (NIVO+IPI) bei Patienten mit fortgeschrittenem Nierenzellkarzinom (aRCC) mit Hirnmetastasen: Zwischenanalyse von CheckMate 920.
Frühere klinische Studien mit Patienten mit aRCC, einschliesslich CheckMate 214, haben Patienten mit Hirnmetastasen weitgehend ausgeschlossen. Allerdings wurde eine Antitumoraktivität bei Melanom-Patienten mit Hirnmetastasen, die mit NIVO 1 mg/kg + IPI 3mg/kg behandelt wurden, und bei Patienten mit nicht-kleinzelligem Lungenkrebs, die mit NIVO 240 mg + IPI 1mg/kg behandelt wurden, beobachtet. CheckMate 920 ist eine laufende klinische Studie der Phase 3b/4 zur Behandlung von NIVO + IPI bei Patienten mit aRCC, die hohen medizinischen Bedarf haben.
Die Autoren stellen die Zwischenergebnisse zur Sicherheit und Wirksamkeit für die Kohorte der Patienten mit Hirnmetastasen vor.
Patienten mit bisher unbehandeltem aRCC jeglicher Histologie, mit asymptomatischen Hirnmetastasen (nicht unter Kortikosteroiden oder Bestrahlung) und Karnofsky-Leistungsstatus ≥70% wurden einer Behandlung mit NIVO 3 mg/kg + IPI 1 mg/kg alle 3 Wochen für 4 Dosen zugeordnet, gefolgt von NIVO 480 mg alle 4 Wochen. Die Patienten wurden bis zur Progression der Erkrankung, bis zu inakzeptabler Toxizität oder maximal 2 Jahre lang behandelt. Der primäre Endpunkt war die Häufigkeit von hochgradigen immunvermittelten Nebenwirkungen (IMAEs). Wichtige sekundäre Endpunkte waren das progressionsfreie Überleben (PFS) und die objektive Ansprechrate (ORR) unter RECIST v1.1 pro Prüfer. Die explorativen Endpunkte umfassten zusätzliche Sicherheitsanalysen und das Gesamtüberleben (OS).
Insgesamt wurden 28 Patienten in die Kohorte der Hirnmetastasen aufgenommen. Bei einer minimalen Nachbeobachtungszeit von 6,47 Monaten wurden in 6 Fällen IMAEs der Klasse 3-4 innerhalb von 100 Tagen nach der letzten Dosis gemeldet. Die in ≥ 1 Fällen beobachteten Grad 3-4 IMAEs waren Durchfall, Kolitis, diabetische Ketoazidose, immunvermittelte Hepatitis, Hypophysitis und Ausschlag jeglicher Art (n = je 1). Es wurden keine behandlungsbezogenen IMAEs von Grad 5 gemeldet. Das ORR unter RECIST v1.1 pro Prüfer in allen behandelten Probanden betrug 28,6% (95% CI 13.2-48.7). Das mediane PFS bei allen behandelten Patienten betrug 9,0 Monate (95% CI 2,9 bis nicht erreicht). Das mittlere OS wurde nicht erreicht (95% CI 13.1 bis nicht erreicht).
Bei Patienten mit aRCC und Hirnmetastasen, die oft von klinischen Studien ausgeschlossen werden, zeigte die NIVO + IPI-Behandlung ein Sicherheitsprofil, das mit früheren Berichten über dieses Dosierungsschema übereinstimmt, bei einer ermutigenden Antitumoraktivität.
WFR
Quelle: Emamekhoo H et al. Safety and efficacy of nivolumab plus ipilimumab (NIVO+IPI) in patients with advanced renal cell carcinoma (aRCC) with brain metastases: Interim analysis of CheckMate 920. J Clin Oncol 37, 2019 (suppl; abstr 4517)
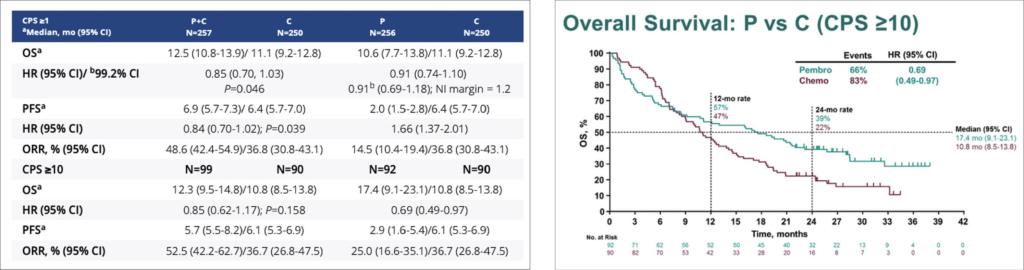
Pembrolizumab +/- Chemo und Chemo alleine beim Magenkarzinom
Die Keynote-062 4, eine 4-armige Phase-3-Studie, untersuchte als Erstlinien-Therapie Pembrolizumab versus Standardchemotherapie versus Pembrolizumab und Standardchemotherapie bei 737 Patienten mit fortgeschrittenem, PDL1-positivem, HER2-negativem Magenkarzinom, davon 146 Patienten mit GEJ-Karzinom. Die Studie wurde als Non-inferiority-Studie konzipiert. Pembrolizumab erwies sich gegenüber Chemotherapie als nicht unterlegen, dabei war die Kombination von Pembrolizumab und Chemotherapie auch besser als alleinige Chemotherapie. Bei Patienten mit einem PDL1 CPS von ≥10 war Pembrolizumab allerdings einer Chemotherapie signifikant überlegen (HR = 0.69, P < 0.05).
Die folgende Tabelle zeigt die klinischen Resultate entsprechend der PDL1-Expression der Patienten.
Die OS-Daten für die Patienten-Subgruppe mit einer CPS >10 sind auf der nächsten Kurve zu sehen. Dabei ist zu beachten, dass initial das OS schlechter ist für Pembrolizumab und erst nach 9 Monaten einen dann allerdings klinisch signifikanten Vorteil zeigt (median OS 17.4. versus 10.8. Monate.).
Die Konklusion der Studie ist, dass Pembrolizumab einer Chemotherapie nicht unterlegen ist, klar besser verträglich war und bei der Patienten-Gruppe mit CPS >10 nach 9 Monaten einen OS-Vorteil erbringt.
ThC
Quelle: Tabernero J et al. J Clin Oncol 37, 2019 (suppl; abstr LBA4007)
Nierenzellkarzinom mit sarkomatösen Merkmalen
CheckMate 214 Post-Hoc-Analysen von Nivolumab plus Ipilimumab oder Sunitinib bei IMDC-Patienten mit intermediärem/niedrigem Risiko mit bisher unbehandeltem fortgeschrittenem Nierenzellkarzinom mit sarkomatösen Merkmalen.
Patienten mit fortgeschrittenem Nierenzellkarzinom mit sarkomatösen Merkmalen (sRCC) haben eine schlechte Prognose und suboptimale Ergebnisse unter einer gezielten Anti-VEGF-Therapie. Nivolumab plus Ipilimumab (N+I) zeigte in bisher unbehandelten Patienten mit International Metastatic RCC Database Consortium (IMDC) intermediärem/niedrigem (I/P)-Risiko, klarzelligem, fortgeschrittenem RCC in der Phase-3-CheckMate 214-Studie eine überlegene objektive Ansprechrate (ORR) und ein Gesamtüberleben (OS) gegenüber Sunitinib (S).
In der vorliegenden Studie wurde eine post-hoc explorative Analyse von N+I vs. S bei CheckMate 214 sRCC-Patienten durchgeführt. Das Vorhandensein von sarkomatösen Merkmalen wurde durch die Stichwortsuche nach «sarcomatoid» bei Patienten bewertet, bei denen lokale Pathologieberichte von Tumorproben aus der Vorbehandlung vorlagen.
842 (77%) der 1096 Intention-to-Treat-Patienten verfügten über lokale Pathologieberichte, darunter 112 randomisierte Patienten mit I/P-Risiko-SRCC (N+I, n = 60; S, n = 52). Die Basiseigenschaften der sRCC-Patienten waren zwischen den Behandlungsarmen ausgeglichen. Insbesondere hatten 47% vs. 53% der I/P-Risiko sRCC-Patienten in den N+I und S Armen eine Tumor PD-L1 Expression ≥1% bei Studienbeginn, die höher war als in allen I/P-Risikopatienten (N+I, 26% vs. S, 29%). Bei deskriptiven Analysen nach einer minimalen Nachbeobachtungszeit von 30 Monaten, waren bestätigte ORR und komplette Ansprechraten pro Prüfer (nach RECIST v1.1), OS und progressionsfreies Überleben (PFS) pro Prüfer unter N+I vs. S in I/P-Risikopatienten mit sRCC besser (Tab. 1). Es wurden keine neuen Sicherheitssignale bei sRCC-Patienten gesehen.
In dieser post-hoc deskriptiven Subgruppenanalyse von CheckMate 214 zeigte N+I eine vielversprechende Wirksamkeit und ein verlängertes Überleben gegenüber S, bei gleichbleibender Sicherheit, bei bisher unbehandelten Patienten mit, I/P-Risiko, fortgeschrittenem klarzelligem RCC mit sarkomatösen Merkmalen. Prospektive Studien von N+I, die Patienten mit sRCC beinhalten, sind im Gange.
WFR
Quelle: McDermott DF et al. CheckMate 214 post-hoc analyses of nivolumab plus ipilimumab or sunitinib in IMDC intermediate/poor-risk patients with previously untreated advanced renal cell carcinoma with sarcomatoid features. J Clin Oncol 37, 2019 (suppl; abstr 4513)
ImPassion130-Studie
Ergebnisberichte von Patienten der Phase-III-Impassion130-Studie mit Atezolizumab plus Nabpaclitaxel bei metastasiertem triple-negativem Brustkrebs (mTNBC).
In der IMpassion130-Studie in der First-Line-Therapie bei mTNBC (N = 902) war PFS mit Atezo + nP signifikant besser als mit Placebo (P) + nP bei ITT (HR, 0,80) und PD-L1 IC+ Patienten (HR, 0,62). Klinisch bedeutsame OS-Verbesserungen (HR, 0,62) wurden auch bei PD-L1+ Patienten gesehen. PROs wurden verwendet, um Patienten-Perspektiven auf den klinischen Gesamtnutzen von Atezo + nP zu dokumentieren.
Die Patienten erhielten entweder Atezo 840 mg oder P q2w + nP 100 mg/m2 an den Tagen 1, 8 und 15 eines jeden 28-Tage-Zyklus bis zur Progression der Krankheit oder Intoleranz. Die Patienten absolvierten das EORTC QLC-C30 und das Brustkrebsmodul (QLQ-BR23) am ersten Tag eines jeden Zyklus, am Ende der Behandlung und q4w während der Nachbeobachtung während eines Jahres. Die Zeit bis zur Verschlechterung der HRQol (TTD; erste ≥ 10-Patienten-Abnahme gegenüber Baseline während 2 Zyklen) war ein vordefinierter sekundärer Endpunkt. Zu den explorativen Endpunkten gehörten TTD in der Funktion sowie der MIttelwert und die mittlere Veränderung der BL-Scores (Änderungen ≥ 10 wurden als klinisch bedeutsam erachtet) in HRQoL, Funktion und Krankheits-oder therapiebezogenen Symptomen.
Die Baseline-Completion betrug 92% (QLQ-C30) und 89% (QLQ-BR23) und blieb > 80% während des Zyklus 20 in ITT und PD-L1 IC+ Patienten. Keine Unterschiede wurden im medianen TTD bei der HRQoL (ITT: HR, 0,97[95% CI: 0,80, 1,18]; PD-L1 IC+: HR, 0,94[95% CI: 0,69, 1,28]), der körperlichen Funktion (ITT: HR, 1,04[95% CI: 0,86, 1.26]; PD-L1 IC+: HR, 1.02 [95% CI: 0.76, 1.37]) oder der Rollenfunktion (ITT: HR, 1.01[95% CI: 0.83, 1.22]; PD-L1 IC+: HR, 0.77[95% CI: 0.57, 1.04]) zwischen den Armen in beiden Therapiegruppen beobachtet. Die Durchschnittswerte bei BL für HRQoL (ITT: 66,0 [Atezo + nP] vs. 64,3[P + nP]; PD-L1 IC+: 67,5 vs. 65,0), für die körperliche Funktion (ITT: 80,4 vs. 79,2; PD-L1 IC+: 82,8 vs. 79,4) und für die Rollenfunktion (ITT: 72,7 vs. 71,0; PD-L1 IC+: 73,7 vs. 71,7) waren ähnlich zwischen den Armen und im Verlauf der Therapie. In beiden Armen waren HRQoL, Körper- und Rollenfunktion und therapiebedingte Symptome (Müdigkeit, Durchfall, Übelkeit, Erbrechen) während der Therapie stabil, wobei keine klinisch bedeutsamen Veränderungen beobachtet wurden, bis die Patienten die Therapie einstellten. PRO-Daten deuten darauf hin, dass Atezo + nP tolerierbar und ähnlich wie nP allein bei der Aufrechterhaltung der HRQoL und der täglichen Funktion im Vergleich zur Baseline war. Dies bestätigt, dass Atezo + nP einen klinischen Nutzen hatte, ohne die HRQoL, die physische und die Rollenfunktion zu beeinträchtigen oder die Therapie-bedingten-Symptome gegenüber P + nP bei 1L mTNBC zu verschlechtern.
Quelle: Adams S et al Patient-reported outcomes (PROs) from the phase III IMpassion130 trial of atezolizumab (atezo) plus nabpaclitaxel (nP) in metastatic triple-negative breast cancer (mTNBC). J Clin Oncol 37, 2019 (suppl; abstr 1067)
Impassion 130: Erweiterte Sicherheitsanalyse aus einer P3-Studie mit Atezolizumab (A) +nab-paclitaxel (np) bei Patienten mit Therapie-naivem, lokal fortgeschrittenem triple negativem Brustkrebs (mTNBC).
IMpassion130 zeigte einen PFS-Vorteil mit A + nP vs. Placebo (P) + nP als First-Line-Therapie bei mTNBC in ITT und PD-L1 IC+ Patienten. Die Studie berichtet über erweiterte Sicherheitsdaten mit 4,5 Monate längerem Follow-up (FU), wobei der Fokus auf unerwünschte Ereignisse von besonderem Interesse (AESI), die möglicherweise immunitätsbedingt sind, lag.
Patienten mit inoperablem lokal fortgeschrittenem oder mTNBC erhielten nP 100 mg/m2 i.v. (an den Tagen 1, 8 und 15 eines 28-Tage-Zyklus) + A 840 mg i.v. q2w oder P bis zur Krankheitsprogression oder Toxizität. Sicherheit war ein sekundärer Endpunkt. Mit 15,6 Monaten medianem FU hatten von 453 Patienten mit A+nP und 437 Patienten mit P+nP 49% und 43% Grad 3/4, 1% und <1% Grad 5 unerwünschte Ereignisse. 23% und 19% hatten schwere AEs, und 58% und 42% hatten AESI. Die meisten AESI (≥86%; in beiden Armen) waren Grad 1/2. 14% unter A+nP vs. 6% unter P + nP erhielten systemische Kortikosteroide innerhalb von 30 Tagen nach Beginn der AESI. Die einzigen Unterschiede in AESI zwischen A + nP vs. P + nP waren Ausschlag (34% vs. 26%), Hypo- (18% vs. 5%) und Hyperthyreose (5% vs. 1%) sowie Pneumonie (4% vs. <1%). Die Hauptursache für Abbruch war periphere Neuropathie, wobei Klasse 3 6% der Patienten unter A + nP gegenüber 3% unter P + nP betraf. Die mediane Zeit bis zum Einsetzen des AESI (TTO) war konsistent mit Atezolizumab-Monotherapie-Studien.
A + nP hatte ein tolerierbares Sicherheitsprofil, ohne bedeutende Änderungen seit dem primären Datenschnitt. Bei längerem FU wurden keine kumulativen Toxizitäten oder neue oder spät einsetzende Sicherheitssignale beobachtet.
Quelle: Schneeweiss A et al. IMpassion130: Expanded safety analysis from a P3 study of atezolizumab (A) + nab-paclitaxel (nP) in patients (pts) with treatment naïve, locally advanced or metastatic triple-negative breast cancer (mTNBC). J Clin Oncol 37, 2019 (suppl; abstr 1068)
IMpassion130: Aufdatiertes Gesamtüberleben (OS) in einer globalen, randomisierten, doppelblinden, kontrollierten Phase-III-Studie mit Atezolizumab (atezo) + nab-Paclitaxel (nP) bei vorher unbehandelten Patientinnen mit lokal fortgeschrittenem oder metastasierendem triple-negativen Brustkrebs (mTNBC).
IMpassion130 evaluierte Atezo (Anti-PD-L1) + nP vs. Placebo + nP in der First-Line-Therapie bei mTNBC. Die primäre PFS-Analyse ergab, dass Atezo + nP das PFS in intent-to-treat (ITT) und PD-L1+ Patienten gegenüber Placebo + nP signifikant verbesserte, wobei die Wirksamkeit von der PD-L1+ Population bestimmt wurde. Zu diesem Zeitpunkt wurde die erste OS-Zwischenanalyse durchgeführt (Schmid, NEJM 2018). In der vorliegenden Studie wird über die 2. Zwischenanalyse des OS berichtet.
Wählbare Patientinnen hatten histologisch dokumentierten lokal fortgeschrittenen Brustkrebs oder mTNBC, ECOG PS 0-1 und Tumorgewebe für die PD-L1-Tests. Die Patientinnen wurden 1:1 zu i.v. Atezolizumab 840 mg oder Placebo randomisiert und wurden am Tag 1 und Tag 15 + nP 100 mg/m2 an den Tagen 1, 8 und 15 jedes 28-Tage-Zyklus bis zur Progression behandelt (Stratifikationsfaktoren waren vorherige Taxane, Lebermetastasen, PD-L1 auf tumorinfiltrierenden Immunzellen [IC]). RECIST 1.1 PFS (in ITT und PD-L1+ Patientinnen) und OS (getestet in ITT und, wenn signifikant, PD-L1+ Patientinnen) waren co-primäre Endpunkte.
Die OS-Daten sind in der Tabelle 2 wiedergegeben. Zum Zeitpunkt der Datenüberprüfung (2.1.2019) befanden sich 9% der Patientinnen im Atezo + nP Arm und 3% im Placebo + nP Arm noch in Behandlung. Die statistische Signifikanz wurde in den ITT-Patientinnen nicht nachgewiesen, aber eine Verbesserung des medianen OS um 7,0 Monate wurde in PD-L1+-Patientinnen mit Atezo + nP (25,0 Monate) vs. Placebo + nP (18,0 Monate; HR, 0,71[95% CI: 0,54, 0,93]) beobachtet. Ein Sicherheitsupdate nach 4.5 Monaten (Schneeweiss, ASCO 2019, eingereicht) zeigte, dass Atezo + nP tolerierbar blieb.
Die zweite IMpassion130 Interims-OS-Analyse stand im Einklang mit der ersten Analyse und bestätigte den klinisch bedeutsamen OS-Nutzen mit Atezo + nP bei bisher unbehandeltem PD-L1+ mTNBC.
Quelle: Schmid P. et al. IMpassion130: updated overall survival (OS) from a global, randomized, double-blind, placebo-controlled, Phase III study of atezolizumab (atezo) + nab-paclitaxel (nP) in previously untreated locally advanced or metastatic triple-negative breast cancer (mTNBC). J Clin Oncol 37, 2019 (suppl; abstr 1003)
WFR
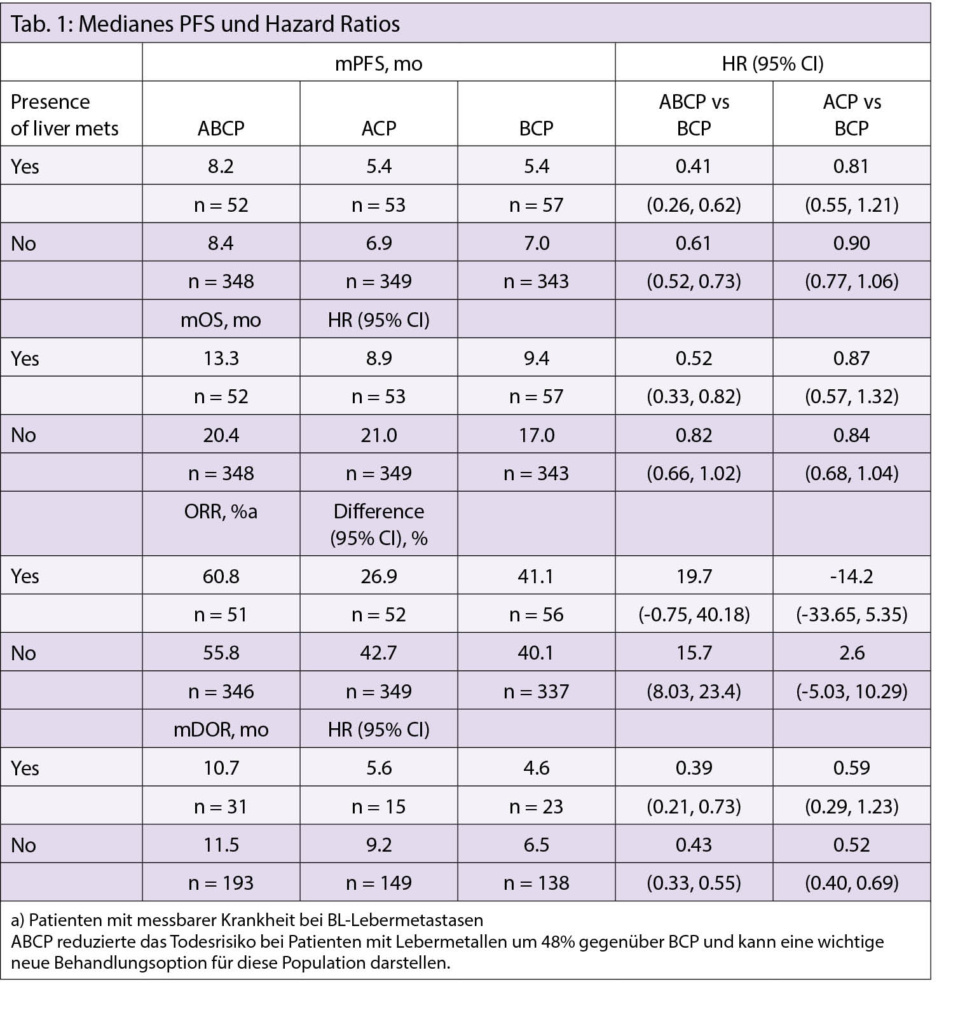
IMpower150: Analyse der Wirksamkeit bei NSCLC Patienten mit Lebermetastasen.
ACBP (Atezolizumab (Atezo) + Bevacizumab (Bev) + Chemo (Carboplatin + Paclitaxel (CP) zeigte ein verbessertes PFS und OS vs. Bev + CP (BCP) bei Patienten mit Chemo-naivem NSCLC in IMpower150. Der Nutzen von ABCP vs. BCP wird erweitert auf wichtige Untergruppen, einschliesslich Patienten mit Baseline (BL) Lebermetastasen, was ein schlechter prognostischer Faktor bei metastasiertem NSCLC ist. Ähnliche Ergebnisse wurden mit Atezo + Chemo (IMpower150 [Atezo + CP; ACP]; IMpower130; IMpower132) nicht beobachtet, was darauf hindeutet, dass die Zugabe von Bev zu Atezo + Chemo wichtig ist, um einen klinischen Nutzen bei diesen Patienten zu erzielen. In der vorliegenden Studie untersuchten die Autoren weitere Eigenschaften und das Ansprechen von Patienten mit BL-Leber-Metastasen in der Studie IMpower150.
1202 ITT-Patienten wurden im Verhältnis 1:1:1 zu ABCP, ACP oder BCP randomisiert. Die Dosierungen waren: A, 1200 mg; B, 15 mg/kg; C, AUC 6 mg/mL/min; P, 200 mg/m2. Koprimäre Endpunkte waren OS und vom Prüfer bewertetes PFS in ITT-Wildtyp-Patienten. Explorative Analysen umfassten Wirksamkeit und Sicherheit in Patienten mit Lebermetastasen.
Die Datenerfassung erfolgte nach einem ≥ 20-Monate-Follow-up in ITT Patienten (Datenabbruch: 22. Januar 2018). 162 Patienten hatten BL-Lebermetastasen (ABCP, n = 52; ACP; n = 53; BCP, n = 57), mit einem Median von 3 metastatischen Stellen und einem Median BL-Tumor SLD von 109 mm (Bereich, 10-249). Die BL-Charakteristika bei diesen Patienten waren im Allgemeinen über alle Studienarme hinweg ausgeglichen. PFS und OS wurden mit ABCP vs. BCP verbessert (Tabelle 1). Grad 3-4 behandlungsbezogene AEs traten in 52,1%, 36,5% und 54,5% der Patienten mit Lebermetastasen in den Armen ABCP, ACP und BCP auf.
WFR
Quelle: Socinski MA et al. IMpower150: Analysis of efficacy in patients (pts) with liver metastases (mets). J Clin Oncol 37, 2019 (suppl; abstr 9012) IMPower150_Roche Tecentriq
Neoadjuvante Immuntherapie bei operablem NSCLC Patienten
Neoadjuvantes Nivolumab (N) oder Nivolumab plus Ipilimumab (NI) beim resektablen nicht-kleinzelligen Lungenkrebs (NSCLC): Klinische und korrelative Ergebnisse aus der NEOSTAR-Studie.
Neoadjuvante Immun-Checkpoint-Inhibitoren (ICIs) induzieren eine hohe Rate an pathologischen Reaktionen (MPR) von 20 bis 45% bei reseziertem NSCLC. In der Studie wurde über die Ergebnisse von NEOSTAR, einer Phase-2-Studie mit neoadjuvantem N oder NI bei NSCLC, berichtet
Patienten mit Stadium I-IIIA (single N2) resezierbarem NSCLC (AJCC 7), PS 0-1, wurden randomisiert für N (3 mg/kg i.v., Tage 1, 15, 29) oder N plus I (1 mg/kg i.v., Tag 1), gefolgt von einer Operation (n = 44). Der primäre Endpunkt war MPR (≤10% viabler Tumor), hypothetisch höher als die MPR bei den Kontrollen unter der Induktionschemotherapie. Tumorimmun-
infiltrate und Pre- & Post-ICI-Tumor, % PD-L1 wurden mit Durchflusszytometrie und Immunhistochemie (IHC) untersucht.
44 Patienten wurden randomisiert, 23 N, 21 NI: Durchschnittsalter 66, 64% Männer, 18% Nichtraucher, 59% Adenokarzinome, Stadien: IA 8 (18%), IB 15 (34%), IIA 7 (16%) IIB 5 (11%); IIIA 9 (20%). Nur 3 Patienten erhielten < 3 Dosen aufgrund von TRAEs (7%). 34 Patienten hatten OP-Post-ICIs (7 wurden nicht reseziert [7/41], 17%,[2 N, 5 NI], 3 ausstehend). Es gab 10 MPRs bei insgesamt 41 Patienten (24%, 4 N, 6 NI), von denen 6 path-CRs waren (15%, 2 N[9%], 4 NI[21%]). Bei 34 resezierten Patienten lag die MPR-Rate bei 29% (N 20%, NI 43%). Der mediane Prozentsatz an viablem Tumor war niedriger nach NI gegenüber N (20% vs. 65%, p = .097). Das ORR (RECIST v1.1) betrug 22% (8 PRs[5 N, 3 NI], 1 CR[NI]); 15% der Patienten hatten progressive Krankheit (3 N, 3 NI). Der Anteil von CR+PR in MPRpos. war höher als in MPRneg. (6 [60%] vs. 2 [7%], p < .001). Zu den chirurgischen Komplikationen gehörten 2 Bronchopleuralfisteln (BPFs) bei N und 8 Luftlecks (5 N, 3 NI). G3-G5 TRAEs beinhalteten einen Todesfall aufgrund von BPF poststeroidbehandelter Pneumonie (G5, N); G3-Pneumonie, Hypoxie, Hypermagnesiämie (je 1, alle N), G3-Durchfall (1 NI). CD3+ und CD103+ Gewebe-gespeicherte CD8+ TILs waren bei mit NI-behandelten Tumoren gegenüber N höher (CD3+ 81,2% vs. 54,4%, p = 0.028; CD8+ 56,2% vs. 38,3%, p = 0.069). Das mediane Tumor PD-L1 vor Behandlung war bei Patienten mit Ansprechen (MPR+, CR+PR) höher als bei Nicht-Ansprechenden (80% vs. 1%, p = 0.024), und der Prozentsatz an viablemTumor war niedriger bei Tumoren mit PD-L1 > 1% vs. PD-L1 ≤1% (Median 20% vs. 80%, p = 0.046).
Insgesamt wurde eine 24%ige MPR-Rate für neoadjuvante ICIs beobachtet. NI induzierte einen höheren Prozentsatz an nicht viablem Tumor und gewebeeigenen Memory-TILs vs. N. Die Antitumoraktivität war mit höheren PD-L1-Werten vor der Behandlung verbunden.
WFR
Quelle: Cascone T et al. Neoadjuvant nivolumab (N) or nivolumab plus ipilimumab (NI) for resectable non-small cell lung cancer (NSCLC): Clinical and correlative results from the NEOSTAR study. J Clin Oncol 37, 2019 (suppl; abstr 8504)