- Ausgewählte Studien aus der Hämato-Onkologie
Ide-cel or Standard Regimens in Relapsed and Refractory Multiple Myeloma
P. Rodriguez‑Otero, et al. N Engl J Med. 2023 Feb 10. doi: 10.1056/NEJMoa2213614. Online ahead of print. PMID: 36762851
Patienten mit Plasmazellmyelom, nach multiplen Rezidiven, refraktär auf Immunmodulatoren, Proteasom-Inhibitoren und monoklonale Antikörper (tripel refraktäres PZM) haben eine ungünstige Prognose. Idecabtagene vicleucel (Ide-cel) ist eine gegen BCMA (B-cell maturation antigen) gerichtete CAR (chimeric antigen receptor )-T Zell Therapie in der autologe T-Lymphozyten des Patienten mit dem CAR-Konstrukt transfiziert, expandiert und nach einer lymphodepletierenden Therapie verabreicht werden.
Die hier vorgestellte Phase III Studie mit rezidivierten refraktären PZM Patienten mit 2-4 Vortherapien, welche unter der zuletzt verabreichten Therapie progredient waren, wurden 2:1 in einen Arm mit ide-cel oder in einen Arm mit der Auswahl aus fünf verschiedenen Standard Regimes randomisiert. Die Verbesserung des PFS war das angestrebte Ziel.
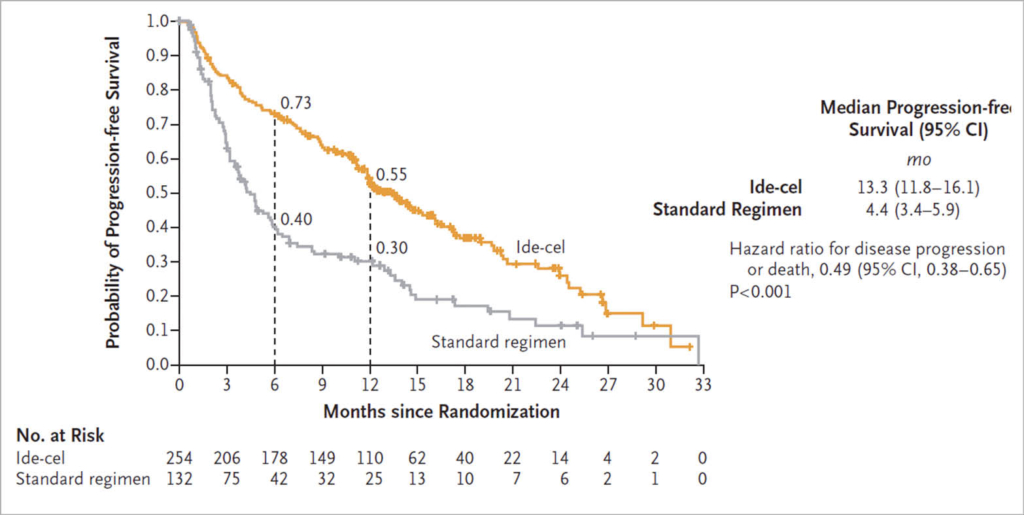
Es wurden 386 Patienten randomisiert, 254 Ide-cel und 132 Standard-Regime.
Nach median 18.6 Monaten war das PFS median 13.3 Monate im Ide-cel-Arm im Vergleich zu 4.4 Monaten im Standard-Arm (hazard ratio: 0.49; 95% CI, 0.38 bis 0.65; P<0.001). Ein Ansprechen wurde bei 71% im Ide-cel- Arm und 42% im Standard-Arm beobachtet (P<0.001); eine komplette Remission in 39% und 5%. Grad 3-4 Nebenwirkungen wurden in 93% im Ide-cel-Arm und in 75% im Standard-Arm beobachtet. Im Ide-cel-Arm wurden die immunologischen Nebenwirkungen Cytokine Release Syndrom in 88% und Neurotoxizitäten (ICANS) in 15% beobachtet.
In der Schlussfolgerung zeigt diese Studie, dass Ide-cel das PFS im Vergleich mit Standard-Behandlungen verlängert und dass die bekannten Toxizitäten beobachtet werden und beherrschbar sind. Einigermassen enttäuschend: die PFS Kurven sind gut separiert aber zeigen keine Tendenz zu einem Plateau.
Two-Year Outcomes of Valoctocogene Roxaparvovec Therapy for Hemophilia A
J. Mahlangu, et al N Engl J Med. 2023 Feb 23;388(8):694-705.
Hämophilie A ist eine X-Chromosom übertragene Krankheit und betrifft fast ausschliesslich Männer. Der Mangel an Faktor VIII führt zu Blutungen, besonders Gelenkblutungen mit konsekutiver Arthropathie. Zur Behandlung wird Faktor VIII intravenös verabreicht, je nach Schweregrad entweder bei Blutung oder prophylaktisch. Valoctocogene roxaparvovec ist eine B-domain–deleted Factor VIII Gentherapie die mittels eines Adeno-associated virus vector verabreicht wird. Die Therapie soll Blutungen bei Patienten mit schwerer Hämophilie A verhindern.
134 Männer mit schwerer Hämophilie A, welche eine prophylaktische Behandlung mit Faktor VIII benötigten, wurden in dieser Phase III Studie untersucht. Sie erhielten eine Infusion mit einer bestimmten Dosis von Vektor Genomen pro Kg. Das gemessene Resultat war die Anzahl Blutungen innerhalb von 2 Jahren.
Zum Zeitpunkt 2 Jahre war die Blutungsrate um 84.5% tiefer (P<0.001) mit einer medianen Faktor VIII Aktivität wie bei einer milden Hemophilia A (6 – 39% Aktivität). Nach 76 Wochen der Therapie wurde ein Abfall des transgene kodierten Faktors VIII beobachtet, mit einer Halbwertszeit von 132 Wochen. D.h. die weniger guten Nachrichten sind, dass diese Therapie in der Wirksamkeit für die meisten Patienten nicht anhält, sondern langsam abfällt. Die Verträglichkeit wurde als moderat beurteilt mit einer selbstlimitierten hepatischen Entzündung in der Mehrheit der Patienten.
Ein zweiter Artikel in der gleichen Ausgabe des NEJM beschäftigt sich mit der Hämophilie B, dem Mangel an Faktor IX.
Gene Therapy with Etranacogene Dezaparvovec for Hemophilia B
S.W. Pipe, et al N Engl J Med. 2023 Feb 23;388(8):706-718.
Faktor IX Mangel (Hämophilile B) wird mittels lebenslänglicher Substitution mit Faktor IX behandelt. Mittels Gentherapie wird versucht die Faktor IX Aktivität zu heben um vor Blutungen zu schützen.
Dies ist eine Phase III Studie, in welcher zuerst während 6 Monaten Faktor IX verabreicht wurde (lead-in Phase), gefolgt von einer Infusion von Adeno-associated virus 5 (AAV5) Vektor mit Expression der Padua Factor IX Variante (etranacogene dezaparvovec in einer Dosis pro Kilogramm).
Der Faktor IX Padua ist eine mutierte Variante des Faktors IX, die in Familien mit Thrombophilie gefunden wird, mit einer bis zu 8-fach erhöhten Aktivität.
54 Männer mit Hämophilie B (Faktor IX Aktivität ≤2%) wurden behandelt mit dem Resultat der jährlichen Blutungsrate 7-18 Monate nach der Gabe.
Die jährliche Blutungsrate fiel von 4.19 (95% CI, 3.22 bis 5.45) während der Einführungsphase auf 1.51 (95% CI, 0.81 to 2.82) 7 bis 18 Monate nach Behandlung (rate ratio of 0.36 (95% CI, 0.20-0.64; P<0.001). Faktor IX Aktivität nahm zu um 36.2% (95% CI, 31.4 – 41.0) 6 Monate nach Behandlung und 34.3% (95% CI, 29.5 to 39.1) 18 Monate nach Behandlung. Die Verwendung von Faktor IX nahm ab um 248,825 IU pro Jahr. Auch Patienten mit AAV5 neutralisierenden Anitkörper wenn unter einem bestimmten Titer profitierten von der Behandlung.
In der Schlussfolgerung ist die Gentherapie der prophylaktischen Faktoren Gabe überlegen in der jährlichen Blutungsrate mit gutem Sicherheitsprofil.
Insgesamt ist die Gentherapie für die Hämophilen auf gutem Weg, wie erwartet sind die Probleme beim Faktor VIII (grosses komplexes Protein) grösser als beim Faktor IX. Das Ziel bleibt eine einmalige Gabe der Gentherapie mit einer lebenslänglichen Wirkung auf Genexpression und somit Faktorenproduktion.
Klinik für Hämatologie
Hämatologische Diagnostik Labormedizin
Universitätsspital Basel und Blutspendezentrum beider Basel SRK
Petersgraben 4
4031 Basel
jakob.passweg@usb.ch