- Ausgewählte Studien aus der Hämato-Onkologie
Reale Ausgaben und Überlebenszeit nach CAR-T-Behandlung bei grosszelligem B-Zell-Lymphom in der Schweiz: eine retrospektive Studie anhand von Versicherungsdaten
Trottmann M, et al. Swiss Med Wkly. 2023;153:3441
Dass Myelodysplastische Neoplasien (MDS) und akute Myeloische Leukämien (AML) in gewissen Familien gehäuft vorkommen ist bekannt, eine kürzlich beschriebene Keimbahnmutation, welche einen Teil dieser Häufung erklärt, ist die DEAD box RNA helicase 41 gene (DDX41-GPV) Mutation. Dies wurde in einer grossen UK Populationsdatenbank mit über 450’000 Menschen untersucht um das Risiko von MDS und AML zu definieren. 452 unterschiedliche Keimbahn Varianten wurden in 3538 (1 in 129) Menschen gefunden. Pathogene Varianten wurden in 1 von 430 Menschen gefunden. Bei einem Follow-up von 13 Jahren wurde ein 12 fach erhöhtes Risiko für MDS und AML gefunden. Der Krankheitsbeginn war mit 71 Jahren relativ spät, häufiger bei Männern. Die biologischen Mechanismen sind nicht gut bekannt. Meist ist die Entwicklung zum MDS / AML mit der Acquisition einer zweiten Mutation und einem erhöhten MCV vergesellschaftet.
Klonale Hämatopoese war nicht häufiger, ebenso gab es keine Assoziation mit myeloproliferativen Neoplasien, lymphatischen Neoplasien, soliden Tumoren oder mit Autoimunerkrankungen. Das absolute Risiko ist 3.2% (5.5% bei Männern, 1.4% bei Frauen). Das Risiko war unterschiedlich je nach Typ der Mutation, höher bei trunkierenden und start-loss Mutationen. Diese Daten informieren über das Risiko von Menschen mit einer solchen Keimbahnmutation an einem MDS oder AML zu erkranken. Bedeutung haben diese Daten auch für die Auswahl von Spendern für Patienten mit einer solchen Keimbahnmutation.
Kommentar
Die Information, dass sogenannte sporadische Tumorerkrankungen z.T. auch eine genetische Prädisposition haben, ist nicht neu. Die Erforschung dieser Prädispositionen ist für die Betroffenen wichtig. Strategien, wie mit solchen Belastungen umzugehen ist, sind zu definieren.
CD19-gerichtete chimäre Antigenrezeptor-T-Zelltherapie bei Patienten mit gleichzeitigem B-Zell-Non-Hodgkin-Lymphom und rheumatischen Autoimmunerkrankungen: eine Propensity-Score-Matching-Studie
Wang J et al. Bone Marrow Transplanation 2023;58:1223-1228
Diese observationelle Studie untersucht die Wirkung der CD19 gerichteten CAR-T Zell Therapie bei älteren Patienten mit diffusem grosszelligen B-Zell Lymphom (DLBCL). Die CD19 CAR-T Zellen sind gentechnisch veränderte autologe T-Lymphozyten mit einem T-Zell Rezeptor der das CD19 Antigen auf den B-Zellen erkennt. Die CAR-T zellulären Therapien sind in der Schweiz zugelassen ab der Zweitlinienbehandlung für diffus grosszellige B Zelllymphome. Ob diese Therapie auch bei älteren Patienten nützlich ist, ist wenig untersucht. 551 Patienten > 65 Jahre alt wurden auf Grund der Medicare Rechnungen zwischen 2018 -2020 eingeschlossen. CAR T Zellen wurde zu dieser Zeit ab der dritten Behandlungslinie angewendet, 19% 65 – 69 Jahre alt, 22% 70 – 74 Jahre alt, 13% ≥75 Jahre alt. Medianer Spitalaufenthalt war 21 Tage. Das EFS nach 1 Jahr war 34%, 43%, und 52% in den 3 Altersgruppen. Mediane Kosten waren $352 572 in den ersten 3 Monaten und unterschied sich nicht in den 3 Altersgruppen. Die Anwendung der CAR-T Technologie war in den 3 Altersgruppen unterschiedlich und wurde bei den älteren Patienten weniger häufig eingesetzt. Die Autoren kommen zum Schluss, dass auch bei etwas schlechteren Resultaten diese Technologie bei älteren Patienten ähnlich gut wirkt wie bei jüngeren Patienten.
Kommentar
Die CAR-T Zell Technologie verteuert die Behandlung von DLBCL Patienten erheblich. Der Einsatz ist auch bei älteren Patienten mit gutem Allgemeinzustand möglich. Die Therapieentscheidungen bleiben bei dieser Patientenpopulation aber komplex. Zwei Drittel der DLBCL Patienten ist > 65 Jahre alt, ein Drittel > 75 Jahre. Outcome Daten sind schwierig zu interpretieren, da mit progressivem Alter die Patienten, die für komplexe Therapien ausgewählt werden, wohl stärker selektioniert sind.
Praktische Erfahrungen mit der CAR-T-Zelltherapie bei älteren Patienten mit rezidiviertem/refraktärem diffusem großzelligem B-Zell-Lymphom.
Chihara D, et al. Blood (2023) 142 (12): 1047–1055.
In einer observationellen Studie hatten von 1363 Patienten mit einem B Zell Lymphom 58 (4.3%) gleichzeitig eine rheumatologische Autoimmunerkrankung. Die Gruppe der gleichzeitig vorliegenden Autoimmunerkrankungen war heterogen und schloss Lupus, Rheumatoide Arthritis, Sjoegren Syndrom, Polymyositis, ankylosierender Spondylitis, Psoriasis ein. Die CD19 CAR-T Zellen sind gentechnisch veränderte autologe T-Lymphozyten des Patienten mit einem T-Zell Rezeptor, der das CD19 Antigen auf den B-Zellen erkennt. Die CAR-T zellulären Therapien sind in der Schweiz zugelassen ab der Zweitlinienbehandlung für diffus grosszellige B Zelllymphome, aber auch für die akute B-lymphatische Leukämie, follikuläre und Mantelzelllymphome. Die Komplikationen der CAR-T Therapie war vergleichbar bei Patienten mit und ohne rheumatologische Autoimmunerkrankung. Das Überleben, die Rezidivrate der Lymphome unterschied sich nicht in den beiden Gruppen. Eine erhebliche Anzahl der Patienten rheumatologischer Autoimmunerkrankung erlebte ein Ansprechen der Entzündungszeichen, der Autoantikörper und benötigte weniger Steroide und andere gegen die Autoimmunität gerichtete Medikamente.
Kommentar
Patienten mit Lymphom und rheumatologischer Autoimmunerkrankung können mit CAR-T Therapien ohne erhöhte Risiken behandelt werden. Diese bemerkenswerten Ergebnisse, Patienten mit Autoimmunerkrankungen haben ein erhöhtes Lymphomrisiko und das Vorliegen beider Entitäten ist somit keine Ausnahme, führen zur Frage, ob die CD19 (B-Zell Marker) gerichtete CAR-T Technologie auch für schwere Autoimmunerkrankungen eingesetzt werden können. Dies kann in Analogie zum Einsatz der autologen Stammzelltransplantation die für gewisse Formen der Autoimmunerkrankungen gesehen werden.
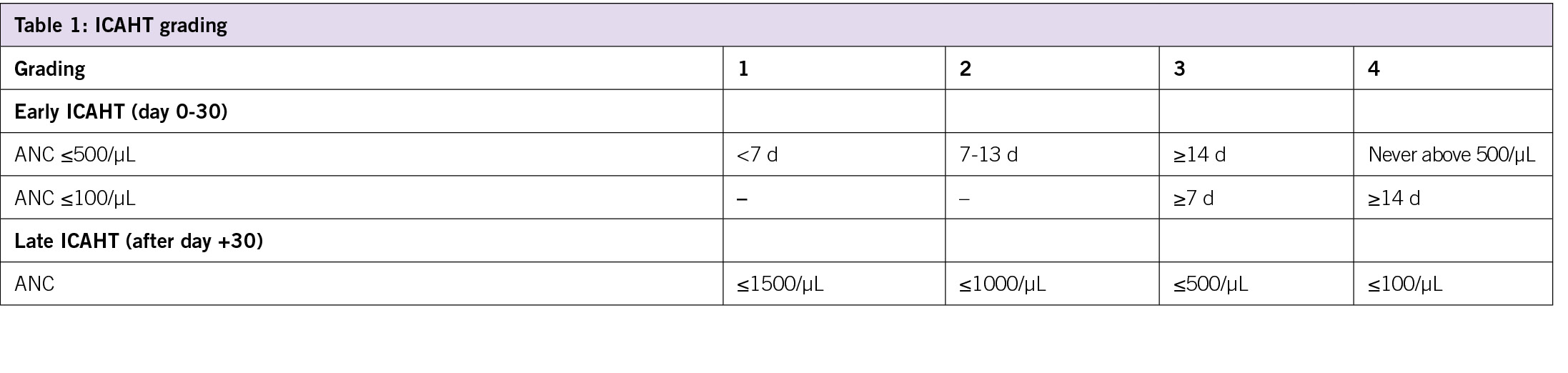
Immuneffektorzellen-assoziierte Hämatotoxizität: EHA/EBMT-Konsens zur Einstufung und Empfehlungen für bewährte Verfahren
Rejeski K et al. Blood 2023;142:865-877
CAR-T Zellen sind gentechnisch veränderte autologe T-Lymphozyten mit einem T-Zell Rezeptor der das CD19 oder das BCMA-Antigen erkennt. CAR-T zelluläre Therapien sind in der Schweiz zugelassen für Lymphome, die akute lymphatische Leukämie (CD19) sowie für Plasma Zell Myelome (BCMA). Die Toxizitäten sind gut bekannt und beschrieben, insbesondere das CRS (Zytokin Freisetzungssyndrom) sowie das ICANS (Immuneffektorzell-assoziiertes Neurotoxizitätssyndrom). Weitere Toxizität schliessen die B-Zell Depletion mit notwendiger Immunglobulinsubstitution sowie hämatologische Ztopenien ein. Dieses Paper beschreibt, gradiert die hämatologischen Zytopenien (ICAHT) und schlägt Behandlungs-Algorithmen vor. Hämatologische Toxizitäten sind häufig nach CAR-T Behandlung, können langdauernd sein und zu infektiösen Komplikationen führen. Für die Gradierung wurde auf die Tiefe und die Dauer der Neutropenie zurückgegriffen (Tabelle), sowie auf den zweiphasigen Verlauf, früh in den ersten 30 Tagen und spät nach 30 Tage nach Behandlung hingewiesen. Risikofaktoren wurden im CAR-HEMATOTOX score zusammengefasst, welcher prätherapeutische Blut- und Entzündungswerte umfasst. Die Risikofaktoren schliessen die Grundkrankheit sowie die Krankheitslast, Vorbehandlungen, Knochenmarksbefall, Inflammation, immunologische und infektiöse Komplikationen mit ein. Zu diesen Toxizitäten gehört auch die CAR-T assoziierte Hämophagozytose. Behandlungsempfehlungen sind Transfusionen, Wachstumsfaktoren, prophylaktische Antiinfektiva und als Ultima Ratio eine Stammzelltransplantation.
Kommentar
ICAHT ist eine wichtig zu kennende Komplikation der CAR-T Zell Therapie. Prolongierte Zytopenien und Immunsuppression führen zu Problemen, die eine sorgfältige Nachbetreuung erfordern.
Klinik für Hämatologie
Hämatologische Diagnostik Labormedizin
Universitätsspital Basel und Blutspendezentrum beider Basel SRK
Petersgraben 4
4031 Basel