- Ausgewählte Studien aus der Hämato-Onkologie
Eltrombopag in Kombination mit Immunsuppression bei der schweren aplastischen Anämie
Quelle: Eltrombopag Added to Immunosuppression in Severe Aplastic Anemia, R. Peffault de Latour, et al, N Engl J Med 2022;386:11-23
Hintergrund
Die erworbene aplastische Anämie ist eine Autoimmunerkrankung mit T-Zell-mediierter Destruktion hämatopoetischer Stammzellen. Die Therapie ist mit immunsuppressiver Therapie oder Stammzelltransplantation. Mehrere Studien haben die Kombination von Cyclosporin A und Anti-Thymozyten Globulin (ATG + CyA) als Standardtherapie etabliert. Eltrombopag (Epag) ist ein Thrombopoetin Analogon, somit ein Wachstumsfaktor und in der Therapie der Immunthrombopenie etabliert. Da dieser Wachstumsfaktor auch bei den Stammzellen angreift, wurde Eltrombopag in der Behandlung der aplastischen Anämie untersucht und Phase II Studien haben die Wirksamkeit bei rezidivierten oder refraktären Patienten sowie als Zusatz bei der ATG + CyA Therapie untersucht. Diese Studie hier ist eine randomisierte Studie, welche ATG + CyA mit ATG + CyA + Epag vergleicht.
Methode
Dies ist eine randomisierte Multizenter Phase III Studie der Erstlinientherapie von Patienten mit schwerer aplastischer Anämie, durchgeführt durch Zentren der Europäischen Stammzelltransplantationsgesellschaft (EBMT). Primärer Endpunkt war die Anzahl von Patienten mit kompletter Remission 3 Monate nach Therapie.
Resultate
Immunsuppression mit ATG + CyA wurde 101 Patienten (Gruppe A), ATG + CyA + Epag (Gruppe B) 96 Patienten verabreicht. 10% der Patienten in Gruppe A und 22% in Gruppe B hatten eine komplette Remission nach 3 Monaten. 6 Monate nach Therapie hatten 41% in der Gruppe A und 68% in der Gruppe B eine komplette oder partielle Remission. Das Intervall bis zum Ansprechen war 8.8 Monate in der Gruppe A und 3 Monate in der Gruppe B. Die Häufigkeit von schweren Nebenwirkungen war vergleichbar. Patienten mit aplastischer Anämie haben nach immunsuppressiver Therapie ein Risiko sekundärer klonaler Anomalien wie zB Übergang in ein myelodysplastisches Syndrom. Medianes Follow-up ist 24 Monate und die Häufigkeit genetischer Anomalien war vor Beginn der Therapie 29% und 31% und stieg nach Therapie auf 66% und 55%, ohne dass das Ansprechen oder das Ueberleben davon betroffen war. Das event-freie Überleben, d.h. Überleben ohne Rückfall, ohne klonale Evolution und mit Ansprechen auf die Erstlinientherapie war 34% und 46% in Gruppe A und B.
Schlussfolgerung
Die Zugabe von Eltrombopag zur Standard immunsuppressiver Therapie führt zu einem schnelleren und besseren Ansprechen.
Interleukin-1 verursacht das Mikrobiom-vermittelte inflammatorische Altern der Blutstammzellen in Mäusen
Quelle: IL-1 mediates microbiome-induced inflammaging of hematopoietic stem cells in mice, Larisa V. Kovtonyuk et al., Blood. 2022 Jan 6;139(1):44-58. doi: 10.1182/blood.2021011570. PMID: 34525198
Hintergrund
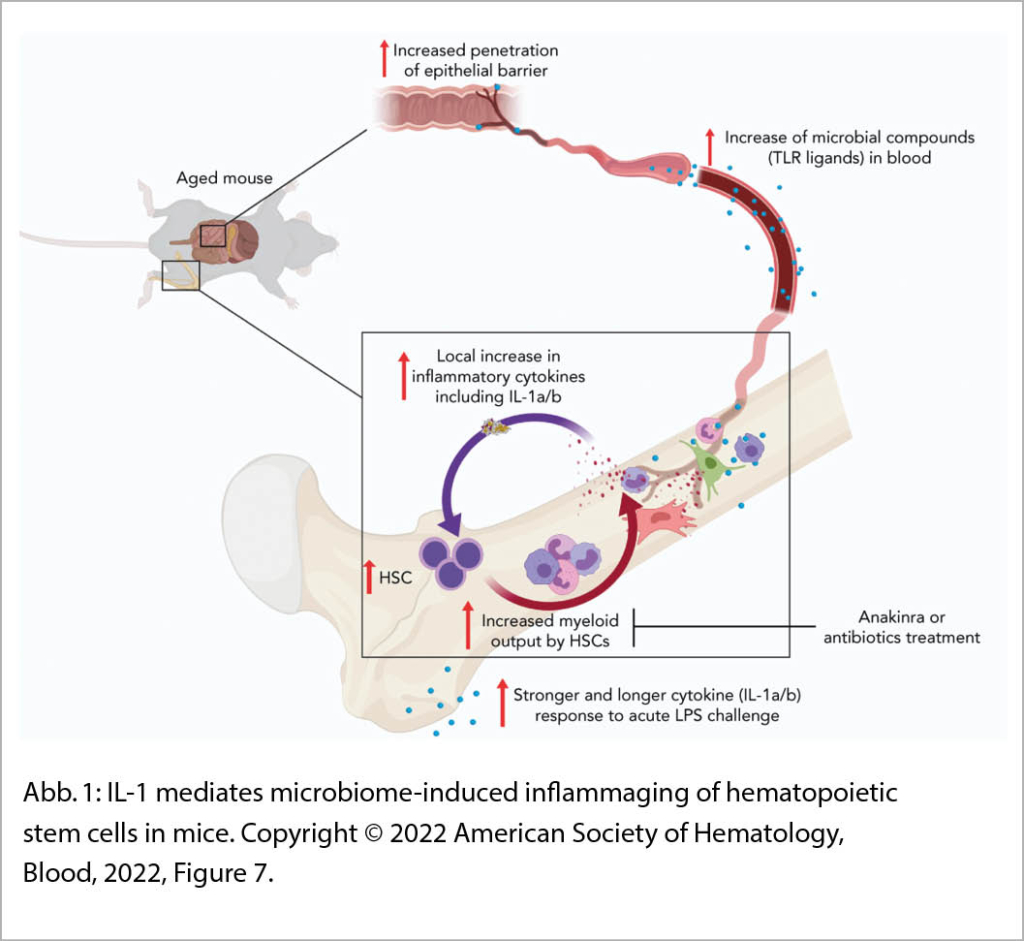
Dies ist eine grundlagenwissenschaftliche Arbeit zur Alterung der Hämatopoese unter dem Einfluss inflammatorischer Reize im Zusammenhang mit dem intestinalen Mikrobiom aus der Arbeitsgruppe von Prof. Manz an der Universität Zürich. Alterung führt zu einer eingeschränkten hämatopoetischen und immunologischen Funktion. Dies zeigt sich in einer reduzierten Fitness der hämatopoetischen Stammzellen (HSZ). Eine Stärkung der myeloischen Differenzierung auf Kosten der lymphatischen Differenzierung der HSZ wird beobachtet. Die Mechanismen dieser Alterung der Hämatopoese sind nicht gut bekannt.
Methoden und Resultate
In dieser Studie wurden ältere und jüngere Mäuse untersucht. Ältere Mäuse produzierten mehr Interleukin 1a und 1b (IL-1a/b), und dieses Zytokin kommt hauptsächlich von myeloisch differenzierten Knochenmarkszellen. Im Blut dieser Mäuse fanden sich je nach Alter mehr mit mikroben assoziierte molekulare Muster, insbesondere TLR4 und TLR8 (Toll Like Rezeptor; Rezeptoren, welche mikrobielle Molekäle erkennen) Liganden. Myeloische Zellen von älteren Mäusen produzierten mehr IL-1b in vitro und Stimulation mit Lipopolysacchariden führte zu einer stärkeren und länger anhaltenden IL-1a/b Antwort. Interleukin-1 Rezeptor knockout Mäuse hatten ein deutlich abgeschwächtes altersassoziiertes inflammatorisches Muster. HSZ von Interleukin-1 Rezeptor knockout Mäusen und von pathogen-frei aufgezogenen Mäusen behielten eine hämatopoetische Differenzierung ohne Zeichen dieser Alterung. Ebenso konnte die medikamentöse Blockade der IL-1 Signale sowie die antibiotische Reduktion des intestinalen Mikrobioms den Myelopoese Bias der HSZ von älteren Mäusen vermindern.
Schlussfolgerung
Diese Arbeit zeigt, dass das Mikrobiom und die Interleukin-1 – Interleukin 1 Rezeptor Achse ein wichtiger und therapeutisch partiell reversibler Bestandteil des inflammatorischen Alterns sind (Abb. 1).
Behandlungsresultate bei älteren Patienten mit akuter lymphoblastischer Leukämie mit und ohne allogene Stammzelltransplantation: Eine Beobachtung über 10 Jahre am USZ.
Quelle: Real-world outcomes in elderly ALL patients with and without allogeneic hematopoietic stem cell transplantation: a single-center evaluation over 10 years. Hofer KD et al, Ann Hematol. 2022 Feb 19. doi: 10.1007/s00277-022-04793-z. Online ahead of print. PMID: 35182191
Hintergrund
In einer weiteren Arbeit aus dem USZ wurden die Behandlungsresultate der akuten lymphatischen Leukämie (ALL) bei älteren
Patienten untersucht.
Die ALL ist der häufigste Tumor im Kindesalter und vieles in der Behandlungserfahrung der ALL ist demzufolge von pädiatrischen Protokollen inspiriert.
Die ALL kommt in allen Alterskatergorien vor, hat einen zweigipflichen Häufigkeitsverlauf, mit einer Spitze im Kindesalter und einem geringeren Häufigkeitsgipfel im Alter. Die Behandlung der ALL beruht auf komplexen Chemotherapieprotokollen mit alternierend eingesetzten Substanzen und hat zu einer hohen Heilungsrate bei Kindern geführt. Die Umsetzung dieser Therapiekonzepte im Alter sind dementsprechend schwieriger.
Im Allgemeinen gilt die Prognose der ALL bei Patienten über 60 Jahren als schlecht. Intensive pädiatrische Protokolle und die Stammzelltransplantation werden in dieser Alterskategorie nur zurückhaltend eingesetzt, die Datenlage ist dementsprechend ungenügend und über hohe behandlungsassoziierte Mortalität ist berichtet worden.
Methoden
In dieser retrospektiven Analyse eines einzelnen Zentrums wurden die Daten aller Patienten mit einer De-novo-Diagnose von ALL zwischen 2009 und 2019 analysiert, die an der Abteilung für Medizinische Onkologie und Hämatologie des Universitätsspitals Zürich, Schweiz, behandelt wurden. Burkitt-Lymphom/Burkitt-Zell-Leukämie wurden nicht in die Analyse einbezogen. Ausgeschlossen wurden Patienten, die jünger als 18 Jahre waren oder sich weigerten, eine allgemeine Forschungsgenehmigung zu erteilen. Die Ergebnisse von Patienten mit T-ALL wurden aufgrund der geringen Anzahl von Patienten im EP nicht detailliert untersucht.
Resultate
In dieser Studie wurden 130 ALL Patienten zwischen 2009 und 2019 untersucht, 26 waren ältere Patienten (zwischen 60-76 Jahre alt). Intensive Induktions-Kombinationschemotherapien konnten bei 65% der älteren Patienten durchgeführt werden. Bei 87% konnte eine komplette Remission erreicht warden, im Vergleich dazu bei 88.0% der jüngeren Erwachsenen. Frühmortalität wurde bei 7% der älteren Patienten beobachtet. Das Dreijahresüberleben der älteren ALL Patienten ohne Philadelphia Chromosom war klar schlechter als bei den jüngeren
Patienten (30% vs 78%, p ≤ 0.001). Eine allogene Stammzelltransplantation wurde bei 49 Patienten, darunter 8 älteren Patienten durchgeführt mit einem Dreijahresüberleben von 87%. Ältere Patienten ohne Stammzelltransplantation hatten ein medianes Ueberleben von 9 Monaten. Bei Patienten mit Philadelphia Chromosom positiver ALL war das Dreijahresüberleben bei den Älteren 60% und 71% bei den Jüngeren. Die behandlungsassoziierte Mortalität (14%) und die Rate an Infektionen (12%) waren insgesamt tief bei den älteren Patienten.
Schlussfolgerung
Diese Daten zeigen, dass bei einem Teil der älteren Patienten mit ALL eine intensive Polychemotherapie möglich ist und dass auch ältere Patienten von Dosisintensität und Stammzelltransplantation profitieren können.
Klinik für Hämatologie
Hämatologische Diagnostik Labormedizin
Universitätsspital Basel und Blutspendezentrum beider Basel SRK
Petersgraben 4
4031 Basel
jakob.passweg@usb.ch