- Ausgewählte Studien aus der Hämato-Onkologie
HLH MAS (Markophagenaktivierung, Hämophagozytose mit gemeinsamen Immunaktivierungswegen)
De Matteis A, Colucci M, Rossi MN, et al. Expansion of CD4dimCD81 T cells characterizes macrophage activation syndrome and other secondary HLH. Blood. 2022;140(3):262-273.
Das Hämophagozytose Syndrom (Hämophagozytische Lymphohistiozytose, HLH) oder Makrophagenaktivierungssyndrom (MAS) ist eine seltene Erkrankung, welche im Kindesalter als angeborene Störung des Immunsystems (primäre HLH) oder im Erwachsenenalter als Tumor-Autoimmunität oder Infekt-assoziierte Manifestation auftritt (sekundäres HLH oder MAS). Das Syndrom ist hoch aggressiv und präsentiert sich mit Fieber, Adenopathien, Organomegalien, Organversagen, Panzytopenie und weitere mehr. Diagnosekriterien sind komplex und umfassen unter anderem Zytopenien, den Nachweis von Hämophagozytose im Knochenmark, massive Hyperferritinämie, Dysfunktion von natürlichen Killerzellen, hohe Triglyzeride, hoher löslicher Interleukin-2-Rezeptor.
Die angeborenen Formen der HLH sind in sich wieder vielfältig und umfassen mehrheitlich Veränderungen in den Genen der Immunregulation.
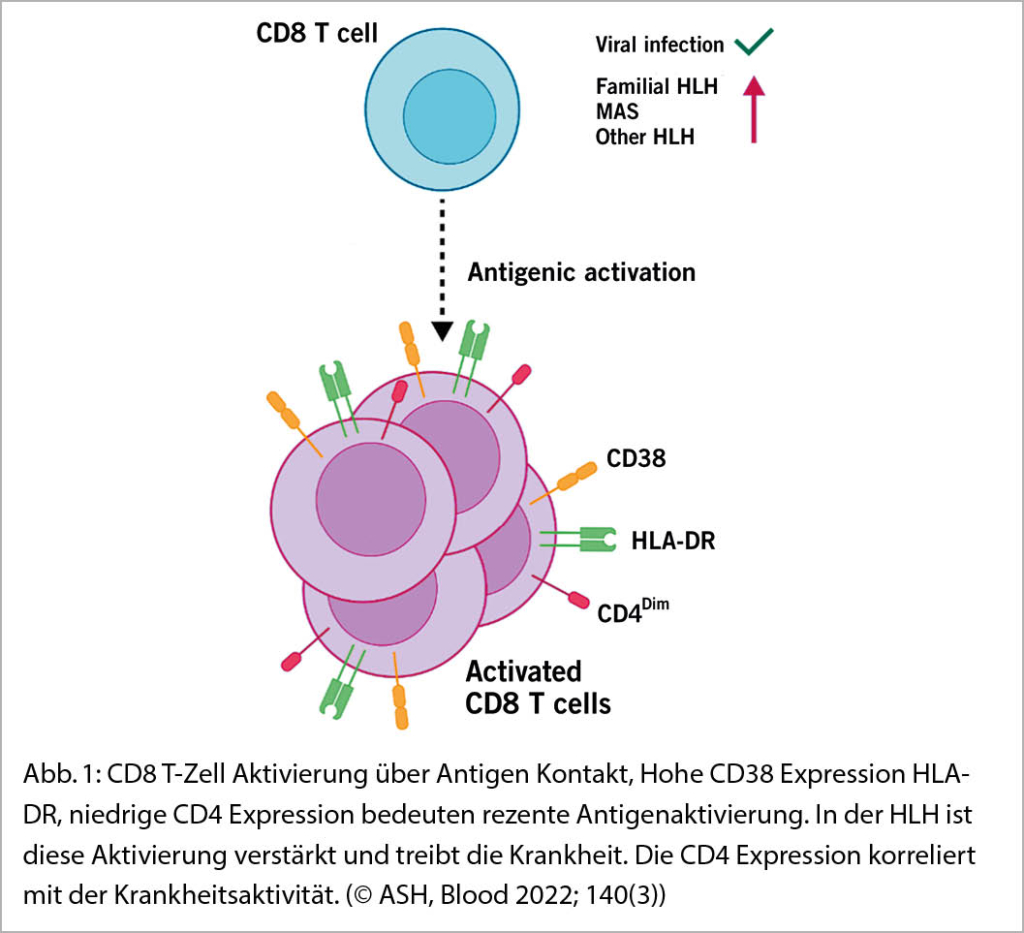
In diesem Artikel beschreiben De Matteis et al. die Expansion von kürzlich aktivierten CD8-positiven T-Zellen mit grosser Ähnlichkeit zwischen der familiären primären HLH und der sekundären HLH. Sie verglichen Patienten mit MAS, mehrheitlich Kinder mit juveniler inflammatorischer Arthritis mit primärer HLH.
Die Autoren beschreiben eine Population von CD8+ T-Zellen mit HLA-DR+ CD4 dim, CD38 bright, als Mass für die Stärke der Makrophagenaktivierung. Diese Befunde zeigen ein gemeinsames Immun-Profil bei der primären familiären HLH und bei Formen der sekundären HLH. Die Befunde werden dadurch erhärtet, dass HLH, primär oder sekundär, eine Störung einer schädigenden akuten CD8 Zellaktivierung darstellt (Abb. 1).
CD8+ T-Zellen, welche HLA-DR und CD38 exprimieren, sind typisch für kürzlich aktivierte Antigen spezifische T-Zellen. Die Bestimmung dieser Zellpopulation ist nicht spezifisch für HLH, kann aber helfen die Differentialdiagnose einzuengen und z.B. gegenüber Septikämien abzugrenzen. Die doppelpositiven CD8 bright CD4 dim Zellen gelten als Marker für T-Zell-Aktivierung und sind interessant als Marker des Schweregrades der Krankheit. Durchflusszytometrisch ist das relativ einfach zu detektieren.
HIT: sind die Alphabet Blutgruppen doch für etwas verantwortlich?
Karnes J, Rollin J, Giles JB, et al. ABO O blood group as a risk factor for platelet reactivity in heparin-induced thrombocytopenia. Blood. 2022;140(3):274-284.
Die Heparin-induzierte Thrombozytopenie (HIT) ist eine bedrohliche medikamentös induzierte Thrombozytopenie, welche über den Thrombozyten-Verbrauch via Plättchen-Aktivierung abläuft und zu katastrophalen thromboembolischen Komplikationen führen kann.
Die Interaktion zwischen Heparinen und plättchengebundenen Anti-Plättchenfaktor-4 Antikörpern gilt als ursächlich für diese Komplikation. Die Identifikation von Patienten, bei welchen diese häufig eingesetzten Medikamente eine HIT auslöst, ist schwierig, ausser eine durchgemachte HIT zeigte sich bereits während einer früheren Hospitalisation.
Die Diagnose erfolgt über die Anti-PF4 Antikörper (wobei nicht alle Patienten mit Anti-PF4 eine HIT entwickeln) sowie den 4T-Score. Weiter diagnostisch unterstützend sind Plättchenaktivierungsuntersuchungen unter Einfluss von Heparin (HIPA, heparin induced platelet activation).
Die Studie präsentiert Daten zu Genome-wide association studies (GWAS) mit an die 106 Markern, welche zeigen, dass Anti-PF4 Antikörper bei Patienten mit der Blutgruppe 0 mit einer HIT assoziiert sind. Es wurden Patienten in 3 Gruppen untersucht:
Patienten positiv für Anti-PF4 Antikörper und positiv für funktionelle Assays (n 1269), Anti-PF4 positive Patienten mit negativem funktionellem Assay (n 1131), und negative Kontrollen (n 1766). Eine unabhängige Kohorte auch mit HIT diagnostizierten Patienten wurde mitgeführt. Alle 47 identifizierten Polymorphismen, welche mit positiven funktionellen Assays assoziierten, gehörten zum AB0 Locus auf Chromosom 9.
Die rs8176719 C Insertionsvariante in den AB0-Genen war signifikant mit funktionellem HIT Assay assoziiert. Diese Insertionsvariante kodiert für alle Nicht-0-Blutgruppen und führt zu einem protektiven Effekt.
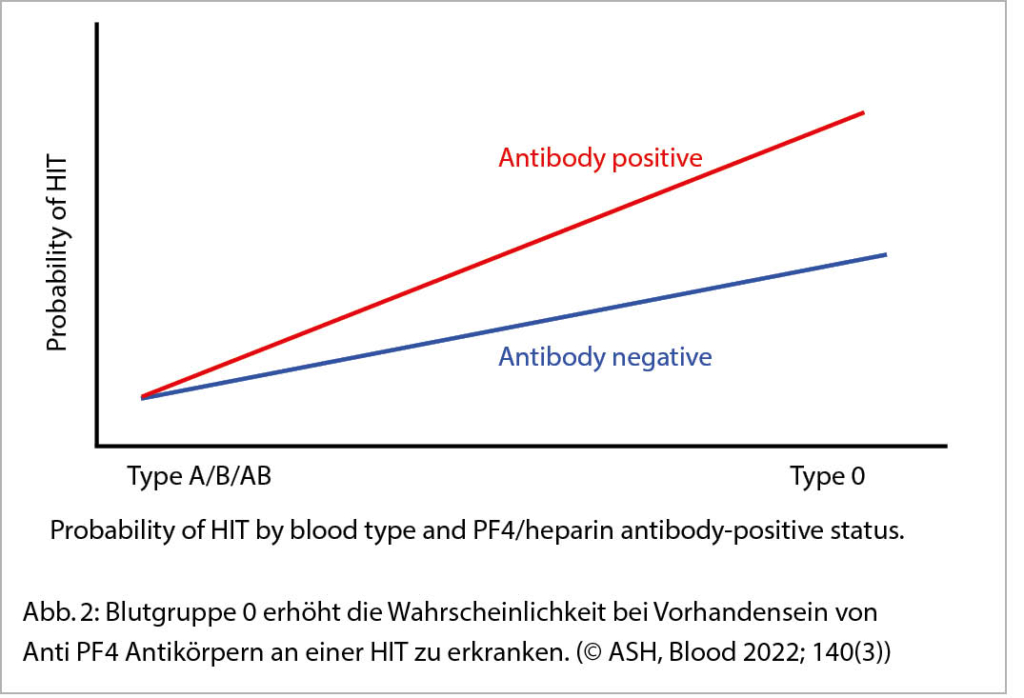
Dies suggeriert, dass die rs8176719 C Deletion und die Blutgruppe 0 HIT-Risikofaktoren sind. Diese Assoziation ist stärker im Vergleich Assay positiv vs Assay negativ Antikörper positive als im Vergleich zu den negativen Kontrollen.
Bei Patienten mit PF4-Antikörpern ist die rs8176719 C Deletion, welche für die Blutgruppe 0 verantwortlich ist ein Risikofaktor für Thrombozyten Reagibilität, d.h. für positiven funktionellen Test und für klinisch manifeste HIT.
Die Autoren schliessen, dass es eine Interaktion gibt zwischen Blutgruppe 0 und PF4-Antikörpern, welche dazu führt, dass der funktionelle HIT-Test positiv wird (Abb. 2).
Es ist unklar, ob diese Abhängigkeit direkt auf die Blutgruppe 0 zurückzuführen ist oder aber auf weitere Faktoren, welche mit der Blutgruppe 0 assoziiert sind, wie p-Selectin, ein Marker der Thrombozytenaktivierung, von Willebrand Faktor (vWF), Faktor VIII (für den der vWF das Trägerprotein ist) und mit dem IgG Rezeptor FcgRIIa.
Es ist faszinierend, dass dieser Zusammenhang zwischen Blutgruppen und einer nicht allzu seltenen medikamentösen Komplikation über Genome-wide association studies entdeckt wird.
CAR-T Zellen für das follikuläre Lymphom
Ghione P, Palomba ML, Patel AR, et al. Comparative effectiveness of ZUMA-5 (axi-cel) vs SCHOLAR-5 external control in relapsed/refractory follicular lymphoma. Blood. 2022;140(8):851-860.
In der ZUMA-5 Studie wurde das autologe CD19 spezifische CAR-T Produkt (axi-cel) bei Patienten mit rezidiviertem refraktärem follikulärem Lymphom untersucht. Da dies eine Phase-II-Studie ohne Kontrollgruppe war, wurde in dieser hier vorliegenden Arbeit die ZUMA-5 Kohorte mit einer vergleichbaren Kohorte (SCHOLAR-5) verglichen, die nicht mit CAR-T behandelt worden war. Diese
Patienten bekamen eine Drittlinientherapie oder waren weiter fortgeschritten. Die beiden Kohorten wurden über ein Propensity Score Matching für bekannte Risikofaktoren vergleichbar gemacht.
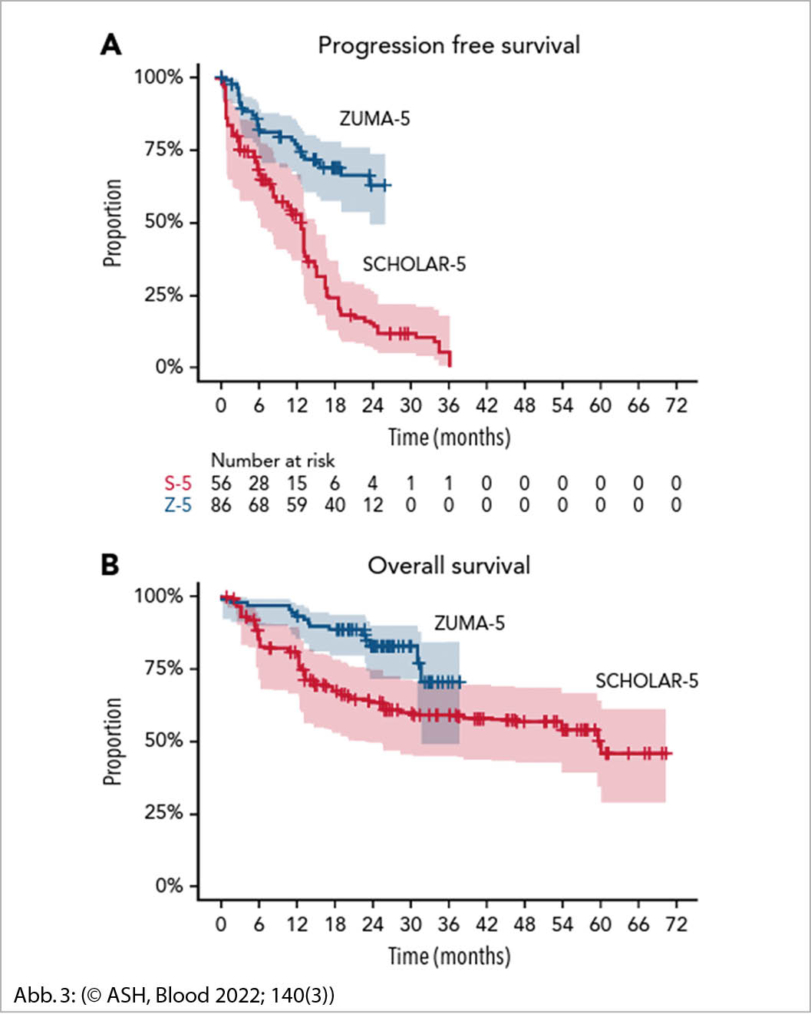
85 Patienten aus Scholar5 wurden mit 86 Patienten aus Zuma-5 verglichen. Das mediane Überleben (OS) und das progressionsfreie Überleben (PFS) (Abb. 3) war 60 und 13 Monate für Scholar5 und nach 18 Monaten nicht erreicht für beide Outcomes für Patienten in ZUMA-5. Die Hazard Ratio for OS und PFS war 0.42 (95% CI, 0.21-0.83) und 0.30 (95% CI, 0.18-0.49). Die Ansprechrate und komplette Remissionsrate war 50% und 30% in SCHOLAR5 und 94% und 79% in ZUMA-5. Zu den Nebenwirkungen der CAR-T Therapie gehörte ein Zytokinfreisetzungssyndrom bei 78% der Patienten, das in 6% einen Grad III oder höher betraf. Grad III/IV neurologische Komplikationen wurden in 15% der Patienten beobachtet. Im Vergleich zu bisherigen Therapien bringt die CAR-T Behandlung eine Verbesserung in mehreren wichtigen Endpunkten der Lymphombehandlung bei follikulären Lymphomen im rezidivierten/refraktären Zustand.
Bei offenbar eindrücklichen Unterschieden zwischen den CAR-T Patienten und den Scholar5 Patienten muss die Frage gestellt werden, ob die beiden Gruppen vergleichbar sind. Zahlreiche neue Therapien sind verfügbar, einschliesslich Kombinationschemotherapien, Imide, monoklonale und bispezifische Antikörper und weitere mehr. Ein Vergleich wie oben zitiert, ist stark abhängig von der Qualität des Propensity Score Matchings, d.h. der Simulation einer randomisierten Studie durch die Angleichung der Risikofaktoren in beiden Armen. Die Schwäche dieser Technik ist natürlich, dass nur für bekannte Risikofaktoren, nicht aber für unbekannte angeglichen werden kann.
Klinik für Hämatologie
Hämatologische Diagnostik Labormedizin
Universitätsspital Basel und Blutspendezentrum beider Basel SRK
Petersgraben 4
4031 Basel
jakob.passweg@usb.ch