- Ausgewählte Studien zu soliden Tumoren
Multiinstitutionelle Validierung eines mammographiebasierten Brustkrebs-Risikomodells
Quelle: Yala A et al. Multiinstitutionelle Validierung eines mammographiebasierten Brustkrebs-Risikomodells.; Journal of Clinical Oncology 2022; 40: 1732-1740. DOI: 10.1200/JCO.21.01337
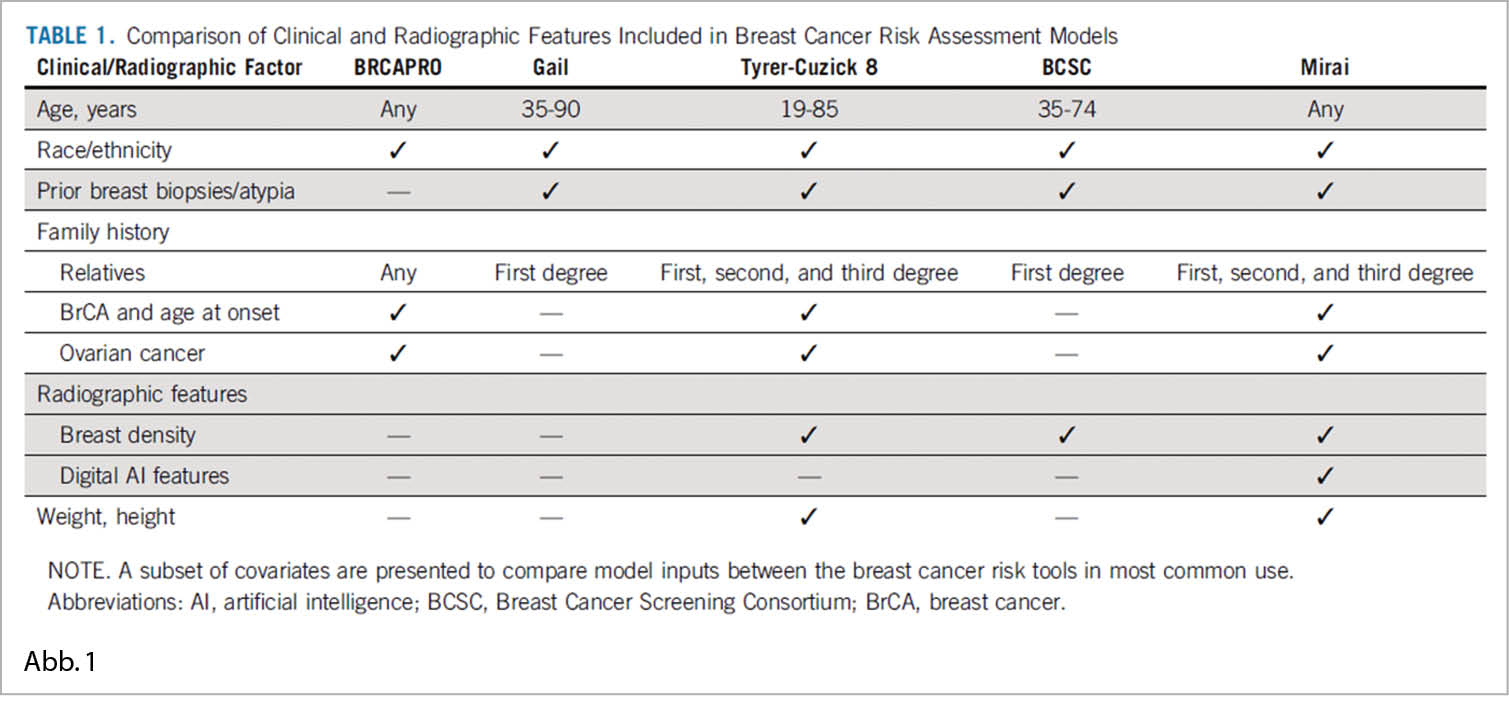
Eine genaue Risikobewertung ist für den Erfolg von Populations-Screening-Programmen bei Brustkrebs unerlässlich. Modelle mit hoher Sensitivität und Spezifität würden es den Programmen ermöglichen, ausgefeiltere Screening-Bemühungen auf Hochrisikopopulationen auszurichten und gleichzeitig die Überbehandlung für den Rest zu minimieren. Auf künstlicher Intelligenz basierende Risikomodelle haben einen signifikanten Fortschritt gegenüber den heute in der klinischen Praxis verwendeten Risikomodellen gezeigt. Der verantwortungsvolle Einsatz derartiger neuer Risikomodelle erfordert jedoch eine sorgfältige Validierung über verschiedene Bevölkerungsgruppen hinweg. Zu diesem Zweck wurde das auf künstlicher Intelligenz basierte Modell Mirai über global unterschiedliche Screening-Populationen hinweg getestet.
Es wurden Mammographie-Screenings und pathologisch bestätigte Brustkrebsergebnisse von verschiedenen Spitälern und Institutionen verwendet, so Massachusetts General Hospital, USA, Novant, ein integriertes Netz von Arztpraxen, ambulanten Zentren und Krankenhäusern in 4 Bundesstaaten in den USA; Emory University Hospital Atlanta, USA; Maccabi-Assuta, Israel; Karolinska, Schweden; Chang Gung Memorial Krankenhaus, Taiwan; und Barretos Cancer Hospital, Brasilien. Der Konkordanzindex von Uno für Mirai bei der Vorhersage des Brustkrebsrisikos nach einem bis fünf Jahren nach der Mammographie wurde bewertet.
Befund
Insgesamt wurden 128.793 Mammographien von 62.185 Patienten an den sieben Standorten gesammelt, von denen 3.815 innerhalb von 5 Jahren eine Krebsdiagnose erhielt. Mirai erhielt Konkordanzindizes von 0,75 (95% CI, 0,72 bis 0,78), 0,75 (95% CI, 0,70 bis 0,80), 0,77 (95% CI, 0,75 bis 0,79), 0,77 (95% CI, 0,73 bis 0,81), 0,81 (95% CI, 0,79 bis 0,82), 0,79 (95% CI, 0,76 bis 0,83) und 0,84 (95% CI, 0,81 bis 0,88) im Massachusetts General Hospital, Novant, Emory, Maccabi-Assuta, Karolinska, Chang Gung Memorial Hospital bzw. Barretos
Schlussfolgerung
Mirai, ein auf Mammographie basierendes Risikomodell, behielt seine Genauigkeit über weltweit unterschiedliche Testsets aus sieben Krankenhäusern in fünf Ländern bei. Dies ist die bisher umfassendste Validierung eines auf künstlicher Intelligenz basierten Brustkrebsmodells und deutet darauf hin, dass die Technologie breite und gerechte Verbesserungen in der Versorgung bieten kann.
Kritik
In ihrem Artikel stellen Yala et al eine multizentrische Validierung eines Deep-Learning-Algorithmus vor, der digitale mammographische Merkmale und klinische Variablen kombiniert, um einen neuartigen und hochpräzisen Brustkrebs-Risikoklassifikator zu erstellen. Ein solches Tool für maschinelles Lernen hat das Potenzial, die individualisierte Krebsrisikobewertung entscheidend zu verbessern, aber die Implementierung muss einen breiten Zugang zu allen Bildgebungsplattformen und untersuchten Patientenpopulationen umfassen.
Biomarker für die systemische Therapie bei metastasierendem Brustkrebs
Quelle: N. Lynn Henry, et al J Clin Oncol. Online veröffentlicht vor Druck 27. Juni 2022, DOI: 10. 1200/JCO.22.01063
Zweck
Aktualisierung der ASCO Guideline Biomarkers to Guide Systemic Therapy for Metastatic Breast Cancer (MBC)
Methodik
Ein Expertengremium führte von Januar 2015 bis Januar 2022 eine systematische Überprüfung durch, um randomisierte klinische Studien und prospektive retrospektive Studien zu identifizieren.
Befund
Die Suche ergab 19 Studien, die die Evidenzbasis bildeten.
Empfehlungen
Kandidaten für ein Regime mit einem Phosphatidylinositol-3-Kinase-Inhibitor und einer Hormontherapie sollten auf PIK3CA-Mutationen getestet werden, indem sie Tumorgewebe der nächsten Generation oder zirkulierende Tumor-DNA (ctDNA) im Plasma verwenden, um die Eignung für Alpelisib plus Fulvestrant zu bestimmen. Wenn keine Mutation in ctDNA gefunden wird, sollten Tests in Tumorgewebe, falls verfügbar, verwendet werden. Patienten, die Kandidaten für eine Therapie mit Polypolymerase (PARP)-Inhibitor sind, sollten auf pathogene oder wahrscheinlich pathogene Mutationen der Keimbahn BRCA1 und BRCA2 getestet werden, um die Eignung für einen PARP-Inhibitor zu bestimmen. Es gibt keine ausreichende Evidenz für oder gegen Tests auf eine pathogene Keimbahn-PALB2-Variante, um die Eignung für eine PARP-Inhibitor-Therapie im metastasierten Umfeld zu bestimmen. Kandidaten für eine Immun-Checkpoint-Inhibitor-Therapie sollten auf die Expression des programmierten Zelltodliganden-1 im Tumor und in den Immunzellen getestet werden, um die Eignung für eine Behandlung mit Pembrolizumab plus Chemotherapie zu bestimmen. Kandidaten für einen Immun-Checkpoint-Inhibitor sollten auch Tests auf mangelhafte Mismatch-Reparatur/Mikrosatelliten-Instabilität unterzogen werden, um die Eignung für Dostarlimab-gxly oder Pembrolizumab zu bestimmen, sowie Tests auf Tumormutationslast. Kliniker können auf NTRK-Fusionen testen, um die Eignung für TRK-Inhibitoren zu bestimmen. Es liegen keine ausreichenden Daten vor, um routinemässige Tests von Tumoren auf ESR1-Mutationen, auf homologe Rekombinationsmängel oder auf TROP2-Expression zur Steuerung der MBC-Therapieauswahl zu empfehlen. Ebenso liegen keine ausreichenden Daten vor, um die routinemässige Anwendung von ctDNA oder zirkulierenden Tumorzellen zur Überwachung des Ansprechens auf die Therapie bei Patienten mit MBC zu empfehlen.
Brustzentrum, Kantonsspital St. Gallen
Rorschacher Strasse 95
9007 St.Gallen
1. Grimm LJ, Plichta JK, Hwang ES. More Than Incremental: Harnessing Machine Learning to Predict Breast Cancer Risk. Journal of Clinical Oncology 2022;40(16):1713-7.
info@onco-suisse
- Vol. 12
- Ausgabe 7
- Oktober 2022