- Best of ASCO 2022

In diesem Jahr waren die Reihen im weitläufigen McCormick Place Convention Center doch auffällig gelichtet und viele Teilnehmer (geschätzt wohl die Hälfte) sind nun virtuell unterwegs: gut für die Umwelt und angenehm für die Teilnehmer vor Ort. Ansonsten wie immer sind die Räume unterkühlt. Hier hat es noch grosses Potential zum Energiesparen und Schonen der Teilnehmer vor steifem Nacken und Erkältung. Toll immer der weite Blick auf den rauen tiefblauen Lake Michigan und die vertraute grossartige Skyline von Chicago! Besonders wertvoll auch, dass man immer wieder geschätzte Kolleginnen und Kollegen antrifft und sich fachlich und persönlich austauschen kann.
In diesem Jahr war das Thema der repräsentativen Studieninklusion von verschiedenen Ethnien, Altersgruppen und Tumorstadien ein wichtiges Thema in vielen Sitzungen. Es wurde in vielen Studien nachgewiesen, dass nicht-weisse Patienten, ältere Patienten, Patienten von sozial deprivierten Schichten und auch Patienten mit Hirnmetastasen oder verschiedenen Morbiditäten nicht oder zu wenig repräsentiert sind. Häufig sind es nicht die Exklusions-Kriterien, sondern die behandelnden Ärzte selber, welche diesen Patienten eine Studienteilnahme gar nicht erst anbieten. Es wurde breit gefordert, dass Studien mehr die «real world» Situation abbilden müssen und entsprechende Ideen und Tools wurden vorgestellt. Viele Präsentationen hatten zudem das Thema der digitalen Kontakte zum Befinden der Patienten zum Thema. Es zeigt sich, dass dieser e-Kontakt geschätzt und auch zuverlässig eingesetzt wird, die Betreuung und Lebensqualität der Patienten signifikant verbessert, weniger ungeplante Hospitalisationen und Konsultationen verursacht und in einigen Studien auch positive Effekte auf Therapieresultate inklusive Overall Survival hat. Hier ist mit relativ wenig und kostengünstigem Aufwand vieles für die Betreuung von Patienten und ihre Familien zu gewinnen.
Viel Spass bei der Lektüre wünscht Ihnen
Prof. em. Dr. med. Thomas Cerny & Eleonore E. Droux
Klassisches Hodgkin-Lymphom (cHL)
Brentuximab-Vedotin plus Chemotherapie verbessert das Überleben
Im Rahmen der ECHELON-1-Studie wurde bei Patienten mit einem cHL (Stadium III und IV) in der First line die zusätzliche Gabe des Antikörper-Wirkstoff-Konjugats Brentuximab-Vedotin (Adcetris®) zur Chemotherapie (A+AVD) mit der alleinigen Chemotherapie (ABVD) verglichen. Es zeigte sich ein Vorteil beim PFS für A+AVD. Jetzt wurden erstmals Daten zum OS bei einem medianen Follow up von fast sechs Jahren präsentiert.
Eingeschlossen in diese Studie wurden 1.334 Patienten mit einem cHL Stadium III/IV. Sie erhielten randomisiert sechs Zyklen A+AVD (Brentuximab-Vedotin, Doxorubicin, Vinblastin, Dacarbazin) oder ABVD (Doxorubicin, Bleomycin, Vinblastin, Dacarbazin) an Tag 1 und Tag 15 alle 28 Tage. Das mediane Follow up betrug 73 Monate.
Unter A+AVD wurden 39 Todesfälle dokumentiert, unter ABVD 64. Es zeigte sich ein signifikanter Vorteil in der A+AVD-Gruppe beim OS. Die geschätzte 6-Jahres-Überlebensrate war bei A+AVD 93,9% vs. 89,4% in der ABVD-Gruppe. Mit A+AVD konnte somit das Sterberisiko um 41% reduziert werden. Bei der PFS-Rate standen 82,3% bei A+AVD 74,5% bei ABVD gegenüber. Bzgl. Sicherheit und Toxizität ergaben sich keine relevanten Unterschiede. Die Therapie-induzierte Neuropathie zeigte bei 72% in der A+AVD-Gruppe und bei 79% in der ABVD-Gruppe eine deutliche Besserung bzw. eine vollständige Rückbildung, «Angesichts dieser Daten empfiehlt sich in der First line bei cHL-Patienten im Stadium III und IV bevorzugt der Einsatz von A+AVD», so der Studienautor Dr. Stephen M. Ansell, Rochester.
PS
Abstract #7503
Metastasiertes Mammakarzinom
Bei niedriger HER2-Expression ist Enhertu® der neue Standard
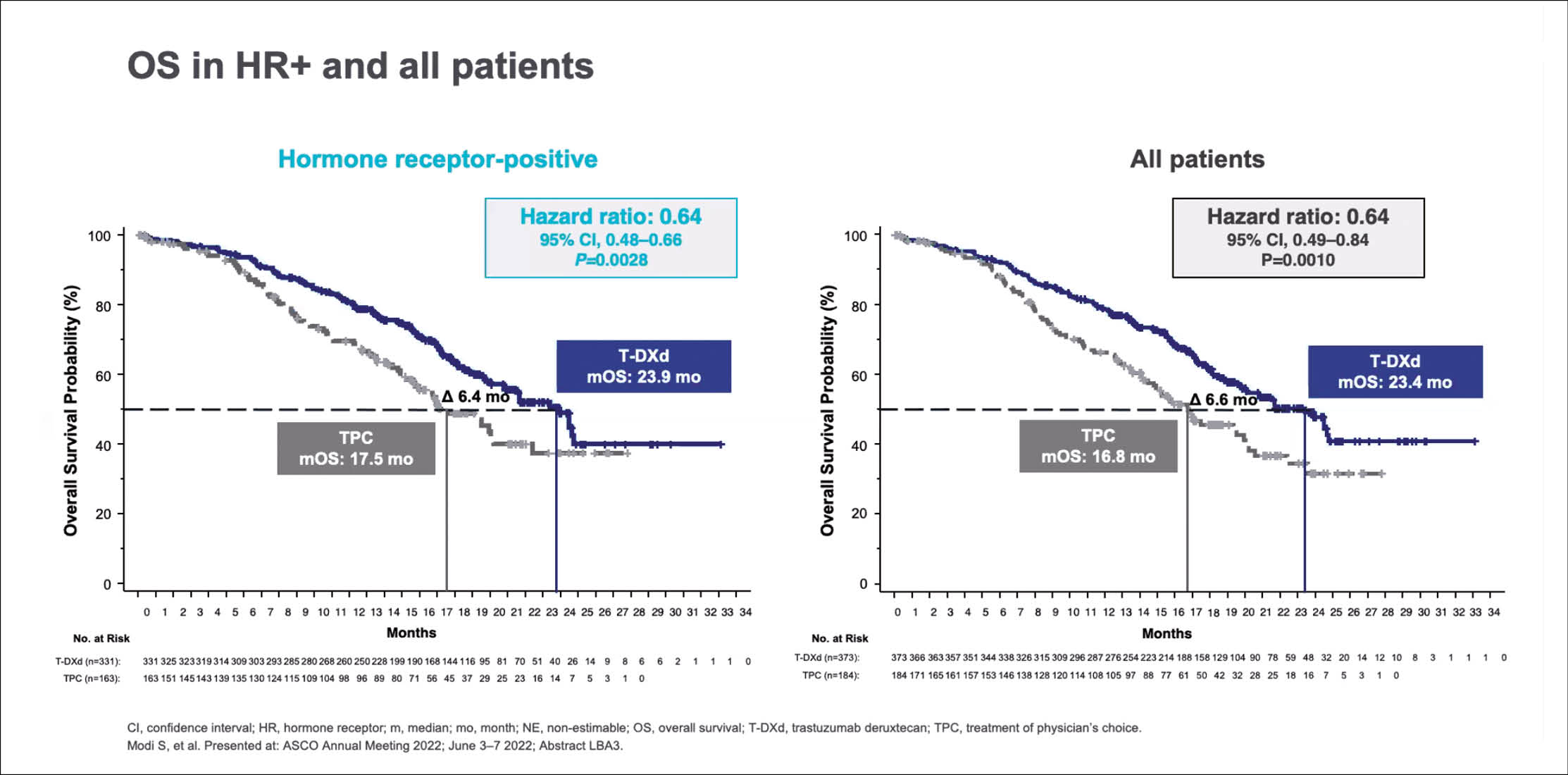
Diese Aussage basiert auf den Ergebnissen der DESTINY-Breast04-Studie. Im Rahmen dieser Studie konnte erstmals gezeigt werden, dass Patientinnen mit einem metastasierten Mammakarzinom bei niedriger HER2-Expression von der gezielten Therapie mit Trastuzumab Deruxtecan (Enhertu®) mehr profitieren als von einer Chemotherapie.
«Solche Patientinnen galten bisher als HER2-negativ und deshalb stand für sie nur eine Chemotherapie zur Verfügung», so Professor Nadia Harbeck, München. Mit innovativen Tools, die eine höhere Sensitivität aufweisen, könnten heute Patientinnen mit einer niedrigen HER2-Expression zuverlässig detektiert werden. Deshalb gilt die herkömmliche Einteilung des Mammakarzinoms in HER2-positiv und HER2-negativ als überholt. Eine weitere für die Therapie entscheidende Tumorentität ist nach Meinung von Professor Giuseppe Viale, Mailand, dazugekommen, nämlich Tumore mit einem niedrigen HER2-Expressions-Level. Nach aktuellen Untersuchungen zeigt sich bei Anwendung von empfindlicheren Tools immunhistochemisch und bei der in situ Hybridisierung bei ca. 60% der primär als HER2-negativ eingeordneten Tumore eine niedrige HER2-Expression, was die Möglichkeit für eine Anti-HER2-gerichtete Therapie eröffnet und zwar als Alternative zu einer Chemotherapie. Dies sei, so Viale, ein bedeutender Fortschritt.
DESTINY-Breast04-Studie
Dies war die Rationale für die DESTINY-Breast04-Studie. Im Rahmen dieser Studie erhielten 557 Patientinnen mit einem metastasierten Mammakarzinom mit einer niedrigen HER2-Expression 2 : 1 randomisiert entweder Trastuzumab Deruxtecan oder eine Chemotherapie nach Wahl des behandelnden Arztes (Capecitabin, Eribulin, Gemcitabin, Paclitaxel). Bei 88,7% war der Tumor Hormonrezeptor (HR) – positiv. Primärer Endpunkt war das PFS.
«Unter Trastuzumab Deruxtecan wurde dieses bei HR-positiven Frauen von 5,4 Monaten unter Chemotherapie auf 10,1 Monate verlängert, das Überleben stieg von 17,5 Monate auf 23,9 Monate» so William Jacot, Montpellier. Doch der Benefit war unabhängig vom Hormonrezeptor-Status. Im Gesamtkollektiv verlängerte das Antikörper-Arzneistoff-Konjugat das mediane PFS von 5,1 auf 9,9 Monate und das OS von 16,8 auf 24,4 Monate (p = 0,001). Die objektiven Ansprechraten betrugen bei HR-positiven Frauen 53%, bei HR-negativen 50% unter Trastuzumab Deruxtecan, unter der Chemotherapie waren es 16% bzw. 17%.
«Mit Trastuzumab Deruxtecan wurden die Patientinnen im Median 8,2 Monate, in der Vergleichsgruppe dagegen nur 3,5 Monate chemotherapeutisch behandelt», so Jacot. Schwere Nebenwirkungen vom Schweregrad ≥ 3 traten bei 28% in der Trastuzumab Deruxtecan-Gruppe und bei 25% in der Chemotherapie-Gruppe auf.
«Diese Ergebnisse sind ein grosser Fortschritt für betroffene Frauen und sie sollten deshalb möglichst schnell Eingang in den klinischen Alltag finden»; so Eva Schumacher Wulf, Köln, Chefredakteurin von Mamma Mia. Mit Trastuzumab Deruxtecan stehe jetzt ein neuer Standard zur Verfügung, der keiner Patientin vorenthalten werden sollte.
PS
Quelle: Virtual Press Briefing im Rahmen des ASCO 2022, 6.6.2022; Veranstalter: Fa. Daiichi Sankyo
Lokal fortgeschrittenes Rektumkarzinom
Bei MRD geling mit PD-1-Blockade komplette Remission
Die neoadjuvante Radio-Chemotherapie ist die Standardtherapie beim lokal fortgeschrittenen Rektumkarzinom. Bei einem Teil der betroffenen Patienten findet sich bei der molekularen Analyse ein «mismatch repair deficient (MRD)». Dieser Biomarker erwies sich beim metastasierten kolorektalen Karzinom als zuverlässiger Prädiktor für ein Ansprechen auf eine Immuntherapie mit einem PD-1-Inhibitor.
Dies ist die Rationale für eine prospektive klinische Phase-2-Studie mit dem PD-1-Inhibitor Dostarlimab bei Patienten mit einem Lokal fortgeschrittenen Rektumkarzinom (Stadium II und III) mit MRD. Eingeschlossen wurden 12 Patienten. Das mediane Follow up betrug 6 Monate. Sie erhielten alle 3 Wochen über sechs Monate den PD-1-Inhibitor, bevor die Radio-Chemotherapie und Operation hätte durchgeführt werden können. Bei Patienten, die nach der Immuntherapie eine komplette Remission erreicht hatten, wurde auf eine weitere Therapie verzichtet.
Alle 12 Patienten erreichten eine komplette Remission, d.h. weder mittels MRI noch FDG-PET und Endoskopie incl. Biopsie konnten Tumorreste nachgewiesen werden. Bis jetzt musste kein Patient neoadjuvant und chirurgisch weiterbehandelt werden. Bei einem Follow up von bis zu 25 Monaten konnte kein Rezidiv dokumentiert werden. Schwerwiegende Nebenwirkungen > Grad 3 traten nicht auf. «Diese ersten Erfahrungen zeigen, dass bei Vorliegen von MRD ein Rektumkarzinom sehr sensitiv für eine PD-1-Blockade ist», so der Studienautorin Dr. Andrea Cercek, New York.
PS
LBA5
Uterusleiomyosarkom: Ein Schritt vorwärts
Sarcoma
Correlative results from NCI protocol 10250: A phase II study of temozolomide and olaparib for the treatment of advanced uterine leiomyosarcoma (uLMS).
Diese Studie nimmt Bezug auf die Tatsache, dass ca 18-25% der uLMS Defekte in den HR (homologous recombination) der DNA Reparatur Genen aufweisen. In einer Phase 2 Studie wurde die Kombination Olaparib und Temozolamid mit einer OR von 27% und einem PFS von 6.9 Monaten als aktiv Kombination dokumentiert und am ASCO 2021 (abstract 11506) vorgestellt. Die uLMS gelten als ein aggressiver Sarkomtyp mit insgesamt sehr unbefriedigendem Ansprechen auf Chemotherapie. Deshalb wurde versucht, ob sich molekulatgenetische prädiktive Marker für das Ansprechen finden lassen.
In dieser einarmigen multizentrischen Phase 2 Studie wurden Frauen mit uLMS nach Versagen mindestens einer oder auch mehrerer Therapien aufgenommen. Dabei wurden initiale Tumorbiopsien und beim Rezidiv erneute Tumorbiopsien von 22 Patientinnen mit verschiedenen aufwändigen im voraus festgelegten Methoden bezüglich der HR Gen-Alterationen mit zudem auch funktionalen Tests untersucht und in einem HRD-Score erfasst. Dabei fanden sich in 31% (5/16) der Patientinnen Mutationen oder Deletionen im HR Panel. Es wurden auch Gesamtgenom Sequenzierungen (WES) durchgeführt und es fanden sich dabei auch genetische Alterationen im TP53 (56%) and RB1 (19%). Insgesamt hatten die meisten Frauen mit uLMS HR-Defekte gemessen mit dem HRD Score. Eine Gruppe von Patientinnen, welche besser auf die Therapie mit Olaparip und Temozolamid ansprachen konnte damit identifiziert werden. Nun ist eine randomisierte Phase 3 Studie in Vorbereitung, welche diese Kombination gegenüber Best Choice vergleichen soll.
ThC
Abstract 11509
LBA7502 Mantelzell Lymphom mit Ibrutinib
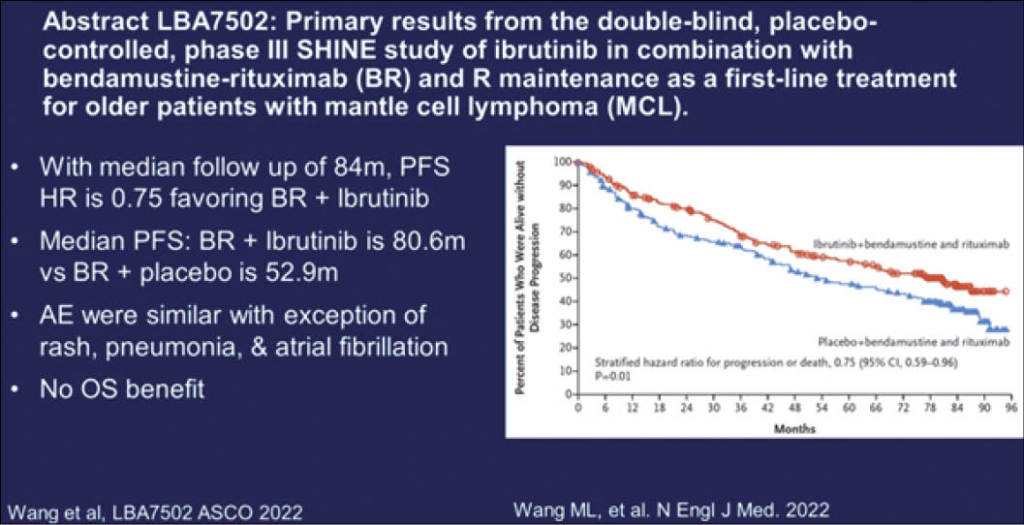
Bereits parallel auch im NEJM erschienen ist diese grosse Placebo kontrollierte verblindete Phase 3 SHINE-Studie von 523 Patienten, alle >65 Jahre, in der Erstlinien Therapie mit dem Brutonkinase-Inhibitor Ibrutinib oral 560mg (4 Tbl täglich) plus die Standard Therapie i.v. Bendamustin/Rituximab versus Placebo (4 Tbl täglich) und die gleiche i.v. Standard Therapie. Alle Patienten erhielten zudem eine Rituximab Maintenance wenn sie eine CR/PR erreichten für total 12 Infusionen alle 2 Monate. Der primäre Endpunkt war PFS und das OS war ein weiterer Endpunkt. 261 Patienten erhielten Ibrutininb+Standard und 262 Patienten den Kontrollarm. Nach einem medianen Follow-up von 84.7 Monaten war das PFS im Verumarm 80.6 Monate versus 52.9 Monaten im Kontrollarm (HR für PFS, PD oder Tod wegen Progression: 0.75; 95% CI, 0.59 to 0.96; P=0.01). Eine CR erreichten 65.5.% Patienten im Verumarm versus 57.6% im Kontrollarm (P=0.06). Zum Zeitpunkt des Daten cut-off’s waren 116 (44.4%) der Patienten im Ibrutinib-Arm progredient oder verstorben und 152 (58%) im Kontrollarm. Das Gesamtüberleben war aber statistisch nicht unterschiedlich und die Inzidenz der Grad 3 und 4 Toxizität betrug 81.5% im Ibrutinib Arm und 77.3% im Placeboarm.
Weitere BKI’s wie Acalabrutinib und Zanubrutinib sind für Patienten mit Mantelzell Lymphom und Rezidiv bereits zugelassen und auch dort sind weitere Studien upfront unterwegs. Besonders interessant dürfte die englische ENRICH Studie werden, welche eine Chemotherapie-freie Kombination von Ibrutinib und Rituximab bei älteren Patienten untersucht oder auch die Kombination von Ibrutinib + Rituxiumab mit Venetoclax (OASIS-2 Studie) und nicht zuletzt natürlich auch die Optionen der zellulären Immuntherapie mit CART’s.
ThC
Eine negative Phase 3 (MITO23) bei Patientinnen mit rezidiviertem BRCA/ness+ Ovarialkarzinom
Trabectedin hat eine gut dokumentierte Aktivität als Monotherapie bei Frauen mit rezidiviertem platin-sensitivem Ovarialkarzinom mit einer Ansprechrate (ORR) von 26-43% und einem medianen PFS von 5 Monaten. Ebenso konnte gezeigt werden, dass Trabecitdin eine Ansprechrate von 39.4%, ein medianes PFS von 4.5 Monaten und ein OS von 18 Monaten bei Patientinnen mit rezidiviertem BRCA mutiertem (incl. BRCAness Phenotyp) Ovarialkarzinom erzielte.
In dieser randomisierten, offenen Phase 3 Studie wurden 244 Patientinnen (median 60 Jahre alt) mit rezidiviertem BRCA mutiertem (incl. BRCAness Phenotyp) Ovarialkarzinom nach mindestens 2 Platinhaltigen Vortherapien randomisiert. Verglichen wurde Trabectidin Monotherapie 1.3mg/m2 alle 3 Wochen versus Best-Choice (wie Carboplatin, Gemcitabine, wöchentlich Paclitaxel, pegyliertes liposomales Doxorubicine oder Topotecan) des behandelnden Teams. Der primäre Endpunkt war das OS. Sekundär wurden das PFS, ORR und DoR exploriert. Nach einem medianen Follow-up von 18.8. Monaten war das OS 15 Monate für den Verumarm mit Trabectidin versus 17.9. Monaten für den Kontrollarm (HR, 1.15; 95% CI, 0.88-1.51; P=.304). Das mediane PFs betrug 4.9. Monate für den Verumarm versus 4.4. Monate für den Kontrollarm. Die ORR betrug für Trabectidin 17.1.% und 21.4.% für den Kontrollarm. Die mediane DoR betrug 5.62 versus 5.66 und war praktisch identisch. Bezgl. der Nebenwirkungen Grad 3-4 war Trabectidin mit 71.1% versus 50% belastender als der Verumarm.
Somit ist Trabectidin in dieser Patientenpopulation mit rezidiviertem BRCA mutiertem (incl. BRCAness Phenotyp) Ovarialkarzinom nicht besser als die Kontrollgruppe mit Best Choice der Behandlungsteams aber toxischer.
ThC
Abstract LBA5504
Luminales Mammakarzinom
Nicht jede Patientin muss nachbestrahlt werden
Mit der LUMINA-Studie konnte erstmals in einem prospektiven Design gezeigt werden, dass bei Patientinnen mit einem luminalen Mammakarzinom mit niedrigem Risiko für ein Rezidiv auf eine adjuvante Bestrahlung verzichtet werden kann.
In der Regel erfolgt bei Frauen mit einem Mammakarzinom nach einer brusterhaltenden Operation eine adjuvante Bestrahlung, um das Risiko für ein Lokalrezidiv zu minimieren. Eine solche geht bei den betroffenen Patientinnen mit einer nicht unerheblichen Beeinträchtigung des Allgemeinbefindens einher und es gibt auch lokale Komplikationen. Da stellt sich die Frage, ob eine Bestrahlung immer zwingend erforderlich ist. Gibt es Patientinnen, bei denen auf die Bestrahlung verzichtet werden kann, ohne dass dadurch die Prognose verschlechtert wird?
Dieser Frage ist man im Rahmen der LUMINA-Studie nachgegangen, einer prospektiven Studie. Randomisiert wurden 501 Patientinnen in einem Alter ab 55 Jahren (88% waren jünger als 75 Jahre) mit einem luminalen Mammakarzinom Typ A mit einem Grading 1-2 und einem Stadium T1N0 nach einer brusterhaltenden Operation, die alle eine adjuvante endokrine Therapie erhielten. Aus früheren retrospektiven Analysen weiss man, dass solche Frauen ein sehr geringes Risiko für eine Tumorprogression zeigen, d.h. die 5-Jahres-Rezidivrate lag bei 2,3%. Charakterisiert waren die Tumore durch E (Östrogen) R > 1%, P (Progesteron) R > 20% und HER2-. Der Biomarker Ki67 lag unter 13,25%. Die mediane Tumorgrösse lag bei 1,1 cm. Das Follow up betrug 5,5 Jahre.
Das Risiko für ein Lokalrezidiv betrug 2,3% und lag damit in einem Bereich wie für ein kontralaterales Mammakarzinom, das sich bei 1,9% entwickelte. Das Gesamtrisiko für ein Tumorrezidiv lag bei 2,7%. «Mit dieser Studie konnte erstmals prospektiv gezeigt werden, dass solchen Frauen mit einem sehr niedrigen Risiko eine postoperative Bestrahlung erspart werden kann», so der Studienautor Dr. Timothy J. Whelan, Hamilton/Kanada.
PS
LBA501
HR+/HER2-metastasiertes Mammakarzinom
Sacituzumab Govitecan (SG) verlängert das PFS
In der ersten Phase-3-Studie erwies sich SG bei Patientinnen mit einem HR+/HER- metastasierten Mammakarzinom einer Chemotherapie als überlegen. Das Risiko für Progression oder Tod wurde um 34% reduziert.
HR+/HER2- ist der häufigste Subtyp des metastasierten Mammakarzinoms. Die Therapie umfasst zunächst eine sequentielle endokrine Therapie gefolgt von einer zielgerichteten Therapie bevor eine singuläre Chemotherapie eingeleitet wird, wobei die Wirkdauer der einzelnen Schritte immer kürzer wird. Sacituzumab Govitecan (Trodelvy®)ist ein gegen Trop-2-gerichtetes Antikörper-Wirkstoff-Konjugat. Die Substanz enthält neben dem humanisierten monoklonale Antikörper Sacituzumab den Wirkstoff SN-38, der aktive Metabolit von Irinotecan, welches die Topoisomerase inhibiert auch noch einen hydrolysierbaren Linker.
In Phase 1/2-Studien konnte mit dieser innovativen Substanz bei Patientinnen mit einem HR+/HER2- metastasierten Mammakarzinom eine ORR von 31,5% erreicht werden bei einem PFS von 5,5 Monaten und einem OS von 12 Monaten und dies bei einem handhabbaren Sicherheitsprofil.
Die TROPiCS-02-Studie ist die erste Phase-3-Studie mit dieser Substanz. Eingeschlossen wurden 543 Patientinnen mit mindestens einer Vortherapie in einem nicht-adjuvanten Setting. Sie erhielten randomisiert entweder SG oder eine Mono-Chemotherapie nach Wahl des behandelnden Arztes (TBC). Das mediane PFS lag unter SG bei 5,5 Monaten im Vergleich mit 4,0 Monaten bei TPC. Die Vergleichswerte bezüglich PFS-Rate betrugen nach 12 Monaten 21,3% vs. 7,1%. Das Risiko für eine Progression oder Tod wurde mit SG um 34% gesenkt. «Diese Daten sprechen dafür, dass SG eine wichtige neue Behandlungsoption für Patientinnen mit einem HR+/HER2- metastasierten Mammakarzinom darstellt», so die Studienautorin Dr. Hope S. Rugo, San Francisco.
PS
LBA1001
Immuntherapie beim fortgeschrittenen NSCLC
Kombination mit Chemotherapie verbessert nicht die Prognose
Eine grosse Metaanalyse zeigt, dass bei Patienten mit einem fortgeschrittenen NSCL, die eine Immuntherapie erhalten, durch eine zusätzliche Chemotherapie das Überleben nicht verbessert wird.
Ausgewertet wurden in dieser Beobachtungsstudie die Daten aus 12 Studien (KEYNOTE, IMPower, CheckMate) von 3.189 Patienten mit einem NSCLC und einem PD-L1 ≥ 50%. Das mediane OS betrug unter der Kombination 25,0 Monate vs. 20,9 Monate unter der Immun-Monotherapie. Beim PFS waren es 9,6 vs. 7,1 Monate. Das ORR war unter der Kombination allerdings höher (61% vs. 43%). Die Unterschiede waren nicht signifikant.
Bei älteren Patienten über 75 Jahren war das OS und PFS sogar günstiger, wenn sie nur die Immuntherapie erhielten. Eine zusätzliche Platin-basierte Chemotherapie verschlechterte in dieser Altersgruppe sogar die Prognose. «Auch wenn noch keine Daten aus randomisierten prospektiven Studien vorliegen, so sollten wir diese Ergebnisse im klinischen Alltag berücksichtigen und im Einzelfall bei entsprechender Nutzen-Risiko-Abwägung entscheiden, ob zusätzlich eine Chemotherapie durchgeführt werden sollte«, so der Studienautor Dr. Oladimeji Akinboro, Silver Spring.
PS
Abstract 9000
LBA2002 low grade Gliome Kinder LGG
Der häufigste Hirntumor bei den Kindern ist das low grade Gliom LGG. Die BRAF 600 Mutation wird in ca. 17% dieser Gliome nachgewiesen. Es konnte bei Kindern mit rezidivierendem LGG in einer Phase1/2 Studie mit Dab+Tram gezeigt werden, dass diese BRAF 600V gerichtete Therapie aktiv ist und somit eine grössere randomisierte up-front Studie gegen die bisherige Chemotherapie wie Carboplatin und Vincristin (C+V) gerechtfertigt ist.
Die Kinder und Jugendlichen im Alter von 2- >18Jahren mussten einen Karnofsky/Lansky von >50% aufweisen. Sie erhielten oral Dabafenib 2x täglich (<12, 5.25 mg/kg/d; ≥12 J, 4.5 mg/kg/d) + Trametnib einmal täglich (<6 J, 0.032 mg/kg/d; ≥6 J, 0.025 mg/kg/d) oder C+V (Standarddosis).
Die Studienanlage und die erfreulichen Resultate der 110 randomisierten Kinder mit einem medianen PFS von 20.1 versus 7.4. Monaten sind in der folgenden Tabelle zusammengefasst.
Nach einem medianen Follow-up von 18.0 Monaten sind im Verumarm noch keine Kinder verstorben und im Kontrollarm mit Chemotherapie ist ein Kind an Progression verstorben. Die Nebenwirkungen und die Abbrechrate waren im Verumarm klar besser: Grad3 AE’s 47% vs 94% und Abbrechen der Therapie: 4% vs 18%. Hauptnebenwirkung der Dab+Tram im Vergleich zur Chemotherapie waren Fieber (68% vs 18%), Kopfweh (47% vs 27%), und Erbrechen (34% vs 48%). Somit kann diese zielgerichtet Dab+Tram Therapie als neue Erstlinientherapie bei Kindern mit BRAF V600 mutiertem LGG betrachtet werden.
ThC
Metastasiertes Mammakarzinom
Ribociclib plus ein Wechsel in der Hormontherapie verlängert das PFS
Wenn Patientinnen mit einem metastasierten HR+/HER2- Mammakarzinom, die unter einem CDK4/6-Inhibitor eine Progression entwickeln, auf Ribociclib zusammen mit einer anderen Hormontherapie umgestellt werden, so führt dies zu einer signifikanten Verlängerung des PFS.
Dies ist das Ergebnis der MAINTAIN-Studie, einer prospektiven Phase-2-Studie. Eingeschlossen in diese Studie wurden 120 Patientinnen mit einem metastasierten HR+/HER2- Mammakarzinom, die unter einem CDK4/6-Inhibitor plus Hormontherapie (Fulvestrant oder Exemestan) einen Progress zeigten. Bei ihnen wurde die Therapie umgestellt. Sie erhielten jetzt Placebo oder den CDK4/6-Inhibitor Ribociclib plus das Hormonpräparat, welches primär nicht eingesetzt wurde. Primär hatten 84% Palbociclib und 11% Ribociclib erhalten. 83% erhielten nach der Umstellung Fulvestrant.
Nach einem medianen Follow up von 18,2 Monaten lag das PFS in der Ribociclib-Gruppe bei 5,29 Monaten vs. 2,76 Monate unter Placebo. Der Unterschied war signifikant und unabhängig von der Art des Hormonpräparates. Dies entspricht einer Reduktion des Risikos für Progression oder Tod von 57%. «Dieser Benefit von fast sechzig Prozent ist durchaus klinisch relevant», so die Studienautorin Dr. Claudine Isaacs, Georgetown.
PS
LBA1004
KRAS-Wildtyp-Pankreaskarzinom
Nimotuzumab plus Gemcitabin verlängert das Überleben
Bei Patienten mit einem fortgeschrittenen KRAS-Wildtyp-Pankreaskarzinom wird das Überleben verlängert, wenn zusätzlich zu Gemcitabin der EGFR-Inhibitor Nimotuzumab gegeben wird.
Dies ist das Ergebnis der NOTABLE-Studie mit 92 Patienten. Das Gesamtüberleben stieg unter Nimotuzumab von 8,5 Monate auf 10,9 Monate bei alleiniger Gemcitabin-Therapie (HR: 0,5, p = 0,024). Die 1-Jahres-Überlebensrate stieg von 26,8% in der Vergleichsgruppe auf 43,6% unter dem monoklonalen Antikörper. Nach 3 Jahren lebten in der Nimotuzumab-Gruppe noch 13,9%, in der Vergleicsgruppe nur 2,7%. Der Benefit fand sich in allen Subgruppen. Besonders ausgeprägt war der Effekt bei Patienten, die nicht operiert waren. «Nimotuzumab ist ein deutlicher Fortschritt», so der Studienautor Dr. Shukui Qin, Nanjing.
PS
LBA4011
Fortgeschrittenes Pankreaskarzinom
Längeres Überleben mit Nivolumab plus Chemotherapie
Das Pankreaskarzinom gilt als ein nicht sehr immunogener Tumor. Doch in einer ersten kleinen Studie bei 34 Patienten erwies sich die Kombination des Checkpoint-Inhibitors Nivolumab, zusätzlich zur Chemotherapie-Doublette Gemcitabin plus nab-Paclitaxel gegeben, als durchaus wirksam. Die 1-Jahres-Überlebensrate betrug 57,7% und lag somit signifikant über der in einem historischen Kollektiv mit alleiniger Chemotherapie dokumentierten 1-Jahres-OS von 35%.
PS
#4010
Metastasiertes Hormon-sensitives Prostatakarzinom (mHSPC)
Überlebensvorteil mit Enzalutamid auch nach mehr als fünf Jahren
Bei Patienten mit einem mHSPC wird mit Enzalutamid ein Überlebensvorteil erreicht und dieser ist auch noch nach fünf Jahren nachweisbar.
In der Phase-3-ENZAMET-Studie konnte gezeigt werden, dass Patienten mit einem mHSPC von der antiandrogenen Therapie mit Enzalutamid prognostisch profitieren. Jetzt wurden erstmals Langzeitdaten für das OS, nämlich über mehr als fünf Jahre präsentiert. Eingeschlossen in diese Studie waren 1,125 Patienten mit einem mHSPC. Verglichen wurde randomisiert die Gabe von Enzalutamid mit der einer Standard Testosteron-Suppression. Bei einer Interimsanalyse im Jahr 2019 fand sich eine signifikante Abnahme des Sterberisikos unter Enzalutamid von 33% (p = 0,002) im Vergleich zur Standardtherapie.
Drei Jahre nach dieser Interimsanalyse, also nach insgesamt mehr als fünf Jahren (68 Monate), zeigte sich bei der Zweit-Analyse, dass der Überlebensvorteil anhält. Während in der Enzalutamid-Gruppe das OS noch nicht erreicht war, lag dieses in der Standardgruppe bei 73,2 Monaten. Die 5-Jahres-Überlebensrate lag unter Enzalutamid bei 67% vs. 57% unter dem Standard. Dabei ist zu berücksichtigen, dass 76% der Patienten im Kontroll-Arm im Verlauf der Studie auf Enzalutamid wechselten. Der Überlebensvorteil bei Enzalutamid zeigte sich in allen Subgruppen. «Diese Daten sind sehr robust», so der Studienautor Prof. Ian D. Davis, Australien. Doch für Patienten mit einem hohen Risiko, insbesondere bei einem grossen Tumorvolumen, sei eine Triple-Therapie aus Testosteron-Suppression, Enzalutamid und Docetaxel am effektivsten.
PS
LBA 5004
NSCLC mit KRAS-Mutation
KRAS-Inhibitor Adagrasip bewährt sich bei Hirnmetastasen
Patienten mit einem KRAS-mutierten NSCLC entwickeln in fast 50% ZNS-Metastasen und dies ist mit einer besonders schlechten Prognose assoziiert. Der neue KRAS-Inhibitor Adagrisip bindet irreversibel und selektiv an das mutierte KRAS.
Pharmakologische Daten konnten zeigen, dass die Substanz gut ins Gehirn penetriert. Auch zeigte sich in experimentellen Studien eine Regression der Hirnmetastasen. Im Rahmen der KRYSTAL-1-Studie, einer Phase 1/2 –Studie, wurde die Substanz jetzt bei NSCLC-Patienten mit Hirnmetastasen und einer KRAS-Mutation untersucht und zwar sowohl als Monotherapie als auch in Kombination mit anderen Anti-Tumor-Substanzen. Eingeschlossen wurden 25 Patienten ohne Vorbehandlung der Hirnmetastasen. Das mediane Follow up betrug 6,6 Monate.
Die ORR bzgl. Hirnmetastasen lag bei 31,6%, die Kontrollrate (DCR) bei 84,2%. Die mediane DOR war nicht erreicht. Das mediane PFS lag bei 4,2 Monaten. Liquor-Untersuchungen ergaben eine gute Penetration ins Gehirn. Das systemische ORR betrug 35%, das DCR 80,0%, das mediane DOR 9,6 Monate und das mediane PFS 5,6 Monate.
Was die Sicherheit betrifft, so ergaben sich keine neuen Gesichtspunkte. 96% der Patienten erlitten Nebenwirkungen, aber nur bei 36% waren diese vom Schweregrad 3. «Diese ersten Daten sind überzeugend dahingehend, dass mit Adagrasib eine neue Substanz bei Hirnmetastasen zur Verfügung steht», so der Studienautor Dr. Joshua K. Sabari, New York.
PS
LBA9009
N-803 und BCG-Instillation bei Patienten mit nicht muskelinvasivem Blasenkarzinom
Seit Jahrzehnten ist BCG ein Standard für die Blaseninstillation bei Patienten mit nicht muskelinvasivem Blasenkarzinom. Patienten, welche darauf nicht oder nicht mehr Ansprechen waren im Fokus dieser Studie (QUILT 3.032), welche einen neue Substanz N-803 zusammen mit BCG bei diesem Patientenkollektiv untersuchte. Letztlich geht es darum, die Zystektomie möglichst lange oder überhaupt vermeiden zu können. N-803 ist ein auf Interleukin-15 basierender Fusionsprotein-Komplex (IL-15RaFc) und es wird vermutet, dass diese Substanz zusammen mit BCG die NK-Zellen sowie durch BCG auch die T-Zell Rekrutierung stark induziert und damit vermehrt. Dies führt dann zu einem erhöhten klinischen Ansprechen und verlängert das DFS.
In dieser weiterhin offenen multizentrischen open-label QUILT 3.032 Studie wurden bisher 160 Patienten mit «non-muscle-invasive bladder carcinoma in situ» (cohort A, n = 84) oder papillärem Urotherkarzinom (cohort B, n = 77) welche auf BCG nicht angesprochen haben mit intravesikal N-803 400 µg plus BCG 50 mg wöchentlich für 6 Wochen, gefolgt von einer Erhaltungstherapie für bis zu 2 Jahren behandelt.
Der primäre Endpunkt für die Kohorte A war die Inzidenz der CR rate (CR) vom carcinoma in situ zu jedem Zeitpunkt. Der primäre Endpunkt für die Kohorte B war das DFS nach12 Monaten. Sekundäre Endpunkte waren die Dauer der CR, die Vermeidung von Zystektomie und Zeit bis zur Zystektomie.
Das mediane Alter der vorwiegend männlichen Patienten (83%) war 72.3 Jahre. Die mediane Anzahl von transurethralen Tumorresektionen war 4, und die mediane Anzahl von BCG Behandlungen war 16.6 in Kohorte A und 12.3 in Kohorte B. Auch intravesikale Chemotherapien, Antibody-Drug Conjugates und Immunotherapien wurden als Vorbehandlungen dokumentiert. Patienten mit carcinoma in situ hatten eine CR Rate von 71% mit einer Response Duration von median 26.6 Monaten. Nach ≥ 24 Monaten waren noch 53.2% in anhaltendem Ansprechen. Nach einer medianen Beobachtungszeit von 23.9 Monaten waren 84% der Patienten insgesamt und 91% der Responder ohne Zystektomie. 96.4% hatten nach 2 Jahren keine Zeichen einer muskelinvasiven Erkrankung. Das Urothelkarzinom spezifische OS war 100% in allen Gruppen.
Für Patienten mit papillarem Urothelkarzinom war das mediane DFS 19.3 Monate, 12-Monate DFS war 55%, und 24-Monate DFS war 48%. Nach einer Beobachtungszeit von 20.7 Monaten konnte eine Zystektomie in 94% vermieden werden. Bei den 4 Responders war die mediane Zeit bis zur Zystektomie 12.9 Monate und 7.8 Monate bei den 8 Nonresponders. Pharmacokinetische Daten zeigten keine Hinweise auf systemisch nachweisbares N-803. Die Nebenwirkungen waren mild mit Grade 1-2 Dysurie (22%), Pollakisurie (20%), Hämaturie (17%), Fatigue (16%), und Harndrang (12%). Grad >3 Toxizitäten oder Immun-bezogene Toxizitäten wurden nicht beobachtet. Nun braucht es Phase-3 Daten um den Stellenwert dieser aktiven Kombination auch gegenüber Pembrolizumab zu vergleichen.
ThC
4508
Metastasiertes kastrationsresistentes Prostatakarzinom (mCRPC)
Im Vergleich mit Cabazitaxel ist LuPSMA überlegen
Lutetium-PSMA ist ein Radiotherapeutikum, bei dem radioaktives Lutetium mit einem Antikörper verbunden ist, der an das Prostata-spezifische Membran-Antigen (PSMA) bindet. Es wird so im Tumor angereichert und führt zum Zelltod.
Bereits in einer früheren Auswertung einer Studie (ANZUP 1603), in der LuPSMA mit Cabazitaxel verglichen wurde, konnte bei 219 Patienten mit einem mCRPC, die unter der Chemotherapie mit Docetaxel einen Progress entwickelt hatten, gezeigt werden, dass im Hinblick auf die PSA Response Rate, aber auch beim PFS LuPSMA der Chemotherapie mit Cabazitaxel überlegen ist. Jetzt wurden erstmals OS-Daten publiziert.
Nach einem medianen Follow up von 36 Monaten waren 70/101 Patienten in der Cabazitaxel-Gruppe und 77/99 Patienten in der LuPSMA-Gruppe verstorben. Eine Folgetherapie erhielten 21 Patienten in der Cabazitaxel-Gruppe und 20 Patienten in der LuPSMA-Gruppe. Das OS war in beiden Gruppen vergleichbar, nämlich 19,1 Monate unter LuPSMA vs. 19,6 Monate unter Cabazitaxel.
«LuPSMA ist eine geeignete Strategie für mCRPC Patienten mit einem Progress unter Docetaxel, es zeigt weniger Nebenwirkungen, ist also verträglicher und die Response-Rate ist höher», so der Studienautor Dr. Michael S. Hofman, Melbourne.
PS
Abstract 5000
Frühes triple-negatives Mammakarzinom
Metronomisches Capecitabine verlängert das DFS
Im Rahmen der SYSUCC-001-Studie konnte gezeigt werden, dass bei Patientinnen mit einem operierten triple-negativen Mammakarzinom eine metronomische Capecitabine-Therapie über 1 Jahr das DFS signifikant verlängert und dies ohne unerwartete schwerwiegende Nebenwirkungen.
Aufgenommen in diese Phase-3-Studie wurden 460 Frauen mit einem operablen triple-negativen Mammakarzinom im Stadium IB-IIIC. Sie erhielten postoperativ randomisiert Capecitabine (650 mg/m2 zweimal täglich) über 1 Jahr, metronomisch also in einem adjuvanten Setting. Verglichen wurde die Chemotherapie mit der Standardtherapie. Primärer Endpunkt war das DFS, sekundäre Endpunkte DDFS und OS und die Sicherheit.
Bei einem medianen Follow up von 57 Monaten lag die DFS-Rate in der Capecitabine-Gruppe bei 83% im Vergleich zu 73% in der Standard-Gruppe. Der Unterschied war statistisch signifikant (p = 0,027). Das DDFS, also die Rate an Fernmetastasen-freiem Überleben, betrug unter Capecitabine 85% vs. 76%. Bei der 5-Jahres-Überlebensrate gab es aber keinen signifikanten Unterschied (86% vs. 81%).
Capecitabine wurde gut vertragen und 91% führten die Therapie über 1 Jahr bis zum Ende der Studie durch. Die häufigsten Nebenwirkungen waren Hanf-Fuss-Syndrom (45,2%), Leukopenie (23,5%), Bilirubinerhöhung (12,7%) und Abdominalbeschwerden (6.8%). Diese waren überwiegend Schweregrad 1/2. «Metronomisches Capecitabine entfaltet eine antitumoröse Wirkung, wobei im Hinblick auf die Verhinderung von Fernmetastasen die Hemmung der Angiogenese und die Immunstimulation eine Rolle spielen dürften», so die Studienautorin Dr. Xi Wang, Guangzhou.
PS
#507
LBA 5500 Athena Gynäkologie Rucaparib Studie
Diese grosse Phase 3 Studie untersuchte die Maintenance Erstlinien Mono-Therapie mit dem PARP-Inhibitor Rucaparib in der Erstlinientherapie für Ovarialkarzinom Patientinnen mit Stadium III-IV, high-grade Histologie, welche auf die Primärtherapie (operative Zytoreduktion und anschliessende Platinum-basierte 2er Kombinationstherapie) angesprochen haben (R0/komplete Resektion). Es wurden Patientinnen auch ohne BRCA1 und BRCA2 (BRCA) Mutationen, «homologous recombination deficiency» (HRD) oder Hochrisiko Charakteristika wie Resttumor nach Operation eingeschlossen. Die Randomisation erfolgte 4:1 mit oral Rucaparib 600 mg 2x/Tag versus Placebo. Stratifikation erfolgte nach HRD Status, «Residual Disease» nach Chemotherapie und Zeitpunkt der Operation. Der primäre Endpunkt war das PFS.
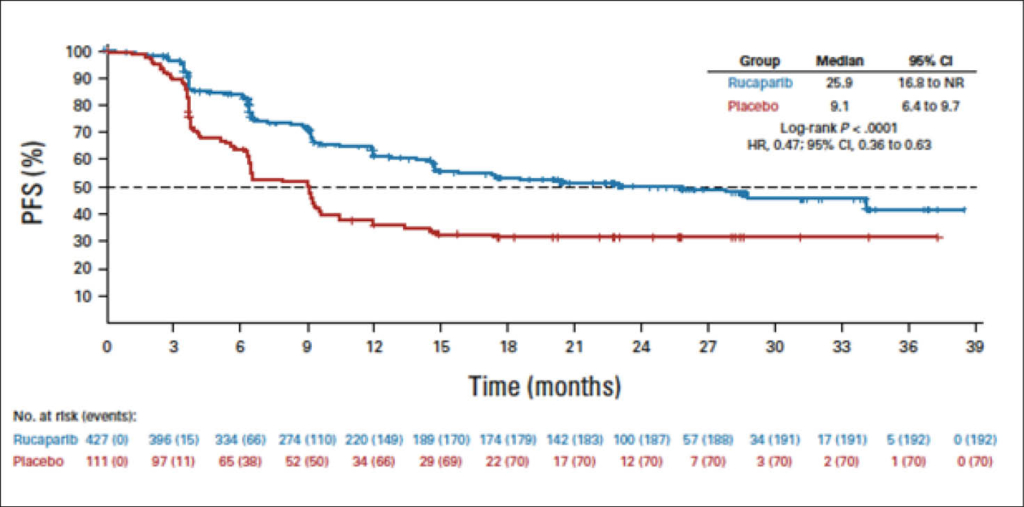
Bis März 2022 wurde 427 und 111 Patientinnen randomisiert für Rucaparib oder Placebo (HRD Population: 185 v 49). Das mediane PFS betrug 28.7 Monate für den Verumarm mit Rucaparib versus 11.3 Monate für Placebo in der HRD Population (HR, 0.47; 95% CI, 0.31 -0.72) und 12.1 Monate versus 9.2 Monate. In der HRD-negativen Population (HR, 0.65; 95% CI 0.45-0.95). Für die Intension to Treat Population waren die Resultate: 20.2 Monate (15.2 to 24.7) versus 9.2 Monate (8.3 to 12.2) mit P: 0.0001; (HR, 0.52; 95% CI, 0.40 to 0.68).
Grad 3 AES waren primär die Anämie (Rucaparib, 28.7% v Placebo, 0%) und Neutropenie (14.6% v 0.9%). Die Graphik zeigt die PFS-Kurve für die Intention-to-treat Population entsprechend der BICR (blinded independent central review). Die Arbeit wurde gleichzeitig zum ASCO im JCO 2022 am 8.6. von Monk et al. publiziert.
Zusammenfassend ist die Maintenance Mono-Therapie mit Rucaparib klinisch eindrücklich wirksam und es stellt sich die Frage, wie dieses Resultat in der Praxis umgesetzt wird, da zB auch Bevacizumab in der Erhaltungstherapie wirksam ist und weitere Substanzen zur Diskussion stehen. Hier wird es vergleichende Studien und Kombinationsstudien brauchen, um diese wichtigen Fragen anzugehen.
ThC
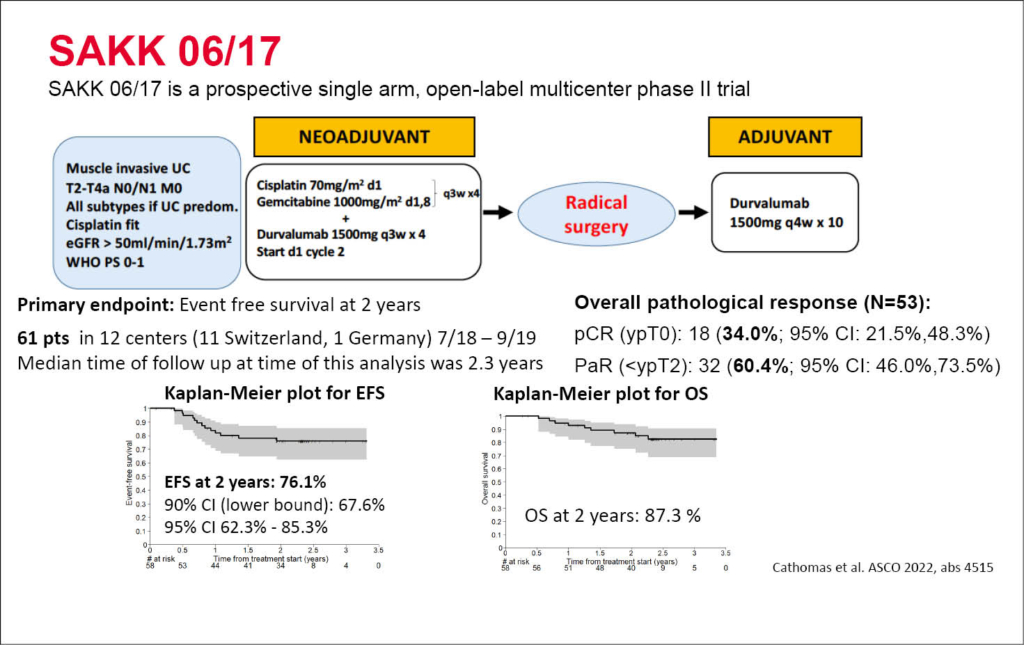
SAKK präsentiert die neoadjuvante Phase-2 Studie (SAKK 06/17) für Patienten mit muskelinvasivem Blasenkarzinom
Richard Cathomas stellte die Daten einer neoadjuvanten und adjuvanten Therapie des muskelinvasiven Blasenkarzinoms mit Studienendpunkt zweijährigem ereignisfreien Überleben (EFS) vor. Es wurden total 61 Patienten mit noch lokalisierten muskelinvasiven Blasenkarzinom (cT2-cT4a cN0-1) eingeschlossen. Die Patienten erhielten 4 Zyklen einer neoadjuvanten Chemotherapie mit Cisplatin/Gemcitabine in Kombination mit 4 Zyklen einer neoadjuvanten Therapie mit Durvalumab. Nach erfolgter kompletter chirurgischer Tumorentfernung erhielten die Patienten zusätzlich bis maximal 10 Zyklen mit adjuvant Durvalumab. Nach 2 Jahren erreichten 76.1% der Patienten ohne lokalen Tumorprogress und ohne Metastasierung das EFS. Ein pathologisches Ansprechen (<ypT2 ypN0) erreichten 55% und bei diesen Patienten lag das 2-Jahres-EFS bei 92,9% (ypT1/a/is) bzw. 100% (ypT0). Bezüglich der Nebenwirkungen wurden keine neuen Sicherheitssignale festgestellt: Grad 3-4 Durvalumab assoziierte bekannte reversible immunologische Nebenwirkungen wurden in 19% bez. 7% dokumentiert. Das OS nach 2 Jahren betrug 87.3.%.
Diese Daten rechtfertigen nun eine randomisierte prospektive Studie der hier untersuchten neoadjuvanten und adjuvanten Kombinationstherapie mit zusätzlich Durvalumab gegenüber der bisherigen alleinigen neoadjuvanten Cisplatin-Kombinations-Chemotherapie.
ThC
Abstract 5506 Cervix Karzinom Pembrolizumab Subgruppen von KEYNOTE-826
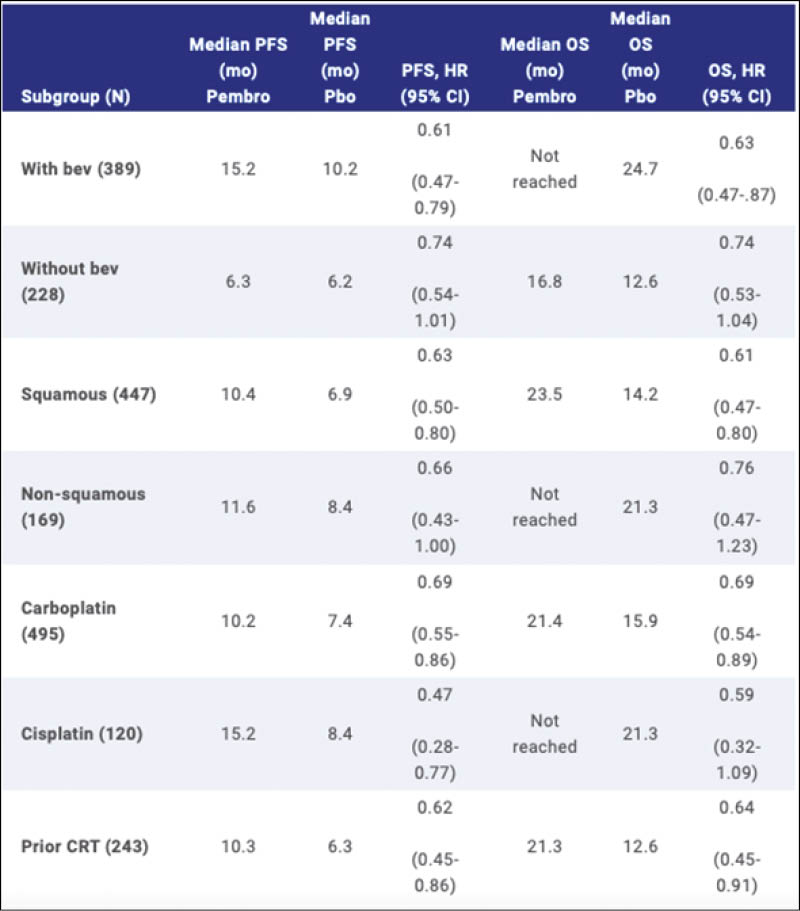
Von dieser grossen bereits bekannten positiven Phase 3 Studie mit 617 randomisierten Patientinnen mit fortgeschrittenem Zervixkarzinom, mit persistierendem Tumor, Rezidiv oder Metastasen wurden nun die Subgruppen-Resultate präsentiert. Die positiven PFS und OS Resultate sind bereits publiziert und nun liegen reife klinisch interessante Auswertungen für die diversen Subgruppen vor. Die Patientinnen wurden 1:1 randomisiert in Pembro 200mg alle 3 Wochen versus Placebo für bis zu 35 Zyklen und erhielten als Chemotherapie Paclitaxel 175mg/m2 und Cisplatin 50mg/m2 oder Carboplatin AUC 5 und Bevacizumab 15mg/kg war als weitere Option freigestellt. Der primäre Endpunkt ist zweifach: PFS und OS für PD-L1 CPS >1, CPS ≥10 sowie die Gesamtpopulation.
Die hier interessierenden Subgruppen wurden definiert als: Bevacizumab Einsatz ja oder nein, Histologischer Typ Plattenepithel versus Adenokarzinom und Adenosquamöse Histologie, Cis-oder Carboplatin Einsatz und vorangehende Chemoradiotherapie ja oder nein. Mit einem medianen Follow-up von 22 Monaten mit Stichtag 3 Mai 2021 sind die Resultate für alle Subgruppen grundsätzlich positiv, aber in verschiedenem Ausmass. Dass auch der Einsatz von Bevacizumab relevant ist, wird aus diesen Daten ebenso ersichtlich. Die Resultate sind in der folgenden Tabelle zusammengestellt:
Erfreulich ist auch, dass mit einer mittleren Beobachtungszeit im Verumarm verschiedene OS Daten noch nicht erreicht sind und wir im weiteren Verlauf noch weitere OS Verbesserungen erwarten dürfen. Somit ist nach vielen Jahren der Stagnation für viele Patientinnen mit rezidiviertem oder metastasiertem Zervixkarzinom die Prognose klar verbessert worden.
ThC
Second-line beim NSCLC
Ramucirumab durchbricht die Checkpoint-Inhibitor-Resistenz
Neue Daten beim fortgeschrittenen NSCLC sprechen dafür, dass bei einem Versagen der First line-Immuntherapie die zusätzliche Gabe von Ramucirumab effektiver ist als eine Chemotherapie
Die Immuntherapie mit Checkpoint-Inhibitoren hat die Therapie des fortgeschrittenen NSCLC revolutionär verbessert. Was aber tun, wenn unter dieser Therapie ein Progress eintritt? Wenn Patienten mit einem fortgeschrittenen NSCLC, die in der First line einen Checkpoint-Inhibitor wie Pembrolizumab (Keytruda®) erhalten haben, im weiteren Verlauf eine Checkpoint-Inhibitor-Resistenz entwickeln, wird in Allgemeinen eine Chemotherapie mit Docetaxel plus dem Angiogenese-Hemmer Ramucirumab (Cyramza®), einem VEGF-Rezeptor-Inhibitor, eingeleitet.
Im Rahmen der Phase-2-Lung-MAP-Substudie (S1800A) wurde dieser Second line-Chemotherapie-basierte Standard mit der Kombination Pembrolizumab plus Ramucirumab verglichen. Eingeschlossen wurden 130 Patienten mit einem fortgeschrittenen NSCLC, die eine Resistenz gegenüber dem Checkpoint-Inhibitor entwickelt hatten. Sie erhielten entweder die Kombination Pembrolizumab plus Ramucirumab oder eine Chemotherapie nach Wahl des behandelnden Arztes evtl. in Kombination mit Ramucirumab.
Mit der Kombination Pembrolizumab plus Ramucirumab wurde eine signifikante Verbesserung des OS erreicht (14,5 Monate vs. 11,6 Monate) (p = 0,05). Doch beim PFS und ORR konnte dieser Benefit nicht dokumentiert werden. «Die Daten sprechen dafür, dass mit dieser Kombination die Checkpoint-Inhibitor-Resistenz durchbrochen werden könnte«, so die Studienautorin Dr. Christine Bestvina,
Chicago.
PS
Abstract 9004
Phase-3-Studie mit Lorlatinib bei behandlungsnaiven Patienten (Pts) mit ALK-positivem fortgeschrittenem nicht-kleinzelligem Lungenkrebs (NSCLC): Umfassende Plasma- und Tumorgenomanalysen.
Hintergrund:
Lorlatinib, ein ALK-Tyrosinkinase-Inhibitor der dritten Generation, hat eine allgemeine und intrakranielle Aktivität bei ALK + fortgeschrittenem NSCLC gezeigt. In der randomisierten, multizentrischen Phase-3-Studie in pts mit zuvor unbehandeltem ALK+ fortgeschrittenem NSCLC (CROWN; NCT03052608) zeigte Lorlatinib eine statistisch signifikante und klinisch signifikante Verbesserung des progressionsfreien Überlebens (PFS) gegenüber Crizotinib (Shaw AT, et al. N Engl J Med. 2020; 383: 2018-2029). Ein umfassendes molekulares Profiling der zirkulierenden Tumor-DNA (ctDNA) und des Tumorgewebes wurde durchgeführt, um molekulare Korrelate der Reaktion zu identifizieren.
Methodik:
Zu Studienbeginn (BL) waren Plasmaproben aus 134 bzw. 129 pt im Lorlatinib- bzw. Crizotinib-Arm verfügbar. Analysen lieferten Ergebnisse für Tumorgewebe (archivierte oder neue Biopsie) von 147 Punkten an beiden Armen. Plasma- und Tumor-DNA wurden mittels Next-Generation-Sequenzierung (NGS; Guardant360 bzw. TissueNext Guardant Health, Inc.). Die objektive Ansprechrate (ORR), die Dauer des Ansprechverhaltens und die PFS auf der Grundlage des Cutoffs vom 20. September 2021, die alle durch eine verblindete unabhängige zentrale Überprüfung bewertet wurden, wurden nach dem Status der Mutation und der Tumormutationslast (TMB) zusammengefasst.
Befund:
Bei BL hatten 22% der pts keine nachweisbare ctDNA. ALK-Missense-Mutationen (n=19) oder Deletion (n=1) wurden im Plasma von 12 pts (n=5 bzw. 7 in den Lorlatinib- bzw. Crizotinib-Armen) nachgewiesen. Die meisten Punkte beherbergten 1 Mutation, aber 3 Punkte beherbergten ≥3 Mutationen. In Tumorproben wurde keine somatische ALK-Mutation nachgewiesen. ALK-Fusionen wurden im Plasma von 48% der pts und im Tumor von 80% nachgewiesen. EML4-ALK-Variante (v)-Subtypen waren sehr konkordant zwischen ctDNA und Tumorgewebe. Basierend auf ctDNA waren die ORRs im Lorlatinib- und Crizotinib-Arm im Allgemeinen höher und erreichten 80% bzw. 72% für EML4-ALK v1 bzw. v3 im Lorlatinib-Arm und 50% bzw. 74% im Crizotinib-Arm. Das mediane PFS wurde für v1 im Lorlatinib-Arm nicht erreicht und betrug 7,4 mo im Crizotinib-Arm; für v3 betrug mPFS 33,3 bzw. 5,5 mo. TP53-Mutationen wurden in 42% der pts mit nachweisbarer ctDNA gefunden, und ihre Anwesenheit schien die Lorlatinib-Aktivität nicht zu beeinflussen. Im Crizotinib-Arm führte das Fehlen von TP53-Mutationen zu einem längeren progressionsfreien Überleben der Pest. Diese Befunde werden im Tumorgewebe verifiziert. Bei einem mit Lorlatinib behandelten PT mit einem anhaltenden partiellen Ansprechen auf Tumorläsionen zum Stichtag der Daten wurde eine KRAS G12V-Mutation und das Vorhandensein einer ALK-Fusion im Tumorgewebe festgestellt, bei BL wurde jedoch keine ctDNA nachgewiesen.
Schlüsse:
Pts mit unbehandeltem ALK+ fortgeschrittenem NSCLC hatten höhere ORRs und potenziell längere PFS in vordefinierten Biomarker-Untergruppen, wenn sie mit Lorlatinib behandelt wurden, verglichen mit Crizotinib in der Phase-3-Studie CROWN. Basierend auf ctDNA- und Tumorgewebeanalysen vor der Behandlung führte Lorlatinib zu einem starken klinischen Nutzen, unabhängig von der Art der ALK-Umlagerung oder dem Vorhandensein einer potenziellen Treiber-Co-Mutation. Informationen zur klinischen Studie: NCT03052608
Alessandra Bearz et al.
Checkpointinhibitoren auch bei BRAFV600 mutierten Melanompatienten mit Hirnmetastasen?
Patienten mit metastasiertem malignem Melanom und ZNS oder Lebermetastasen haben eine besonders schlechte Prognose. Gerade Patienten mit ZNS Metastasen werden zudem häufig von innovativen Studien ausgeschlossen. So besteht hier ein besonders dringender Bedarf klinische Studien mit neuen Medikamenten insbesondere auch Immuntherapien zu lancieren. In der Tricotel Studie, die R. Dummer präsentierte, wurde in der Kohorte 2 die Sicherheit und Wirksamkeit der Kombinationstherapie A + C + V bei BRAFV600-mutierten Patienten mit ZNS Metastasen (auch symptomatische Patienten mit Kortikosteroiden) untersucht. Patienten ≥18 Jahre alt mit MRI-dokumentierten mindestens ≥5 mm Hirnmetastasen in ≥1 Dimension und keiner Vorbehandlung für das metastasierte Stadium erhielten A (840 mg Tag1 und 15 jeden 28 Tage Zyklus) + C (60 mg täglich Tag1- 21d und dann 7 Tage Pause) + V (720 mg 2x täglich), wobei im Zyklus 1 A nicht gegeben wurde.
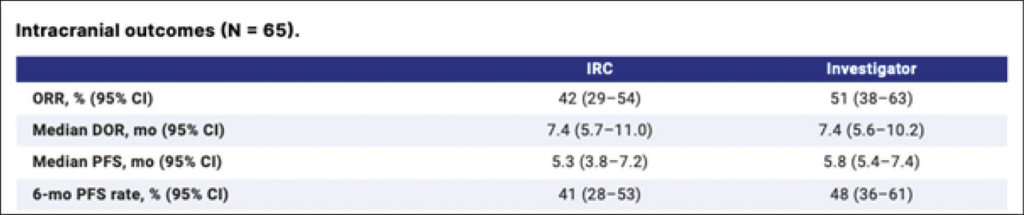
Der primäre Studienendpunkt war die Ansprechrate ORR durch ein unabhängiges Review-Committee (IRC) und sekundär wurde die «investigator-assessed intracranial ORR», extrakraniale ORR, Gesamt ORR, DoR, disease control rate, PFS, OS und Sicherheit analysiert. Zudem wurden vordefinierte Subgruppen mit symptomatischen, steroidbehandelten und asymptomatischen Hirnmetastasen separat analysiert.
Es wurden insgesamt 65 Patienten aufgenommen (median 55 Jahre, 63% Männer): 37% erhielten Steroide und/oder waren symptomatisch und 49% hatten eine erhöhte LDH. Der mediane Follow-up für alle betrug 9.7 Monate.
Die intrakraniale ORR betrug 42% durch die IRC und 51% durch die Studienleiter selber. DoR und PFS sind in der Tabelle aufgeführt.
Patienten unter Steroiden oder mit Symptomen zeigten eine ORR von 58%, DoR von 10.2 Monaten und die PFS betrug 7.2 Monate. In asymptomatischen Patienten betrug die ORR 46%, DoR 5.7 Monate und das PFS 5.5 Monate.
Von 60 Patienten, welche A + C + V erhielten, wurden Grad 3-4 AEs in 70% der Patienten dokumentiert: vor allem erhöhte Lipase (27%) und erhöhte CPK (17%) sowie «Serious AEs» (30%). Ein Therapieabbruch erfolgte in 27%.
Zusammenfassend weisen diese Daten darauf hin, dass durch die Zugabe von Atezolizumab zu C + V eine verstärkte klinisch relevante intrakranielle Wirkung in dieser sehr schwierigen Population erwartet werden darf, insbesondere bei symptomatischen und Steroiden behandelten Melanompatienten mit Hirnmetastasen und dass auf dieser Grundlage weiterführende randomisierte Studien notwendig sind.
ThC
Abstrac t9515 Atezolizumab (A), cobimetinib (C), and vemurafenib (V) in patients (pts)
with BRAFV600 mutation–positive melanoma with central nervous system (CNS)
mestastases(mets): primary results from a phase 2 Tricotel study.