- CAR-T-Zelltherapie – eine neue Behandlungsoption
Die Mehrzahl der Rückfälle beim diffusen grosszelligen B-Zell Lymphom (DLBCL) treten in den ersten 5 Jahren auf. Die Standardbehandlung besteht in einer Salvage- und einer konsolidierenden Hochdosis-Chemotherapie mit klar kurativem Ziel. Die Prognose ist bei einem Frührezidiv bzw. refraktärer Situation, und vor allem wenn eine Hochdosis-Therapie nicht durchgeführt werden kann, wesentlich ungünstiger. Die Chimeric Antigen Receptor (CAR) T-Zell Therapie stellt für diese PatientInnen eine Behandlungsoption dar, die in den USA seit Oktober 2017, und am 22.10.2018 auch in der Schweiz zugelassen ist. Diese Therapie ist in jeder Hinsicht und für alle Beteiligten Neuland.
La majorité des rechutes dans le lymphome diffus à grandes cellules B (DLBCL) se produisent au cours des 5 premières années. Le traitement standard consiste dans une thérapie de sauvetage et d’ une chimiothérapie à forte dose dans un but curatif clair. Le pronostic est nettement moins favorable en cas de récidive précoce ou de situation réfractaire, en particulier si le traitement à forte dose ne peut être effectué. Le traitement par les cellules CAR-T (chimeric antigen receptor T cells) est une option thérapeutique pour ces patients qui a été approuvée aux Etats-Unis depuis octobre 2017 et en Suisse depuis le 22 octobre 2018. Cette thérapie est un territoire inexploré à tous les égards et pour toutes les personnes concernées.
Therapie des DLBCL – derzeitige Erfolge und Grenzen
Das diffuse grosszellige B-Zell-Lymphom (DLBCL) ist eines der häufigsten Lymphome. Phänotypisch, genetisch und klinisch handelt es sich um eine sehr heterogene Erkrankung. Mit der Standardchemotherapie CHOP in Kombination mit dem CD20-Antikörper Rituximab wurde bei über 60-Jährigen nach 10 Jahren ein Gesamtüberleben von 44% und ein progressionsfreies Überleben von 37% erreicht (1). Diverse Versuche zur Verbesserung der Resultate der Erstbehandlung sind, auch bei jüngeren PatientInnen, bisher leider gescheitert. 87% der Rezidive treten in den ersten 3 Jahren auf (1). Fitten PatientInnen mit Rückfällen muss eine Salvage- und eine konsolidierende Hochdosis-Chemotherapie mit autologer Stammzell-Transplantation angeboten werden, was bei einem 3-Jahresgesamtüberleben von 50-70% klar kuratives Potential hat (2, 3). In der Population der über 60-Jährigen werden allerdings 70% innerhalb der ersten 2 Jahre versterben (1). Bei einem Frührezidiv bzw. refraktärer Situation ist die Prognose mit einem medianen Gesamtüberleben von 14.4 Monaten auch bei jungen PatientInnen ebenfalls ungünstig, und mit 5.1 Monaten noch eingeschränkter, sofern eine Hochdosis-Chemotherapie nicht durchgeführt werden kann (4). Standardtherapien bei Rezidiven nach autologer bzw. allogener Transplantation sind beschränkt bzw. fehlten bisher. Für diese PatientInnen sind neue Optionen also sehr willkommen.
CAR-T-Zell Therapie
Prinzip: Die Behandlung basiert auf manipulierten körpereigenen Abwehrzellen (vgl. auch info@onkologie, 03_2017). T-Zellen beseitigen normalerweise Krankheitserreger und können im Prinzip auch Krebszellen abtöten. Letzteres funktioniert nicht zuverlässig, da z. B. die T-Zellen ohne Antigenpräsentation Tumorzellen nicht erkennen und damit nicht wirksam angreifen können. Bei der neuartigen Therapieform erhält die T-Zelle einen künstlichen Rezeptor, der sich aus dem körpereigenen T-Zell-Rezeptor und einem Antikörper (z. B. CD19) zusammensetzt. Durch die Manipulation erhalten T-Zellen des Patienten die Fähigkeit, Tumorzellen direkt und spezifisch zu erkennen und effizient abzutöten. Es handelt sich also im wahrsten Sinne um eine individuelle, d.h. auf den einzelnen Betroffenen zugeschnittene Therapie.
Ablauf: Zur Herstellung von CAR-T-Zellen müssen dem Patienten T-Zellen entnommen werden. Dieser als Leukapherese bezeichnete ambulante Schritt erfolgt ohne spezielle Vorbereitung und aus dem peripheren Blut. Die Umprogrammierung erfolgt im Labor mit Hilfe eines viralen Vektors und umfasst auch eine Vermehrung der gentechnisch veränderten Abwehrzellen. Die Produktion dauert 2 bis 3 Wochen. Zur besseren Wirkung und längeren Verbleibedauer der CAR-T-Zellen werden die unmanipulierten Lymphozyten der Patienten mit einer Lymphozyten-depletierenden Chemotherapie (Fludarabin und Cyclophosphamid) entfernt, die Rückgabe der CAR-T-Zellen erfolgt 2 bis 7 Tage später. Je nach Zustand wird zusammen mit der Nachbeobachtungsphase von 10-14 Tagen die Behandlung eine Hospitalisationsdauer 2 bis 3 Wochen erfordern. Zudem wird gefordert, dass der Patient nach Austritt in den ersten 30 Tagen nach der Infusion das Behandlungszentrum je nach Produkt innert 60-120 Minuten erreichen kann. Wegen der möglichen, verzögerten Neurotoxizität muss der Patient während dieser Zeit auch auf das Autofahren verzichten.
Wirksamheit bei Lymphomen
Nach den ersten positiven Erfahrungen mit anti-CD19 CAR-T-Zellen bei der akuten, lymphatischen Leukämie < 26 Jahren wurde die Entwicklung bei Erwachsenen mit Rezidiven oder refraktären aggressiven Lymphomen weitergeführt. Dies hat im Oktober 2017 in den USA und im August 2018 auch zur Zulassung der zwei ersten kommerziellen Produkte durch die EMA geführt. Grundlage dazu waren die Resultate der ZUMA-1 und JULIET-Studien (5). In der Schweiz ist seit dem 22.10.2018 Kymriah® in der gleichen Indikation sowie für die akute lymphatische Leukämie bei Kindern und jungen Erwachsenen zugelassen (Tab. 1).
In ZUMA-1 mit dem von Gilead aufgekauften Produkt Axicabtagene ciloleucel (Yescarta®) wurden in den USA und Israel 111 Patienten eingeschlossen; 109 erhielten das Produkt, das mit einem Median von 17 Tagen vergleichsweise rasch zur Verfügung stand. Yescarta® wird ungefroren geliefert. Bei mehrfach vorbehandelten Patienten mit aggressiven Lymphomen (inkl. primär mediastinalen Lymphomen) liess sich eine Gesamtansprechrate von 82% (komplett in 54%) erreichen, welche nach einer medianen Nachbeobachtungszeit von 15.4 Monaten in 42% anhielt. Die Gesamtüberlebensrate nach 18 Monaten betrug 52%.
Bei der JULIET-Studie wurde Tisagenlecleucel (Kymriah®) von Novartis verwendet. In der Zulassungsstudie wurden weltweit 165 Patienten eingeschlossen. Nur 111 (67%) erhielten schliesslich das aufgetaute Produkt nach 30 bis 96 Tagen, was durch Produktionsengpässe bedingt war, und teilweise überbrückende Therapien notwendig gemacht hat. Das Gesamtansprechen war 53% (komplett in 40%) und noch 37 bzw. 30% nach 6 Monaten. Wichtig war die Beobachtung, dass das Erreichen einer CR nach 3 Monaten mit Langzeitansprechen korreliert. Die mediane Ansprechdauer ist noch nicht erreicht.
Das dritte Konstrukt JCAR017 von Celgene wird in einem CD4/CD8-Verhältnis von 1:1 und in einer fixen Zieldosis von 1 x 108 T-Zellen verabreicht. Die Resultate der TRANSCEND-Studie von 140 amerikanischen Patienten, vorgestellt am ASH 2017, ergab bei einer vergleichsweise bisher kurzen Beobachtungszeit von 6.2 Monaten eine Ansprechrate von 74%, die in 52% komplett war und dann median 9.2 Monate anhielt. Die Wirksamkeit und Logistik zur Verabreichung von JCAR017 wird derzeit im Rahmen der JCAR017-BCM-001 Studie auch in 16 europäischen und 2 japanischen Zentren weiter untersucht (Abb. 1).
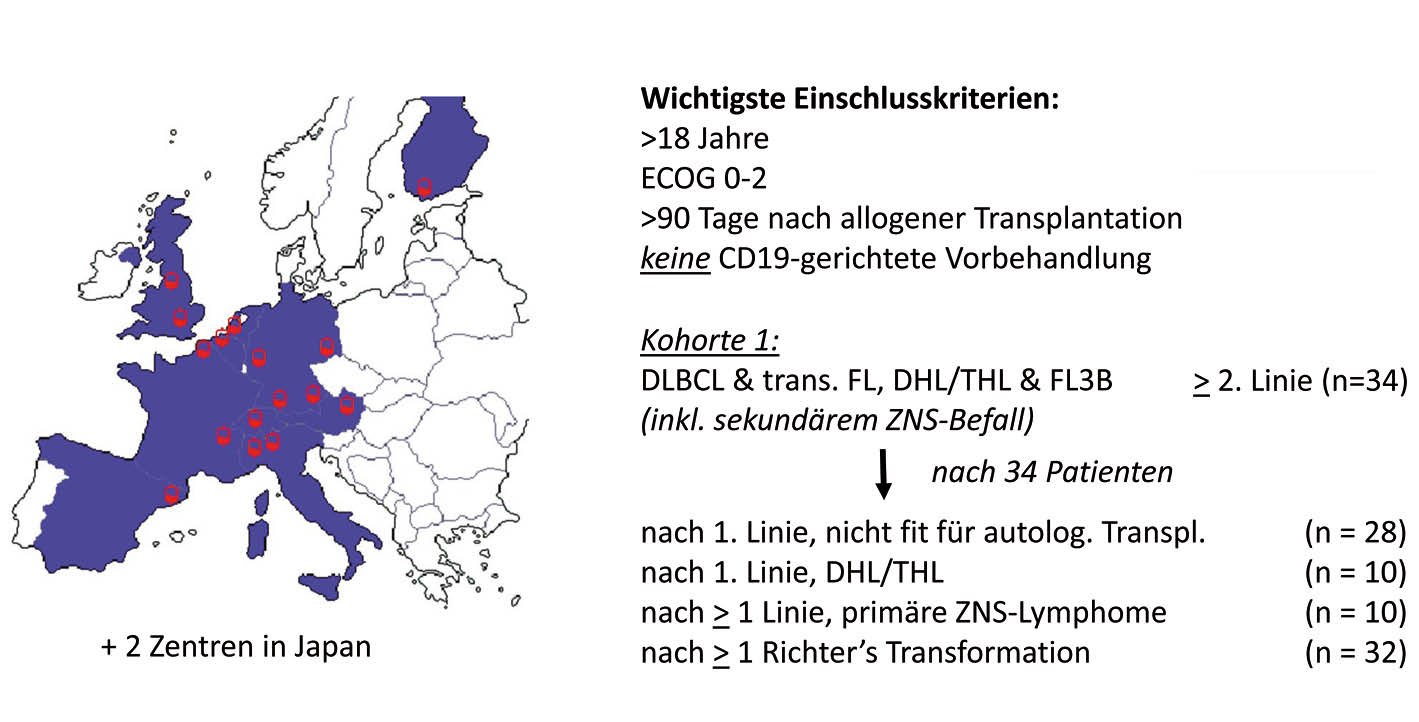
Die Studie rekrutiert zunächst in die Kohorte 1; das Inselspital ist eines der 16 Europäischen Zentren.
Nebenwirkungen
Die Wirkung von CAR-T-Zellen erklärt die häufigste Nebenwirkung: nach der Infusion sollen diese die Tumorzellen erkennen und via direkte Bindung zerstören. Dies führt zur Ausschüttung von Zytokinen, wodurch die Patienten nach median 3 (bis 10) Tagen nach der Infusion Fieber, Hypotonie und Hypoxämie entwickeln können. Diese Nebenwirkung verlief in einigen Fällen auch schwer und hat zum Tod einzelner Patienten geführt. Dieses sogenannte «cytokine-release syndrome» (CRS) erfordert daher eine engmaschige Überwachung, und supportive Massnahmen inkl. Gabe des anti-IL-6-Rezeptor-Antikörpers Tocilizumab und recht häufig intensivmedizinische Interventionen. In den Publikationen zu den drei Produkten wurde über Häufigkeiten zwischen 46 bis 93 % bzw. in höhergradigem Ausmass (mind. G3) 6 bis 23 % berichtet. Die Spannbreite ist zumindest teilweise durch unterschiedliche Definitionen und Klassifikationen, sowie durch unterschiedliche Richtlinien zur Verabreichung von Tocilizumab erklärt.
Die neurologischen Nebenwirkungen kennen wir von der Verwendung des bispezifischen CD3-CD19 Antikörpers Blinatumomab. Zu den ersten Anzeichen gehören Wortfindungs- und Aufmerksamkeitsstörungen bis hin zu Enzephalopathien mit Hirnödem und epileptischen Anfällen. Die Symptome treten meist nach dem CRS und auch verzögert auf, und können Stunden bis mehrere Tage andauern. Im Vergleich zur akuten, lymphatischen Leukämie tritt diese Nebenwirkung bei Lymphompatienten mit 12-31% seltener auf. Der zugrundeliegende Mechanismus wird derzeit nicht verstanden. Wie beim CRS erfordert das Management dieser glücklicherweise meist reversiblen Nebenwirkung ein speziell geschultes und zugeordnetes interdisziplinäres Behandlungsteam.
Neben den Medikamenten-spezifischen Nebenwirkungen können diese Patienten natürlich auch krankheitsbedingte Symptome oder persistierende Nebenwirkungen früherer Behandlungen und, wenn auch ältere Patienten diese Behandlung erhalten, auch durch Komorbiditäten bedingt sein. Von Zentren mit mehrjährigen Erfahrungen zu CAR-T-Zell-Therapien wird aber auch über wenig ereignisreiche Verläufe berichtet, so dass die Behandlung teilweise ambulant durchgeführt wurde. Individuell wird dies von den Indikationen, dem Zustand der Patienten und in Zukunft sicherlich auch vom wachsenden Erfahrungsschatz der Behandlungsteams abhängen.
Organisatorische Aspekte
Kymriah® ist seit dem 22. Oktober 2018 in der Schweiz zugelassen, die Mitteilung hat in der Presse ein grosses Echo ausgelöst. Im Vergleich zu anderen Medikamenten kann es trotzdem derzeit nicht einfach eingesetzt werden, da das Medikament stationär verabreicht wird bis mehr klinische Erfahrung vorhanden ist. Dies erfordert die Finanzierung der Therapie über das DRG System, die aktuell noch nicht verfügbar ist. Daher ist die zeitnahe Aufnahme in die Liste der Medikamente mit Zusatzentgelt zwingend. Letzteres ist von uns Anwendern zu fordern, da die erwarteten Medikamenten-Kosten von 370’ 755 CHF für das Spital systemrelevant sind und anders nicht zu finanzieren sind. Es ist zu hoffen, dass sich die involvierten Parteien der Gesamtverantwortung bewusst sind und durch Kompromisse rasch zu einer allgemeingültigen Lösung beitragen. Vielleicht könnte diese Therapie auch dazu dienen, das System der Zulassung neuer Medikamente resp. innovativer Technologien in der Schweiz prinzipiell zu überdenken.
Mit der Anwendung von «lebenden Medikamenten» inkl. dem Spektrum von Nebenwirkungen wird medizinisches Neuland betreten. Derzeit beschränken sich die klinischen Erfahrungen mit CAR-T-Zellen weltweit auf wenige Zentren. Nach der Vorstellung von Novartis soll Kymriah® in der Schweiz nach und nach an einer begrenzen Anzahl Krebszentren angewendet werden. Das Inselspital wurde als erstes Zentrum in der Schweiz für die Anwendung von Kymriah® zertifiziert. Ungewöhnlich ist auch die Tatsache, dass in absehbarer Zeit bis zu drei Medikamente für die praktisch gleiche Population zur Verfügung stehen werden. Neben Unterschieden in der Wirksamkeit oder Nebenwirkungen können in Zukunft z. B. auch logistische Aspekte entscheidend sein.
Zusammenfassung und Ausblick
Die drei Produkte sind in der Lage, bei ~1/3 von schwerkranken vorbehandelten Lymphompatienten komplette Remissionen zu erreichen, die auch länger andauern können.[6] Die publizierten Beobachtungszeiten übersteigen 2.5 Jahre nur in Einzelfällen, so dass gegenüber Heilsversprechen derzeit ein vernünftiges Mass an Skepsis entgegenzuhalten ist. Und doch ist die Wirksamkeit dieser zellulären Immuntherapie klar besser als alles, was wir bisher diesen Patienten anbieten konnten. Direkte Vergleiche mit der Hochdosis-Therapie, z. B. im Rahmen der ZUMA-7- (mit drei Zentren in der Schweiz) und der JCAR017-BCM-003-Studie, an welcher das Inselspital teilnehmen wird, könnten ggf. gar zur Ablösung der konventionellen Therapien bei Rezidiven führen. Zudem wird die Therapie bereits auch bei anderen CD19-exprimierenden Lymphomen (z. B. Mantelzell-Lymphom) untersucht.
Inselspital
Universitätsspital Bern
Universitätsklinik für Medizinische Onkologie
Loryhaus
3010 Bern
Inselspital
Universitätsspital Bern
Universitätsklinik für Medizinische Onkologie
Loryhaus
3010 Bern
Inselspital
Universitätsspital Bern
Universitätsklinik für Medizinische Onkologie
Loryhaus
3010 Bern
urban.novak@insel.ch
Celgene hat sich finanziell am klinischen Vorbereitungsaufenthalt am Memorial Sloan Kettering von Frau Dr. B. Jeker beteiligt. Novartis hat Dr. B. Jeker und PD Dr. U. Novak die Teilnahme an einem CAR-T-Cell Workshop in Köln ermöglicht. Prof. T. Pabst hat an Advisory Boards von Gilead, Celgene und Novartis teilgenommen.
- Mit CAR-T-Zellen lassen sich bei schwer kranken PatientInnen aggressive Lymphome bei bis zu 80% behandeln. Bei einer Krankheitskontrolle bis zum 3. Monat (40-70 %) hält der Effekt wahrscheinlich längerfristig an.
- Seit dem 22. Oktober 2018 ist mit Kymriah® die erste zelluläre Immuntherapie zur Behandlung von Rezidiven der akuten B-ALL bei Kindern und aggressiven mehrfach vorbehandelten Lymphomen zugelassen. Die Rahmenbedingungen für die Finanzierung sind derzeit noch unklar.
- Erst durch Langzeitdaten und vergleichende Studien werden wir den Stellenwert dieser neuartigen Behandlungsoption gegenüber den konventionellen Therapien und neuen Substanzen kennen.
Messages à retenir
- Les cellules CAR-T peuvent être utilisées pour traiter jusqu’ à 80 % des lymphomes agressifs chez les patients gravement malades. Avec un contrôle de la maladie jusqu’ au 3ème mois (40-70 %), l’ effet dure probablement plus longtemps.
- Kymriah®, la première immunothérapie cellulaire pour le traitement des rechutes de B-ALL aiguës chez l’ enfant et des lymphomes agressifs multitraités, est autorisé depuis le 22 octobre 2018. Les conditions-cadres pour le financement ne sont pas encore claires.
- Ce n’ est que grâce à des données à long terme et à des études comparatives que nous pourrons connaître l’ importance de cette nouvelle option thérapeutique par rapport aux thérapies conventionnelles et aux nouvelles substances.
1. Coiffier B et al. Long-term outcome of patients in the LNH-98.5 trial, the first randomized study comparing rituximab-CHOP to standard CHOP chemotherapy in DLBCL patients: a study by the Groupe d’ Etudes des Lymphomes de l’ Adulte. Blood 2010;116:2040-5
2. Gisselbrecht C et al. Salvage regimens with autologous transplantation for relapsed large B-cell lymphoma in the rituximab era. J Clin Oncol 2010;28:4184-90
3. Gilli S et al. BeEAM conditioning with bendamustine-replacing BCNU before autologous transplantation is safe and effective in lymphoma patients. Ann Hematol 2017;96:421-9
4. Crump M et al. Outcomes in refractory diffuse large B-cell lymphoma: results from the international SCHOLAR-1 study. Blood 2017;130:1800-8
5. Schuster SJ et al. Chimeric Antigen Receptor T Cells in Refractory B-Cell Lymphomas. N Engl J Med 2017;377:2545-54
6. Locke F et al. Durability of response in ZUMA-1, the pivotal phase 2 study of axicabtagene ciloleucel (Axi-Cel) in patients (Pts) with refractory large B-cell lymphoma. JCO 2018;26:suppl; abstr 3003
info@onco-suisse
- Vol. 9
- Ausgabe 1
- Februar 2019









