- ctDNA beim Kolonkarzinom – der Weg in die Klinik in der adjuvanten Situation
Beim Kolonkarzinom stellt sich insbesondere nach Resektion im Stadium II die Frage, ob eine adjuvante Chemotherapie zur Verbesserung des Überlebens notwendig ist. Im Stadium III ist die adjuvante Chemotherapie unbestritten, in den letzten Jahren wurde aber die Dauer der Therapie – 3 versus 6 Monate – ausgiebig untersucht und festgestellt, dass für sehr viele Situationen eine Dauer von 3 Monaten ausreicht. Bisher wurden klinische und pathologische Risikofaktoren zu Rate gezogen, ob im Stadium II eine adjuvante Therapie durchgeführt werden soll und ob im Stadium III doch eine 6-monatige Behandlung mit Oxaliplatin und Fluorouracil erfolgen muss. In diesem Feld ist die Bestimmung von zirkulierender Tumor-DNA ein wichtiger Baustein zur Rezidivrisiko-Abschätzung und scheint die Stratifizierung deutlich sicherer zu machen.
For Stage II Colon cancer there is lot of debate, whether adjuvant chemotherapy is really necessary after surgery to increase disease free or overall survival and for stage III there has been work done in deescalate duration of therapy from 6 to 3 months for many situations. Up to now decision making for or against adjuvant chemotherapy in stage II and whether to treat 6 or 3 months after surgery in stage III has been done using clinicopathological risk factors. In this field ctDNA becomes an important tool for better defining recurrence risks.
Keywords: Stage II Colon cancer, clinicopathological risk factors, ctDNA, recurrence risks
Risikostratifizierung durch Nachweis von ctDNA beim Kolonkarzinom
In den Stadien II und III des Kolonkarzinoms ist trotz erfolgreicher Chirurgie das 5-Jahresüberleben bei ca. 68-83% bzw. 45-65% und das Rezidivrisiko kann im Stadium II bei Vorliegen von Risikofaktoren mit einer 5FU-haltigen Therapie um ca. 3-5% und im Stadium III mit einer 5FU- und Oxaliplatin-haltigen Kombinations-Chemotherapie um ca. 15-20% gesenkt werden (1). Insbesondere im Stadium II, wo die Risikoreduktion gesamthaft recht gering scheint, ist die richtige Selektion der Patienten, welche eine adjuvante Chemotherapie erhalten, essenziell (2,3). Aber auch im Stadium III mag es Patienten geben, bei welchen evtl. keine oder eine weniger toxische Therapie ausreichend wäre. So wurde nämlich in einer Analyse von 12’834 Patienten im Stadium III, welche in der IDEA-Studie eingeschlossen waren, gesehen, dass das 5-Jahres krankheitsfreie Überleben stark variierte in den klinischen Gruppen mit tiefstem Risiko (T1N1a) mit 89% bis zu nur noch 31% mit höchstem klinischem Risiko (T4N2b), der Nutzen der adjuvanten Therapie war ebenso unterschiedlich gross. So ergab diese Analyse eine Verbesserung des krankheitsfreien Überlebens von 8% bei den Patienten mit niedrigem Risiko und bis zu 20% bei den Hochrisikosituationen (4).
Eine wichtige grössere Arbeit zur Frage bzgl. prädiktiver Aussage von postoperativem Nachweis von ctDNA nach Resektion von Stadium II Kolonkarzinomen ist die Studie von Tie et al., publiziert 2016 (5). In dieser Studie wurden 231 Patienten eingeschlossen, wobei bei 230 Patienten eine verwertbare somatische Mutation im Tumorgewebe gefunden wurde. Bei 20 dieser Patienten (8.7%) wurde in der Zeit 4-10 Wochen postoperativ diese tumor-spezifische Mutation im Plasma gefunden. 52 von diesen 230 Patienten wurden mit adjuvanter Chemotherapie behandelt und aus der Analyse ausgenommen, um die prognostische Aussage nicht zu verringern. Somit wurde schliesslich bei 14 von 178 analysierten Patienten (7.9%) zirkulierende Tumor-DNA gefunden. 92.1 % waren somit ctDNA negativ. Im medianen Beobachtungszeitraum von 27 Monaten hatten bei den positiv getesteten Patienten 78.6% ein radiologisch detektierbares Rezidiv und bei den negativ getesteten lediglich 9.8%. Das rezidiv-freie Überleben war somit bei den ctDNA positiven deutlich geringer mit einer Hazard-Ratio von 18.
In einer ergänzenden Analyse von derselben Autorin, publiziert im 2021 (6), wurden 3 Kohorten gepoolt, auch Stadium III Kolonkarzinome und eine Rektumkarzinomkohorte eingeschlossen.
Übereinstimmend mit dem höheren pathologischen Stadium waren auch mehr Patienten postoperativ ctDNA positiv, so wurde bei den Stadium II Patienten bei 8.7% und bei den Stadium III Patienten bei 21% ctDNA nach der Primäroperation nachgewiesen.
In den meisten Studien wird jeweils angegeben, ob ctDNA nachgewiesen wurde oder nicht, hier wurde noch die Abhängigkeit von der Höhe der nachgewiesenen Allelfrequenz der gesuchten Mutation berichtet, wobei auch hier bei höherer Allelfrequenz ein höheres Risiko für ein Tumorrezidiv gesehen werden konnte.
Die jüngste Publikation der GALAXY-Analyse, der Observationsarm der CIRCULATE-Japan, bestätigt und verfeinert die bisherigen Resultate. In dieser Studie wurden Stadien II bis resektable Stadium IV Patienten eingeschlossen, weiter auch Patienten mit Rektumkarzinom.
Das Ziel war, den bezüglich Rezidivrisiko prädiktiven Wert der postoperativ positiven ctDNA zu zeigen und auch die Auswirkung auf die adjuvante Chemotherapie zu analysieren (7).
Die Analyse der ctDNA erfolgte 4 und 12 Wochen postoperativ, 1039 Patienten wurden analysiert und 18% (187 Patienten) waren ctDNA positiv, 4 Wochen postoperativ. Patienten, welche innerhalb der 12 Wochen rezidivierten oder zum Zeitpunkt 12 Wochen postoperativ keine ctDNA-Analyse erhielten, wurden ausgeschlossen, dies, um die ctDNA-Dynamik korrekt analysieren zu können. Somit wurden schliesslich 838 Patienten in die Analyse eingeschlossen und es blieben 182 Patienten mit positivem Nachweis von ctDNA.
Für die ctDNA Analyse wurde eine Tumor-informed Methode mittels «whole-exome-sequencing» verwendet. Die am häufigsten verwendeten Gene waren TP53 und APC.
Nach einem Follow-up von gut 16 Monaten konnte folgendes gezeigt werden: Patienten, welche 4 Wochen postoperativ einen positiven ctDNA-Nachweis hatten, rezidivierten zu 61.4% im Gegensatz zu nur 9.5% der Patienten mit negativem ctDNA-Resultat zum gleichen Zeitpunkt, was einer Hazard-Ratio von 10 entspricht. Dieser Trend konnte für alle pathologischen Stadien gezeigt werden, wobei die Hazard-Ratio für die lokalisierteren Stadien höher war als für resezierte Stadien IV. Die Risikostratifizierung konnte mittels traditionellen klinikopathologischen Faktoren bezüglich krankheitsfreien Überlebens in den Stadien II-III in dieser Analyse nicht signifikant diskriminieren. Die Untersuchung des Nutzens der adjuvanten Therapie bei Hochrisiko Stadien II und Stadium III Patienten konnte einen signifikanten Nutzen zeigen bei Patienten, welche ctDNA positiv waren, bei Patienten, welche ctDNA negativ waren, war der Nutzen bzgl. krankheitsfreiem Überleben nicht signifikant. Ein weiterer Punkt, der gezeigt werden konnte, ist dass ctDNA-Clearance unter adjuvanter Chemotherapie prognostisch günstig ist, bzw. die fehlende Clearance definitiv prognostisch schlecht. Wichtig ist hier nochmals anzumerken, dass dies rein beobachtende Resultate sind und die Therapieentscheide jeweils auf klinischen und pathologischen Faktoren beruhten und dass der Follow-up mit 16 Monaten für krankheitsfreies Überleben von kurativ therapierten Kolonkarzinomen noch kurz ist.
Wichtig werden prospektive und randomisierte Studien, welche zur Deeskalation der adjuvanten Therapie für die prognostisch günstigen Situationen mit postoperativ fehlendem ctDNA-Nachweis führen können und Therapie-Eskalationsstrategien, um die ganz schlechte Situation der fehlenden ctDNA-Clearance trotz adjuvanter Chemotherapie zu verbessern.
Adjuvante Chemotherapie gesteuert nach Bestimmung von ctDNA
Die DYNAMIC-Studie, publiziert im NEJM 2022, hat sich die Frage gestellt, ob bei Stadium II Kolonkarzinomen nach Resektion und fehlendem Nachweis von ctDNA auf die adjuvante Chemotherapie verzichtet werden kann, ohne das Rezidivrisiko zu verschlechtern (8).
In dieser Studie wurden Patienten mit folgenden Tumorstadien eingeschlossen: T3 oder T4, N0 und M0. Das Studiendesign ist eine randomisierte Phase 2 Studie, es wurde 2:1 randomisiert in entweder ctDNA gesteuerte Therapieentscheidung versus Therapieentscheid analog den bekannten klinikopathologischen Risikofaktoren beim Stadium II (pT4, weniger als 12 Lymphknoten im Resektat, G3, LV1, Pn1, Ileus). ctDNA wurde mittels Tumor-informed Ansatz 4 und 7 Wochen postoperativ bestimmt. Die Resultate wurden den Behandlern 8 bis 10 Wochen postoperativ mitgeteilt. Wenn zu einem der Zeitpunkte ctDNA nachgewiesen wurde, wurde eine adjuvante Therapie durchgeführt, die Art und Weise war dem jeweiligen Kliniker überlassen. Waren bei beiden Zeitpunkten die ctDNA-Ergebnisse negativ, dann wurde keine Chemotherapie durchgeführt. Der primäre Endpunkt dieser Studie war das Rezidiv freie Überleben nach 2 Jahren. 459 Patienten wurden in diese Studie eingeschlossen, bei der Datenanalyse war der mittlere Follow-up 37 Monate. In der ctDNA-gesteuerten Therapiegruppe erhielten weniger Patienten eine adjuvante Therapie (15 versus 28%) und trotzdem blieb das krankheitsfreie Überleben in beiden Gruppen gleich. Patienten, welche einen positiven ctDNA Nachweis hatten, erhielten öfter eine Oxaliplatin-haltige adjuvante Chemotherapie als die Patienten im Standard-Strategiearm. Insbesondere die Stadium II Patienten mit niedrigem Rezidivrisiko hatten bei ctDNA-Negativität eine sehr gute Prognose mit einem Rezidiv freien Überleben von mehr als 96% nach 3 Jahren. Beim T4-Stadium bestand auch bei negativer ctDNA doch ein gewisses Rezidivrisiko, diese Subgruppen waren aber post hoc anaylsiert worden. Sicher konnte gezeigt werden, dass mit dieser ctDNA-gesteuerten Therapieentscheidung im Stadium II deutlich adjuvante Chemotherapie mit auch teils persistierender Langzeittoxizität wie Polyneuropathie, gespart werden kann. Insgesamt wurde hier die adjuvante Therapie eher spät nach Operation begonnen und dies wird auch für den klinischen Alltag dann wichtig sein für die Logistik der ctDNA- Analysen.
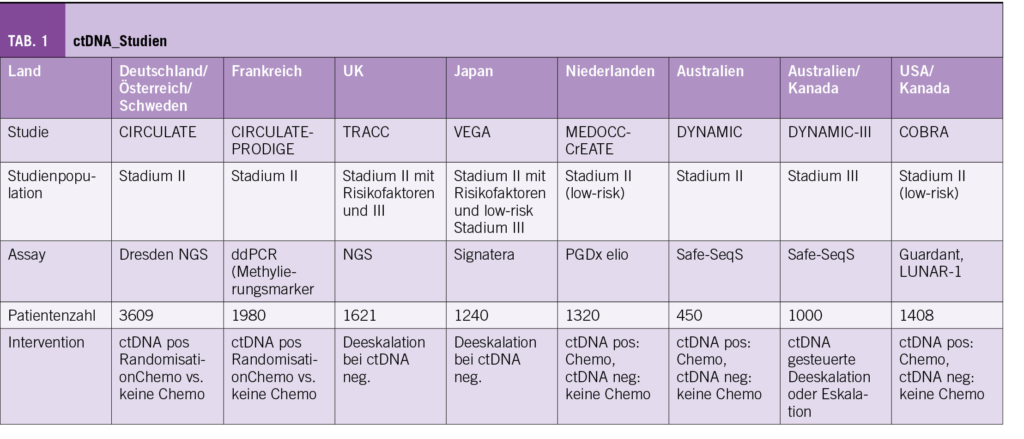
In vielen Ländern laufen derzeit Studien mit der Fragestellung bzgl. De-Eskalation aber teils auch mit der Frage nach Intensivierung der Behandlung gesteuert anhand von ctDNA-Analysen, teils im Stadium II, teils im Stadium III und teilweise auch kombiniert und auch Studien, welche Rektumkarzinompatienten einschliessen (Tab. 1).
Die Resultate der bisherigen Studien sind sehr ermutigend, dass mit dem Messen der ctDNA nach kurativ intendierter Resektion von Kolonkarzinomen für die Rezidivrisikobeurteilung ein starkes neues Werkzeug dazukommen wird. Vergessen darf man aber dabei nicht, dass in all diesen bisherigen Arbeiten auch ohne Nachweis von ctDNA ca. 10% der Patienten ein Rezidiv erlitten und dass auch nicht alle mit positiver ctDNA in den Beobachtungszeiträumen der Studien ein offensichtliches Rezidiv hatten.
Copyright bei Aerzteverlag medinfo AG
Klinik für Medizinische Onkologie und Hämatologie
Kantonsspital St. Gallen
Rorschacherstrasse 95
9007 St. Gallen
Der Autor hat keine Interessenskonflikt im Zusammenhang mit diesem Artikel deklariert.
◆ Für resezierte Kolonkarzinome konnte gezeigt werden, dass der Nachweis von ctDNA postoperativ prognostisch ungünstig ist
◆ Die DYNAMIC-Studie konnte erstmals in einem randomisierten Design zeigen, dass beim Stadium II (ausser pT4, post-hoc-Analyse) nach Resektion bei negativer ctDNA auf eine adjuvante Chemotherapie verzichtet werden kann bei gleichbleibendem Krankheitsfreiem Überleben.
◆ Weltweit laufen viele Studien mit Deeskalation- und teils auch Eskalationsstrategien gesteuert am Resultat von ctDNA-Analysen nach kurativer Operation eines Kolonkarzinoms.
1. Argilés G, Tabernero J, Labianca R, Hochhauser D, Salazar R, Iveson T, u. a. Localised colon cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. Oktober 2020;31(10):1291–305.
2. Benson AB, Hamilton SR. Path Toward Prognostication and Prediction: An Evolving Matrix. J Clin Oncol. 10. Dezember 2011;29(35):4599–601.
3. O’Connor ES, Greenblatt DY, LoConte NK, Gangnon RE, Liou JI, Heise CP, u. a. Adjuvant Chemotherapy for Stage II Colon Cancer With Poor Prognostic Features. J Clin Oncol. 1. September 2011;29(25):3381–8.
4. Sobrero, A. F. et al. A new prognostic and predictive tool for shared decision making in stage III colon cancer. Eur. J. Cancer 138, 182–188 (2020).
5. Tie J, Wang Y, Tomasetti C, Li L, Springer S, Kinde I, u. a. Circulating tumor DNA analysis detects minimal residual disease and predicts recurrence in patients with stage II colon cancer. Sci Transl Med [Internet]. 6. Juli 2016 [zitiert 18. Oktober 2023];8(346). Verfügbar unter: https://www.science.org/doi/10.1126/scitranslmed.aaf6219
6. Tie J, Cohen JD, Lo SN, Wang Y, Li L, Christie M, u. a. Prognostic significance of postsurgery circulating tumor DNA in nonmetastatic colorectal cancer: Individual patient pooled analysis of three cohort studies. Int J Cancer. 15. Februar 2021;148(4):1014–26.
7. Kotani D, Oki E, Nakamura Y, Yukami H, Mishima S, Bando H, u. a. Molecular residual disease and efficacy of adjuvant chemotherapy in patients with colorectal cancer. Nat Med. Januar 2023;29(1):127–34.
8. Tie J, Cohen JD, Lahouel K, Lo SN, Wang Y, Kosmider S, u. a. Circulating Tumor DNA Analysis Guiding Adjuvant Therapy in Stage II Colon Cancer. N Engl J Med. 16. Juni 2022;386(24):2261–72.
info@onco-suisse
- Vol. 14
- Ausgabe 1
- Februar 2024