- Ein essentielles Medikament der WHO
Rituximab, als 1997 weltweit erster zugelassener monoklonaler Antikörper der Onkologie, ist auch nach 20 Jahren ein Top-Blockbuster. Ein Rückblick zeigt, dass die Prognose der Lymphom Patienten sich durch Rituximab enorm verbessert hat und auch die erhöhte Heilungsrate bei Patienten mit aggressiven Formen von B-Zell Lymphomen sich langfristig bestätigt. Rituximab hat über die Onkologie hinaus neue Indikationen gefunden. Die Sicherheit von Rituximab ist gut und langfristig belastende Nebenwirkungen sind gering. Rituximab hat die 100 Mia $ Umsatzgrenze erreicht und zählt heute zu den essentiellen Medikamenten der WHO.
Le rituximab, le premier anticorps monoclonal approuvé au monde pour l’oncologie en 1997, est toujours un blockbuster de premier plan après 20 ans. Une revue montre que le pronostic des patients atteints d’un lymphome s’est considérablement amélioré avec le rituximab et que l’ augmentation du taux de guérison chez les patients atteints de formes agressives de lymphome à cellules B est confirmé à long terme. Le rituximab a trouvé de nouvelles indications au-delà de l’oncologie. La sûreté du rituximab est bonne et les effets indésirables à long terme sont faibles. Le rituximab a atteint la barre des 100 milliards de dollars et est maintenant l’un des médicaments essentiels de l’OMS.
The development and use of rituximab (Mabthera®) (R) has become one of the most successful chapters in the recent history of modern oncology hematology. R was the first monoclonal antibody ever approved by the FDA in 1997 for oncological therapy. Already in 1998 Swissmedic followed with the same indication approval. She focused on the treatment of pretreated follicular non-Hodgkin’s lymphoma expressing CD20.
R as chimeric mouse-human monoclonal antibody (mAb, IgG1kappa) of 1328 amino acids with a molecular weight of 144,544 daltons was developed by Lee Nadler, who also first described the antigen CD20, at the Dana-Farber Cancer Institute (1). CD20 is a glycosylated transmembrane phosphoprotein on the surface of mature B lymphocytes and is particularly strongly expressed in> 95% of B cell neoplasias. CD20 is not secreted or repelled by the cell surface and thus does not circulate in the blood. Also, no natural ligand for CD20 is known. The CD20 antigen is encoded in humans by the MS4A1 gene. Since neither the early B-progenitor cells nor the very mature B-cells express substantially CD20, hardly any long-term side effects are to be expected. Nadler and his team were also the first which documented as early as 1980 that a clinically demonstrable positive effect on the malignant B lymphocytes could be achieved with an antibody directed against CD20 (Ab 89). He also documented for the first time that a treatment-refractory patient with a “diffusely poorly differentiated lymphocytic lymphoma” also benefited temporarily clinically.
Wirkmechanismus
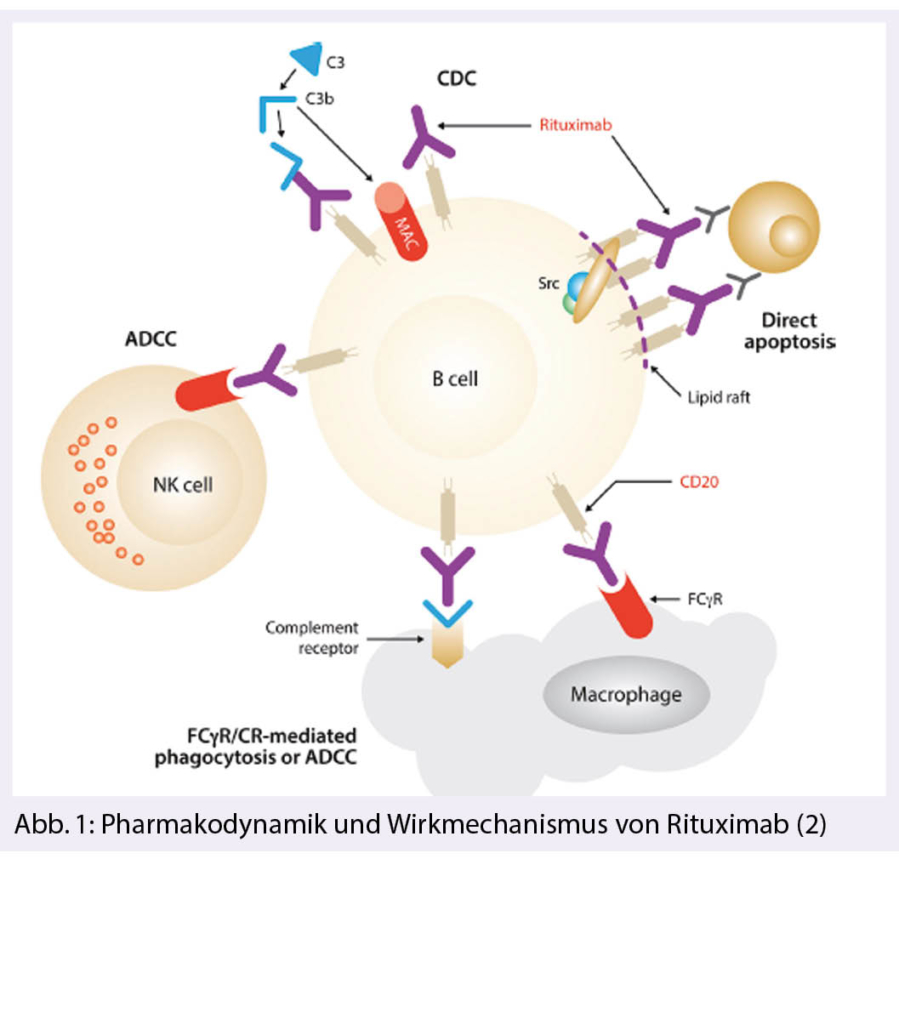
Bis heute wissen wir nicht abschliessend wie R seine klinische Wirkung entfaltet. Die meisten Daten zum Wirkmechanismus stammen aus in-vitro Versuchen. Die chimärische Natur von R hat den Vorteil gegenüber monoklonalen Maus-Antikörpern, dass die Immunogenizität stark reduziert ist und somit wiederholte Anwendungen ermöglicht werden und dass R humanes Komplement C1q binden kann und durch die Komplementfixation (CDC) und Antikörper vermittelte zelluläre Toxizität (ADCC) die Tumorzellen effizienter zerstören kann. Letztere wird heute als der wesentliche Wirkmechanismus von R betrachtet. Nach der Bindung von R an CD20 wird der Komplex in der Zellmembran nach innen verschoben als Cholestrol- und Sphingolipid-reiche sog. Lipid-rafts, welche in der intrazellulären Signalauslösung die wesentliche Rolle spielen Wir haben es somit mit einer komplexen Pharmakodynamik mit einem breiten Wirkspektrum zu tun und dies ist schematisch zusammenfassend in Abb. 1 dargestellt (2).
Eine direkte Dosis-Wirkungsbeziehung ist bekannt und der Entscheid die Dosis bei 375mg/m2 festzulegen war 1997 rein pragmatischer Natur. Zum Zeitpunkt der Erstzulassung war die Produktion von R für den Markt zu knapp und die Dosis wurde deshalb so gewählt, dass damit gerade eine gute klinische Aktivität beim follikulären NHL erzielt werden konnte, ohne dass die Dosis-Wirkungskurve optimal ausgelotet wurde. Es wurde zu Recht postuliert, dass je nach Tumor-Volumen und Expressionsstärke von CD20 die Dosis besser individuell angepasst sein sollte. Bis heute ist leider diese weitere Optimierung der besten individuellen Einzel-Dosis nicht weiterverfolgt worden und lediglich bei der ersten Dosis zur Behandlung von CLL Patienten mit 500mg/m2 wird die sonst generell übliche Dosis von 375mg/m2 überschritten. Es wird weiter postuliert, dass die in der Klinik beobachteten synergistischen Effekte mit den meisten bisher etablierten Zytostatika, neben den immunologischen Effekte von R, auch auf einer Sensibilisierung für die zytostatischen und zytotoxischen Effekte in Kombinationstherapien beruhen. Ein eigentlicher Rituximab-Resistenzmechanismus konnte bisher nicht nachgewiesen werden. Beim seltenen erworbenen Verlust von CD20 auf vorher sensiblen CD20+ Lymphomen ist die konsekutive klinische «Resistenz» eine logische unmittelbare Konsequenz. Inwieweit auch Komplement-Resistenz Proteine oder Fc-Rezeptor Polymorphismen für die Resistenzentwicklung eine Rolle spielen bleibt umstritten (3). Auch die Variation der Zusammensetzung der erwähnten Lipid-Rafts, welche bei malignen B-Zellen besonders häufig beobachtet wird und sehr dynamisch ist, wird als möglicher Mechanismus für eine R-Resistenz postuliert. Ein klinisch brauchbarer prädiktiver Bluttest, der mit dem Therapieerfolg von R zuverlässig korreliert, konnte bisher leider nicht identifiziert werden.
Produktion
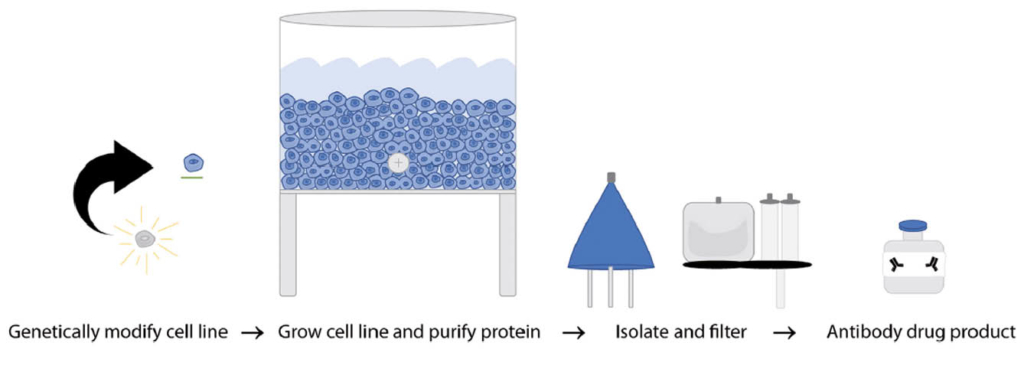
Rituximab wird industriel in grossen Mengen in Inkubationstanks aus Zellkulturen von genetisch modifizierten ovariellen Hamster-Zell-linien (OHC) hergestellt. Danach wird das Isolat in mehreren Schritten durch komplexe speziell dafür geeignete Filter weitestgehend gereinigt, um möglichst alle Fremd-Bestandteile zu entfernen (Abb. 2) (6). Es ist deshalb wichtig zu wissen, dass nie alle Chargen total identisch sein können und somit auch die Verträglichkeit variieren kann. In der Praxis hat sich jedoch die Zuverlässigkeit der Produkte mit diesem Herstellungsprozess bewährt und auch Lieferunterbrüche sind kein Problem mehr.
Sicherheit
Vor allem bei der Erstexposition mit Rituximab kommt es bei bis zu 50 % der Patienten zu teils ausgeprägten Nebenwirkungen durch ein Cytokin-release Syndrom mit Fieber, Schüttelfrost, Atembeschwerden und Exanthemen. Durch prophylaktische Massnahmen (Steroide, Antihistaminika und NSAR) lassen sich diese Nebenwirkungen reduzieren und im weiteren Verlauf der Behandlung bessern sich die Nebenwirkungen meist. Wenn vor und bei der Erstgabe die Kontraindikationen, die obligaten Sicherheitsmassnahmen sowie die notwendige Überwachung sorgfältig befolgt werden und eine übertriebene Hyperhydrierung vermieden wird kann bei den meisten Patienten die Therapie standardmässig weiter verabreicht werden. Viele initial geäusserten Befürchtungen wie anhaltende Immunsuppression, gehäufte schwere opportunistische Effekte und sekundäre Neoplasien sowie das häufige Auftreten von Anti-R- Antikörpern konnten bisher in keinem für diese Therapien und Krankheiten erwarteten Ausmass dokumentiert werden. Auch die Befürchtung, dass die häufig notwendigen konkommitierenden Steroidgaben die Wirkung von R neutralisieren könnte, wurde in klinischen Studien entkräftet. Das Auftreten eines Tumorlyse-Syndroms ist selten und meist beherrschbar, wenn die entsprechenden bekannten prophylaktischen und therapeutischen Massnahmen erfolgen. Noch unklar ist inwieweit eine progressive multifokale Leukoenzephalopathie (PML) als Folge einer R Therapie auftreten kann. Die PML ist eine schwerwiegende opportunistische Virusinfektion des Gehirns, die bei Patienten mit Immunschwäche durch das JC-Virus ausgelöst wird und oft tödlich verläuft. Vorsicht ist insbesondere auch geboten bei schwer immungeschwächten vorbehandelten Patienten die wegen Rheumatoider Arthritis, Granulomatose mit Polyangiitis und mikroskopischer Polyangiitis R erhalten.
Es kann heute gesagt werden, dass die Verträglichkeit und Sicherheit von R als Monotherapie und in Kombination in damit geübten Händen angesichts der ausgeprägten therapeutischen Wirkung als gut bezeichnet werden darf.
Therapie Resultate
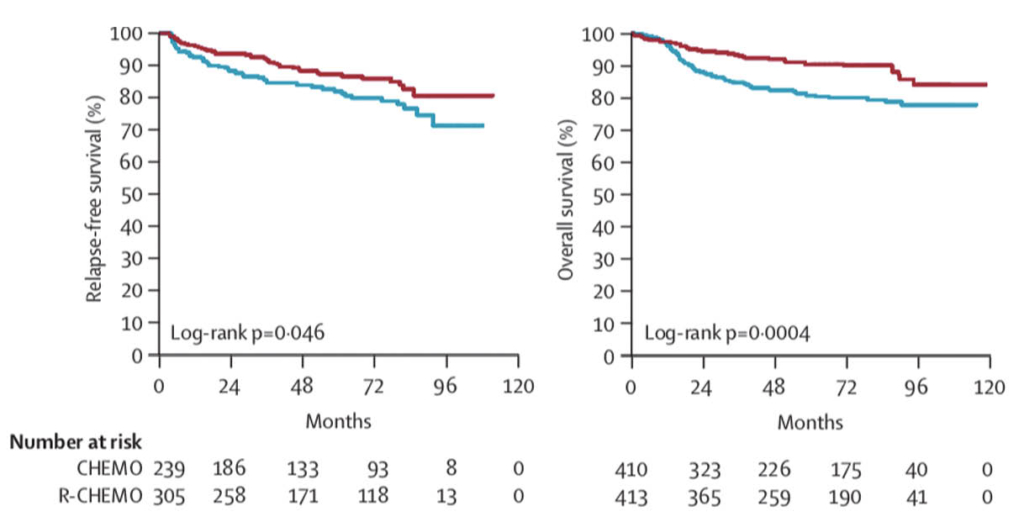
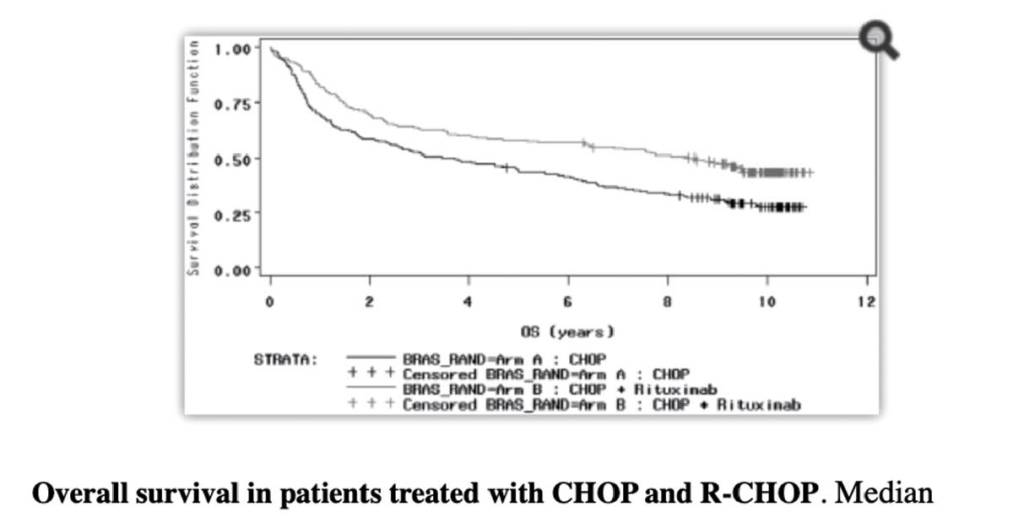
Das kurative Potential von R in Kombination mit Chemotherapie wie zb. R-CHOP ist ein Meilenstein der Onkologie für die Behandlung der Patienten mit aggressivem B-Zell Non-Hodgkin Lymphom. Bei Patienten mit fortgeschrittenem aggressivem Non-Hodgkin Lymphom aller Altersgruppen sind die Resultate eindrücklich und diese Therapie ist heute weltweit die Standardtherapie geworden. Die beiden ersten Landmark-Studien dazu für jüngere Patienten (MINT-Studie: (3). Figur 3) und ältere (GELA-Studie (4), Figur 4) wurden wiederholt publiziert nach längeren Beobachtungszeiten und belegen eindrücklich die deutlich erhöhte Heilungsrate durch die Zugabe von Rituximab zur bisherigen Chemotherapie.
Bei der Behandlung aller indolenten Lymphome ist R ebenfalls eine Standardtherapie, häufig in Kombination mit Chemotherapie aber auch als Monotherapie. Hier kommt die Erhaltungstherapie mit 2-3monatlichen Gaben von R-Infusionen nach einer erfolgreichen Induktionsphase während meist 2 Jahren zur Anwendung, um das PFS und die Zeit bis zur nächsten Behandlung deutlich hinauszuzögern. Die Gesamtprognose der Patienten hat sich damit deutlich um mehrere Jahre verbessert und zunehmend ist die Diagnose eines indolenten Lymphoms bei älteren Menschen nicht mehr Lebenszeit verkürzend. Da eine absolute R-Resistenz selten ist kommt R sowohl in der Primärtherapie wie auch in den Folgetherapien wiederholt zum Einsatz. Die nuklearmedizinische R-basierte Radioimmuntherapie mit Zevalin und Bexxar (USA) haben eine zwar etwas höhere CR-Rate als R allein gezeigt und waren ähnlich wirksam wie eine 6-8-monatige R-haltige Induktionstherapie. Sie haben sich aber letztlich auch aus logistischen Gründen nicht durchgesetzt.
Heute kann man vereinfachend sagen, dass fast alle Patienten mit CD20 positiven B-Zell Malignomen von einer R-haltigen Therapie klinisch wesentlich profitieren und dadurch die Prognose wie durch kein anderes Therapeutikum bisher wesentlich verbessert werden konnte (5). Als Konsequenz davon ist R auf der WHO-Liste der «Essential Medicines» gelandet und hat als erstes Medikament überhaupt die 100 Milliarden US $ Umsatzgrenze erreicht.
Rituximab und die nächsten 20 Jahre
In den letzten Jahren sind neue anti-CD20 Antikörper auf den Markt gekommen wie Ofatumumab mit einer anderen Bindungsstelle am CD20 als R und Obinutuzumab, modifiziert am Fc-Teil von R und einer zusätzlichen Gylcosylierung. Beide sind zudem voll humanisierte monoklonale Antikörper. Auch verschiedene Biosimilars haben die Zulassung erreicht und kämpfen um ihren Marktanteil. R ist zwischenzeitlich neu adaptiert auch für eine subkutane Applikation erhältlich. Weitere anti-CD20 monoklonale Antikörper wie Veltuzumab und Ocrelizumab sind unterwegs. Bispezifische Antikörper gegen CD20/CD3 zeigen ebenfalls wesentliche Aktivität. Trotzdem, R und seine Biosimilars dürften noch lange im Rennen bleiben wegen der weltweiten langfristigen Vertrautheit mit diesem Antikörper und den hervorragenden immer wieder bestätigten klinischen Daten. Auch in Kombinationstherapien gerade mit den neu zugelassenen hochwirksamen vorab oralen Medikamenten wird R noch lange der beste, da lange bewährte Partner bleiben.
Es sind immer noch offene Fragen zu beantworten wie zB die Optimierung der Einzel-Dosis, die Dauer der optimalen Erhaltungstherapien, die Frage nach einem prädiktiven Marker.
Aus heutiger Sicht würde man sich natürlich wünschen, dass wir schon vor 25 Jahren die Option gehabt hätten eine «tissue-agnostic» Zulassung zu erwirken. Dies hätte enorm viel Aufwand, Zeit und auch Leben sparen können, wenn die Indikation der Zulassung von R damals simpel «CD-20+ B-Zell-Lymphome» gelautet hätte.
Rosengartenstrasse 1d
9000 St. Gallen
thomas.cerny@kssg.ch
Der Autor hat keinen Interessenskonflikt im Zusammenhang mit diesem Beitrag deklariert.
- Rituximab, bzw die gegen CD20 gerichtete passive Immuntherapie bei Patienten mit B-Zell Lymphomen, kann nach 20 Jahren weltweiter Erfahrung als eine der erfolgreichsten Errungenschaften der modernen Onkologie betrachtet werden.
- Die Prognose der meisten Patienten wurde damit um Jahre verbessert und die Heilungsrate auch älterer Patienten mit aggressiven Lymphomen hat sich deutlich verbessert.
- Rituximab, seine Biosimilars und weitere CD20 gerichtete Therapien sind heute die Basis der modernen Lymphom-Therapie und werden vorab in Kombinationen auch in Zukunft unverzichtbar bleiben.
Messages à retenir
- Le rituximab, ou l’ immunothérapie passive dirigée contre le CD20 chez les patients atteints d’un lymphome à cellules B, peut être considéré comme l’ une des plus grandes réussites de l’oncologie moderne après 20 ans d’expérience mondiale.
- Le pronostic de la plupart des patients s’ est amélioré d’ années en années et le taux de guérison des patients âgés atteints de lymphomes agressifs s’est considérablement amélioré.
- Le rituximab, ses biosimilaires et d’ autres thérapies dirigées contre le CD20 sont aujourd’hui à la base de la thérapie moderne du lymphome et resteront indispensables en combinaison dans le futur.
1. Nadler LM et al. Serotherapy of a patient with a monoclonal antibody directed against a human lymphoma-associated antigen.Cancer Res. 1980;40:3147-54
2. Jaglowski SM et al. The clinical application of monoclonal antibodies in chronic lymphocytic leukemia.Blood. 2010;116:3705-14
3. Pfreundschuh M et al. CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial (MInT) Group Lancet Oncol. 2006 May;7(5):379-91.
4. Coiffier B et al Long-term outcome of patients in the LNH-98.5 trial, the first randomized trial comparing rituximab-CHOP to standard CHOP chemotherapy in DLBCL patients: a study by the Groupe d’Etudes des Lymphomes de l’Adult. Blood. 2010; 116: 2040-5.
5. Salles G et al. Rituximab in B-Cell Hematologic Malignancies: A Review of 20 Years of Clinical Experience. Adv Ther. 2017; 34: 2232-2273.
6. Pierpont TM et al. Past, Present, and Future of Rituximab-The World’s First Oncology Monoclonal Antibody Therapy. Front Oncol. 2018; 8: 163rd
info@onco-suisse
- Vol. 9
- Ausgabe 3
- Juni 2019