- Ein neuer Standard für die Behandlung des lokalisierten Prostatakarzinoms?
Prostatektomie und Strahlentherapie sind die beiden Interventionen, die bei Patienten mit behandlungsbedürftigem lokalisierten Prostatakarzinom am besten etabliert sind. Im Allgemeinen besteht ein breiter Konsens darüber, dass beide Modalitäten eine ähnliche Heilungschance bieten, aber aufgrund der unterschiedlichen Profile von Nebenwirkungen und Auswirkungen auf funktionelle Bereiche ihre spezifischen Vor- und Nachteile haben.
La prostatectomie et la radiothérapie sont les deux interventions les mieux établies chez les patients atteints d’un cancer de la prostate localisé qui ont besoin d’un traitement. En général, il existe un large consensus sur le fait que les deux modalités offrent une chance de guérison similaire, mais qu’elles présentent des avantages et des inconvénients spécifiques en raison des différents profils d’effets secondaires et d’implications fonctionnelles.
Einer der grössten Nachteile der klassischen externen Strahlentherapie ist die hohe Anzahl an Bestrahlungssitzungen, die benötigt werden, um eine vollständige Strahlentherapie durchzuführen. In der Regel dauert diese bis zu 2 Monaten. Um diesem Aufwand entgegenzutreten, wurden verkürzte Therapieschemata mit leicht erhöhten Einzeldosen evaluiert. Randomisierte Studien haben gezeigt, dass diese sogenannt moderat-hypofraktionierten Regimes mit 2,5 bis 3 Gy pro Fraktion in Bezug auf die biochemische Kontrolle und die Verträglichkeit den normofraktionierten Standard-Schemata nicht unterlegen sind (1, 2, 3).
Die stereotaktische Körperbestrahlung (Stereotacic Body Radiotherapy, SBRT) ist eine neuere Behandlungsoption, die dank präziseren Positionierungs-Technologien eine noch höhere Einzeldosis pro Fraktion, die sogenannte Ultra-Hypofraktionierung, ermöglicht. Die klinische Evidenz, die die Sicherheit und Wirksamkeit von ultrahypofraktionierter RT belegt, entwickelt sich mit der zunehmenden Verbreitung und Verfeinerung dieser Modalität. Der vorliegende Übersichtsartikel skizziert die radiobiologischen Aspekte, Wirksamkeit und die Toxi-zitätsergebnisse von SBRT anhand der aktuellen Studienlage.
Ultra-Hypofraktionierung; was bedeutet das?
Ultra-Hypofraktionierung wird häufig synonym mit stereotaktischer Körperbestrahlung (SBRT) und stereotaktisch ablativer Körperbestrahlung (SABR) verwendet, wobei sich der erstere Begriff strikt auf die Fraktionsgrösse bezieht, während sich letztere auch auf die Plattform der Strahlführung und Bestrahlungstechnik beziehen. Die Richtlinie der American Society for Radiation Oncology (ASTRO), der American Society of Clinical Oncology (ASCO) und der American Urological Association (AUA) zur Hypofraktionierung definiert die moderate Hypofraktionierung als 2,4-3,4 Gy/Tag und die ultrahypofraktionierte Strahlentherapie als Dosen pro Behandlung von 5,0 Gy/Tag oder höher (4). Eine Stellungnahme des Prostatakrebs-Expertengremiums der Deutschen Gesellschaft für Radioonkologie (DEGRO) und der Arbeitsgemeinschaft Radioonkologie der Deutschen Krebsgesellschaft (DKG-ARO) beschreibt Dosen zwischen 2,2-4 Gy/Fraktion als moderat und über 4 Gy/Fraktion für die Ultra-Hypofraktionierung (5).
Radiobiologische Aspekte – Warum funktioniert die Ultra-Hypofraktionierung?
Für die meisten Krebsarten sind die normofraktionierten Schemata von 1,8-2 Gy pro Tag / fünfmal pro Woche in Bezug auf Tumorkontrolle und Toxizität als Standard zu betrachten. Einige Tumore zeigen eine höhere Empfindlichkeit gegenüber Fraktionsdosen und können daher von hypofraktionierten Schemata profitieren. Diese Eigenschaft spiegelt sich in einem niedrigen Alpha/Beta-Wert (α/β) (6): Der Wert α/β ist ein Mass für die Fraktionierungsempfindlichkeit und steht in Zusammenhang mit der inhärenten Fähigkeit von Tumorzellen, subletale DNA-Schäden zu reparieren, die durch ionisierende Strahlung verursacht werden.
Der sehr niedrige α/β Wert des Prostatakarzinoms lässt auf eine hohe Empfindlichkeit gegenüber hohen Dosen pro Fraktion schliessen (7–10). Der α/β Wert des Prostatakarzinoms ist möglicherweise gar niedriger als das der umliegenden Risikoorgane, einschliesslich Rektum und Blase, wodurch die Hypofraktionierung das therapeutische Verhältnis weiter verbessern und ähnliche Wirksamkeitsraten bei gleicher oder geringerer Komplikationsrate als die konventionelle Fraktionierung liefern kann (8, 9, 10).
Wirksamkeit, Toxizität und Lebensqualität der Ultra-Hypofraktionierung – Was haben die klinischen Studien gezeigt?
Es gibt mehrere veröffentlichte Serien, die den Einsatz von SBRT untersuchen (Tab. 1). Die grösste Analyse ist eine Kohortenstudie, die individuelle Patientendaten aus 12 Phase-II-Studien analysierte, die 2142 Männer mit low risk (LR) und intermediate rsik (IR) Prostatakrebs umfassten, die entweder mit CyberKnife oder einem konventionellen Linearbeschleuniger behandelt wurden. Ca. 55,3% der Patienten hatten eine LR Erkrankung, 32,3% eine favourable IR-Erkrankung und 12,4% eine unfavourable IR-Erkrankung. High risk (HR)-Patienten wurden ausgeschlossen. Die Nachbeobachtungszeit betrug 6,9 Jahre (Median) (11). Das siebenjährige biochemische freie Überleben (bRFS) betrug 95,5% für die LR-Krankheit, 93.7% bei favourable IR und 86.5% bei unfavorable IR Patienten. Die Inzidenz von akuten toxischen Ereignissen Grad 3 oder höher betrug 0,60% für urogenitale (GU) und 0,09% für gastrointestinal (GI) Toxizitäten.
Die neueste Metaanalyse wurde von Jackson et al. durchgeführt, die 6116 Patienten aus 38 prospektiven Studien umfasste (12). Hier wurden nur Studien gepoolt, die zum gleichen Zeitpunkt den gleichen Endpunkt berichteten, was eine inhärente Einschränkung darstellt. Auf Patientenebene hatten 45% eine LR-, 47% eine IR- und 8% eine HR-Erkrankung. Die mittlere Nachbeobachtungszeit betrug 39 Monate, was bei der Bewertung der 5- und 7-Jahres bRFS-Raten und Toxizitäten berücksichtigt werden muss. Die kombinierte akute ≥ G3 Toxizität lag unter 1%. Die späte ≥ G3 GU- und GI-Toxizität betrug 2,0% bzw. 1,1% und änderte sich nicht, wenn nur Studien mit einer medianen FU von ≥5yr ausgewertet wurden. Interessanterweise gab es einen Zusammenhang zwischen Dosis und ≥ G3 GU-Toxizität, aber nicht mit ≥ G3 GI-Toxizität. Die Autoren kommen zu dem Schluss, dass die Ultra-Hypofraktionierung als strahlentherapeutische Standardstrategie für lokalisiertes Prostatakarzinom angesehen werden könnte – eine Aussage, die zwar für LR- und IR-Patienten ernstgenommen werden muss, aber für unterrepräsentierte HR-Patienten noch nicht validiert ist.
Neben den zahlreichen retro- und prospektiven Single-Arm Serien wurden 2 randomisierte Studien veröffentlicht. Der skandinavische non-inferiority design HYPO-RT-PC Trial randomisierte Männer mit IR und HR Prostatakarzinom, um entweder 42,7 Gy in sieben Fraktionen, 3 Tage pro Woche, oder konventionell fraktionierte Strahlentherapie (78 Gy in 39 Fraktionen, 5 Tage pro Woche) zu erhalten (18). Hier wurde keine anti-androgene Therapie (ADT) erlaubt. Nach einer medianen Nachbeobachtung von 5 Jahren war das failure-free Survival in beiden Armen identisch (84%).
Die akuten G2 oder höher GU Toxizitäten war im ultrahypofraktionierten Arm am Ende der Behandlung (28% vs. 23%) und bei der Nachbeobachtung nach einem Jahr (6% gegenüber 2%) leicht erhöht. Es gab keinen Unterschied in den akuten oder nach einem Jahr berichteten GI Toxizitäten. Nach 5 Jahren wurden keine Unterschiede in den GI und GU Toxizitäten berichtet.
Es ist erwähnenswert, dass neben dem einzigartigen Fraktionierungsschema (7 Fraktionen statt 5 Fraktionen) auch die Bestrahlungstechnik in dieser Studie nicht den höchsten Standards entsprach. Weder die Magnetresonanztomographie (MRT) zur Konturierung noch die Behandlung mittels intensitätsmodulierter Radiotherapie (IMRT) waren obligatorisch. Tatsächlich wurden 80% der Patienten mit konventioneller 3D-Planung behandelt.
Der neueste randomisierte PACE-B-Trial, der über die Toxizität der Ultra-Hypofraktionierung bei Prostatakrebs berichtet, wurde 2019 veröffentlicht (19). In diesem non-inferiority Trial erhielten Männer mit Prostatakrebs mit LR oder IR (nur Gleason 7a) entweder konventionelle oder moderate hypofraktionierte Strahlentherapie (78 Gy in 39 Fraktionen in 7-8 Wochen bzw. 62 Gy in 20 Fraktionen über 4 Wochen) oder SBRT (36,25 Gy in fünf Fraktionen über 1-2 Wochen). Eine zusätzliche Therapie mittels ADT wurde nicht erlaubt. Es wurden 41,7 % der Patienten im SBRT-Arm mit dem CyberKnife und 58,3% mit einem konventionellen Linearbeschleuniger mit volumetrischer Bogentherapie (VMAT) behandelt. Image-guided Radiotherapie (IGRT) und intrafraktionelle Bewegungskontrolle waren obligatorisch. Hinsichtlich der akuten Toxizität gab es keinen signifikanten Unterschied zwischen den Armen, aber einen leichten Trend zugunsten des SBRT-Arms (23% gegenüber 27%). Dies steht im Gegensatz zur HYPO-RT-PC Studie, bei der die akute Toxizität im ultrahypofraktionierten Arm etwas höher war.
Neben der perkutanen Bestrahlung wird beim Prostatakarzinom, insbesondere in der LR und IR Situation, häufig auch die Brachytherapie eingesetzt. Die SBRT wurde in einigen Publikationen auch mit diesem Strahlentherapieverfahren verglichen. Loblaw et al. veröffentlichten eine kanadische Studie mit 602 Patienten mit niedrigem Risiko, die eine überlegene bRFS mittels SBRT im Vergleich zur konventionellen Bestrahlung zeigte, während die bRFS zwischen SBRT und LDR (low dose rate) Brachytherapie ähnlich war (20). Eine weitere retrospektive multizentrische Analyse verglich die Ergebnisse von 437 Patienten mit mittlerem Risiko, die entweder SBRT oder HDR (high dose rate) Brachytherapie erhielten: es wurde eine bRFS von 96,3% ohne signifikanten Unterschied nach Behandlungsart berichtet (21). Gegenüber der Brachytherapie bietet die SBRT im Prinzip als nicht-invasive und ambulant durchführbare Methode praktische Vorteile mit vergleichbaren biochemischen Kontrollraten. Eine Toxizitätsanalyse im Direktvergleich steht noch aus.
Von der Lebensqualität nach einer ultrafraktionierten Strahlentherapie wurde ebenfalls in verschiedenen Publikationen berichtet und scheint in der gesamten Literatur konsistent zu sein mit einer anfänglichen Verschlechterung in den ersten Monaten im Harn- und Darmbereich, gefolgt von einer anschliessenden Erholung auf die Basislinie in den nächsten 3 bis 12 Monaten (18, 22, 23). Die sexuelle Funktion nahm in der Regel nach der SBRT ohne Erholung ab (22, 24).
Zahlreiche randomisierte Studien sind im Gange, die bald Licht auf Wirksamkeit und Toxizität von SBRT im Vergleich zur Chirurgie werfen werden. Dazu gehört die von Grossbritannien geführte internationale Studie PACE A, die Patienten aus Grossbritannien, Kanada und Irland einschliesst, und die SBRT mit der radikalen Prostatektomie vergleicht.
Technische Aspekte zur Planung und Durchführung der SBRT
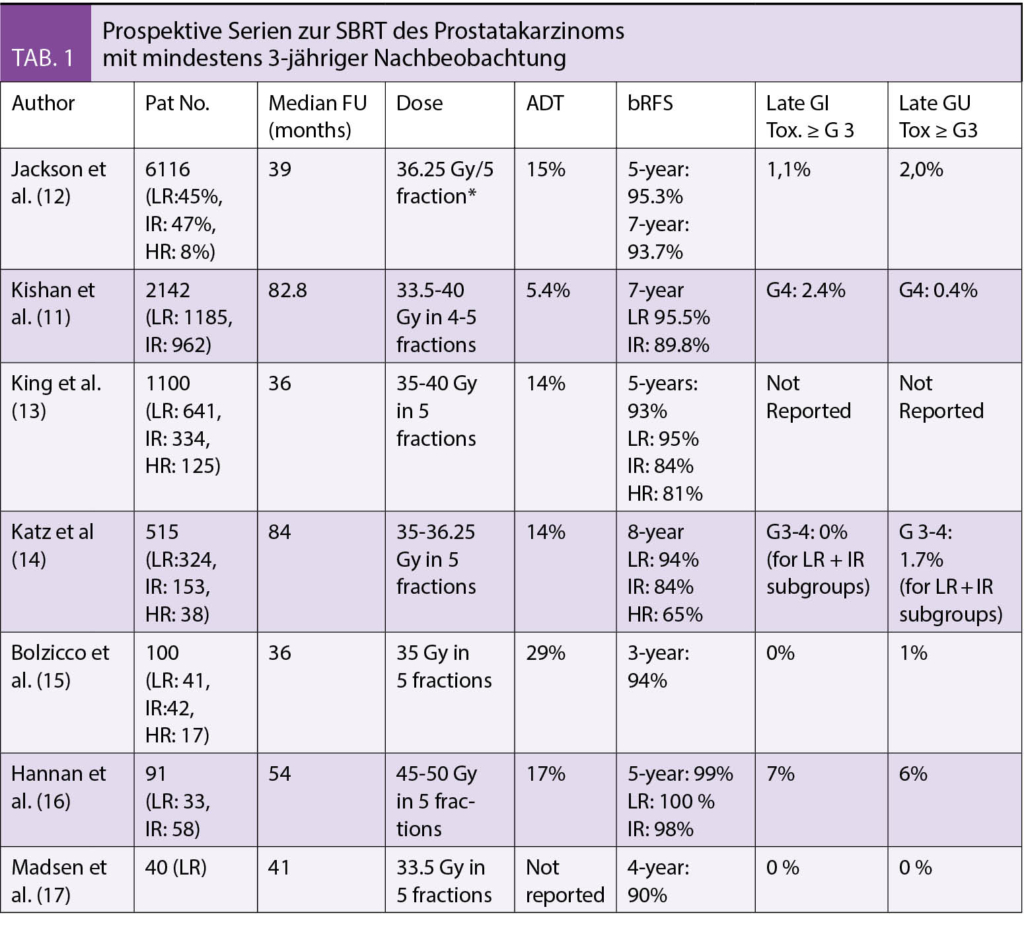
Die Definition des Zielvolumens ist für die Verwendung von SBRT entscheidend. Das Zielvolumen umfasst typischerweise die Prostata, mit oder ohne die proximalen Samenblasen und Bereiche mit extrakapsulärer Ausdehnung. Frühere Studien haben gezeigt, dass bei der Konturierung der Prostata eine signifikante Variation besteht, was die Notwendigkeit einer angemessenen Qualitätssicherung unterstreicht (25, 26). Zunehmend wird die Bildfusion von MRT-Sequenzen in die Praxis umgesetzt. Die Einbeziehung von MRT-Bildern reduziert die Variation zwischen den Beobachtern bei der Zielvolumendefinition im Vergleich zu reinen Computertomographie-Bildern.
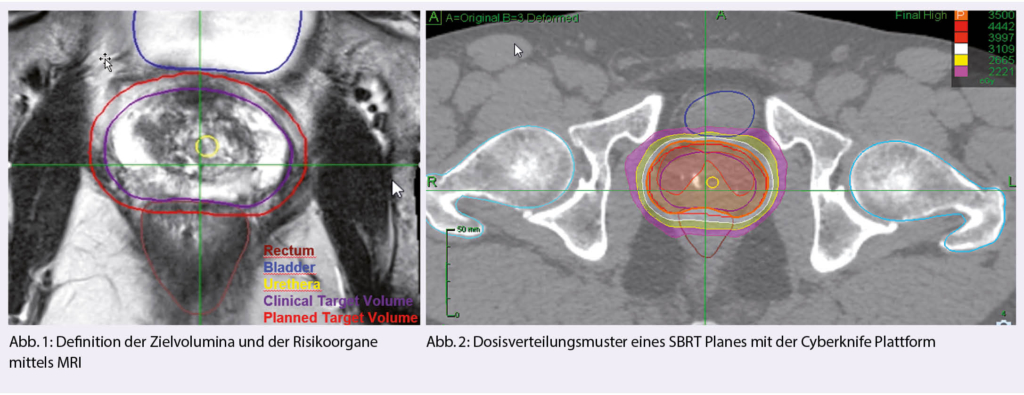
In der Mehrheit der bisherigen veröffentlichten Studien wurde das CyberKnife zur Durchführung von SBRT verwendet, in neueren Serien wurde auch von Gantry-basierten Linacs mit ähnlichem Outcome berichtet (27, 28). Die grösste technische Herausforderung bei der Anwendung von SBRT auf die Prostata ist das Management der Beweglichkeit der Prostata während der Bestrahlung. Bildleitsysteme sind der Schlüssel zu einer sicheren Verabreichung von SBRT (Realtime Motion Tracking Systeme).
Kosteneffizienz Analysen
Insgesamt deuten die obigen Ergebnisse darauf hin, dass die SBRT eine gleichermassen wirksame und sichere Behandlungsoption im Vergleich zu alternativen Strahlentherapie-Modalitäten für Patienten mit LR und IR Prostatakarzinom sind. Neben den praktischen Vorteilen der SBRT mit grösserer Patientenzufriedenheit und verbessertem Therapiezugang zeigen erste Analysen auch eine höhere Kosteneffizienz. Mit der Einschränkung, dass sich die lokalen Ergebnisse nicht ohne weiteres auf andere Länder übertragen lassen, quantifizieren eine Reihe von Studien aus verschiedenen Ländern den Kostenvorteil von SBRT (29).
Copyright bei Aerzteverlag medinfo AG
Universitätsklinik für Radio-Onkologie
Inselspital
Freiburgstrasse
3010 Bern
Mohamed.Shelan@insel.ch
Inselspital
Universitätsspital Bern
Universitätsklinik für Radio-Onkologie
Freiburgstrasse
3010 Bern
Die Autoren haben in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Mehrere prospektive Studien mit mittelfristigem Follow-up unterstützen die Verwendung von SBRT bei lokalisiertem Prostatakrebs mit niedrigem und mittlerem Risiko, wobei über hohe Raten der biochemischen Kontrolle und niedrige Raten der späten Toxizität berichtet wird.
- Die SBRT weist praktische und wirtschaftliche Vorteile gegenüber alternativen Modalitäten auf mit dem Potenzial für einen verbesserten Zugang zur Strahlentherapie und für relevante Kostensenkungen.
- Die Durchführung von SBRT verlangt höchste technische Standards im Bereich stereotaktischer Bestrahlung.
Messages à retenir
- Plusieurs études prospectives avec un suivi à moyen terme soutiennent l’ utilisation de la SBRT dans les cas de cancer de la prostate localisé à faible et moyen risque, avec des taux élevés de contrôle biochimique et de faibles taux de toxicité tardive signalés.
- La SBRT présente des avantages pratiques et économiques par rapport aux autres modalités, avec la possibilité d’ améliorer l’ accès à la radio-thérapie et de réduire les coûts correspondants.
- La performance de la SBRT exige les normes techniques les plus
élevées dans le domaine de l’ irradiation stéréotaxique.
1. Lee WR, Dignam JJ, Amin MB, et al. Randomized phase III noninferiority study comparing two radiotherapy fractionation schedules in patients with low-risk prostate cancer. J Clin Oncol. 2016;34(20):2325-2332. doi:10.1200/JCO.2016.67.0448
2. Dearnaley D, Syndikus I, Mossop H, et al. Conventional versus hypofractionated high-dose intensity-modulated radiotherapy for prostate cancer: 5-year outcomes of the randomised, non-inferiority, phase 3 CHHiP trial. Lancet Oncol. 2016;17(8):1047-1060. doi:10.1016/S1470-2045(16)30102-4
3. Catton CN, Lukka H, Gu CS, et al. Randomized trial of a hypofractionated radiation regimen for the treatment of localized prostate cancer. J Clin Oncol. 2017;35(17):1884-1890. doi:10.1200/JCO.2016.71.7397
4. Morgan SC, Hoffman K, Loblaw DA, et al. Hypofractionated Radiation Therapy for Localized Prostate Cancer: Executive Summary of an ASTRO, ASCO, and AUA Evidence-Based Guideline. Pract Radiat Oncol. 2018;8(6):354-360. doi:10.1016/j.prro.2018.08.002
5. Höcht S, Aebersold DM, Albrecht C, et al. Hypofraktionierte Radiotherapie des lokalisierten Prostatakarzinoms. Strahlentherapie und Onkol. 2017;193(1):1-12. doi:10.1007/s00066-016-1041-5
6. Marzi S, Saracino B, Petrongari MG, et al. Modeling of αβ for late rectal toxicity from a randomized phase II study: Conventional versus hypofractionated scheme for localized prostate cancer. J Exp Clin Cancer Res. 2009;28(1):1-8. doi:10.1186/1756-9966-28-117
7. Brenner DJ, Hall EJ. Fractionation and protraction for radiotherapy of prostate carcinoma. Int J Radiat Oncol Biol Phys. 1999;43(5):1095-1101. doi:10.1016/S0360-3016(98)00438-6
8. Daşu A. Is the α/β Value for Prostate Tumours Low Enough to be Safely Used in Clinical Trials? Clin Oncol. 2007;19(5):289-301. doi:10.1016/j.clon.2007.02.007
9. Gulliford S, Hall E, Dearnaley D. Hypofractionation trials and radiobiology of prostate cancer. Oncoscience. 2017;4(3-4):27-28. doi:10.18632/oncoscience.347
10. Dasu A, Toma-Dasu I. Prostate alpha/beta revisited an analysis of clinical results from 14 168 patients. Acta Oncol (Madr). 2012;51(8):963-974. doi:10.3109/0284186X.2012.719635
11. Kishan AU, Dang A, Katz AJ, et al. Long-term Outcomes of Stereotactic Body Radiotherapy for Low-Risk and Intermediate-Risk Prostate Cancer. 2020;2(2):1-13. doi:10.1001/jamanetworkopen.2018.8006
12. Jackson WC, Silva J, Hartman HE, et al. Stereotactic Body Radiation Therapy for Localized Prostate Cancer : A Systematic Review and Meta-Analysis of Over 6 , 000 Patients Treated On Prospective Studies. Radiat Oncol Biol. 2019;104(4):778-789. doi:10.1016/j.ijrobp.2019.03.051
13. King CR, Freeman D, Kaplan I, et al. Stereotactic body radiotherapy for localized prostate cancer: Pooled analysis from a multi-institutional consortium of prospective phase II trials. Radiother Oncol. 2013;109(2):217-221. doi:10.1016/j.radonc.2013.08.030
14. Katz A, Formenti SC, Kang J. Predicting biochemical disease-free survival after prostate stereotactic body radiotherapy: Risk-stratification and patterns of failure. Front Oncol. 2016;6(JUL):1-7. doi:10.3389/fonc.2016.00168
15. Bolzicco G, Favretto MS, Scremin E, Tambone C, Tasca A, Guglielmi R. Image-guided stereotactic body radiation therapy for clinically localized prostate cancer: Preliminary clinical results. Technol Cancer Res Treat. 2010;9(5):473-477. doi:10.1177/153303461000900505
16. Hannan R, Tumati V, Xie XJ, et al. Stereotactic body radiation therapy for low and intermediate risk prostate cancer – Results from a multi-institutional clinical trial. Eur J Cancer. 2016;59:142-151. doi:10.1016/j.ejca.2016.02.014
17. adsen BL, Hsi RA, Pham HT, Fowler JF, Esagui L, Corman J. Stereotactic hypofractionated accurate radiotherapy of the prostate (SHARP), 33.5 Gy in five fractions for localized disease: First clinical trial results. Int J Radiat Oncol Biol Phys. 2007;67(4):1099-1105. doi:10.1016/j.ijrobp.2006.10.050
18. Widmark A, Gunnlaugsson A, Beckman L, et al. Articles Ultra-hypofractionated versus conventionally fractionated radiotherapy for prostate cancer : 5-year outcomes of the HYPO-RT-PC randomised , non-inferiority , phase 3 trial. 2019;6736(19):1-11. doi:10.1016/S0140-6736(19)31131-6
19. Brand DH, Tree AC, Ostler P, et al. Intensity-modulated fractionated radiotherapy versus stereotactic body radiotherapy for prostate cancer (PACE-B): acute toxicity findings from an international, randomised, open-label, phase 3, non-inferiority trial. Lancet Oncol. 2019;20(11):1531-1543. doi:10.1016/S1470-2045(19)30569-8
20. Loblaw A, Pickles T, Crook J, et al. Stereotactic Ablative Radiotherapy Versus Low Dose Rate Brachytherapy or External Beam Radiotherapy: Propensity Score Matched Analyses of Canadian Data. Clin Oncol. 2017;29(3):161-170. doi:10.1016/j.clon.2016.10.001
21. Hegde J V., Collins SP, Fuller DB, et al. A Pooled Analysis of Biochemical Failure in Intermediate-risk Prostate Cancer Following Definitive Stereotactic Body Radiotherapy (SBRT) or High-Dose-Rate Brachytherapy (HDR-B) Monotherapy. Am J Clin Oncol Cancer Clin Trials. 2018;41(5):502-507. doi:10.1097/COC.0000000000000311
22. McBride SM, Wong DS, Dombrowski JJ, et al. Hypofractionated stereotactic body radiotherapy in low-risk prostate adenocarcinoma: Preliminary results of a multi-institutional phase 1 feasibility trial. Cancer. 2012;118(15):3681-3690. doi:10.1002/cncr.26699
23. Katz AJ, Kang J. Quality of life and toxicity after SBRT for organ-confined prostate cancer , a 7-year study. 2014;4(October):2-7. doi:10.3389/fonc.2014.00301
24. King CR, Collins S, Fuller D, et al. Health-Related Quality of Life After Stereotactic Body Radiation Therapy for Localized Prostate Cancer : Results From a Multi-institutional Consortium of Prospective Trials. Radiat Oncol Biol. 2013;87(5):939-945. doi:10.1016/j.ijrobp.2013.08.019
25. Nakamura K, Shioyama Y, Tokumaru S, et al. Variation of clinical target volume definition among japanese radiation oncologists in external beam radiotherapy for prostate cancer. Jpn J Clin Oncol. 2008;38(4):275-280. doi:10.1093/jjco/hyn014
26. Moeckli R, Jeanneret Sozzi W, Mirimanoff RO, et al. Physical considerations on discrepancies in target volume delineation. Z Med Phys. 2009;19(4):224-235. doi:10.1016/j.zemedi.2009.06.006
27. Mantz CA, Fernandez E. Real-Time Target Tracking Prostate SBRT and the Real-Time Tracking System 4D Localization System: 5-Year Quality of Life and Disease Outcomes. Int J Radiat Oncol. 2013;87(2):S393. doi:10.1016/j.ijrobp.2013.06.1030
28. Loblaw D, Sethukavalan P, Cheung P, et al. Comparison of Biochemical and Toxicity Outcomes From a Contemporaneous Cohort Study of Low-Risk Prostate Cancer Treated With Different Radiation Techniques. Int J Radiat Oncol. 2013;87(2):S26. doi:10.1016/j.ijrobp.2013.06.071
29. Lievens Y, Defourny N, Corral J, et al. How public health services pay for radiotherapy in Europe: an ESTRO–HERO analysis of reimbursement. Lancet Oncol. 2020;21(1):e42-e54. doi:10.1016/S1470-2045(19)30794-6
info@onco-suisse
- Vol. 10
- Ausgabe 5
- September 2020