- Elacestrant bei ER+, HER2– metastasierendem Brustkrebs mit ESR1-mutierten Tumoren:
Subgruppenanalysen aus der Phase III EMERALD-Studie nach vorheriger Dauer der endokrinen Therapie plus CDK4/6-Inhibitor
Patientinnen mit vorbehandeltem Östrogenrezeptor (ER)-positivem/humanem epidermalem Wachstumsfaktor-Rezeptor 2 (HER2)-negativem fortgeschrittenem Brustkrebs haben eine schlechte Prognose.
Elacestrant ist ein neuartiger, nichtsteroidaler, oraler SERD, der den Estrogenrezeptor (ER) alpha dosisabhängig abbaut und die Estradiol-abhängige ER-gesteuerte Gentranskription sowie das Tumorwachstum in präklinischen In-vitro- und In-vivo-Modellen hemmt, einschliesslich solcher, die ESR1-Mutationen aufweisen, die mit endokriner Resistenz verbunden sind (1–4).
Elacestrant zeigte in einer Phase-I-Studie mit stark vorbehandelten Patientinnen mit fortgeschrittenem ER+/HER2– Brustkrebs, einschliesslich Patientinnen mit ESR1-mutierten Tumoren, eine antitumorale Aktivität und gute Verträglichkeit (5). Die Phase III Studie EMERALD (6) zeigte, dass Elacestrant das progressionsfreie Überleben (PFS) signifikant verlängerte im Vergleich zur endokrinen Monotherapie (Standard-of-Care [SOC]) bei Östrogenrezeptor-positiven, HER2– metastasierten Brustkrebspatientinnen, die zuvor mit einer endokrinen Therapie plus einem CDK4/6-Inhibitor (ET+CDK4/6i) behandelt wurden und Östrogenrezeptor 1 (ESR1) – mutierte Tumoren hatten.
Eine kürzlich publizierte Studie (7) zeigte nun die Wirksamkeit und Sicherheit von Elacestrant im Vergleich zu SOC in klinischen Subgruppen, die vorgängig mit ET+CDK4/6 Inhibition während mehr als 12 Monaten behandelt worden waren. Dabei war Elacestrant in allen relevanten Subgruppen mit einem verlängerten PFS gegenüber SOC assoziiert, unabhängig von der metastatischen Lokalisation oder Anzahl, koexistierenden katalytischen PIK3-Untereinheit α oder Tumorprotein-p53-Genmutationen, HER2– niedrigen Expression oder ESR1-Mutationsvarianten. Eine vorgängige Therapie mit ET+CDK4/6 Inhibition während mehr als ≥ 12 Monate kann helfen bei der Identifizierung von Patienten mit ESR1-mutierten Tumoren, die endokrin empfindlich gegenüber Elacestrant sind, was eine ET-Sequenzierung in der zweiten Linie vor anderen zielgerichteten Therapien und Wirkstoffkombinationen ermöglicht und Chemotherapie-basierte Therapien, einschliesslich Antikörper-Wirkstoff-Konjugate hinauszuschieben möglich macht.
Patienten und Methoden
EMERALD war eine offene Phase-III- Studie, in der zufällig zugewiesene Patientinnen mit ER+, HER2– metastasierten Brustkrebs, die zuvor 1–2 Therapien erhalten hatten, obligatorisch CDK4/6i und ≤ 1 Chemotherapie mit Elacestrant (345 mg täglich) oder SOC (Aromatasehemmer oder Fulvestrant) behandelt wurden. Das PFS wurde über alle Subgruppen in explorativen Post-hoc-Analysen ohne Anpassung für mehrere Tests evaluiert.
Ergebnisse von EMERALD
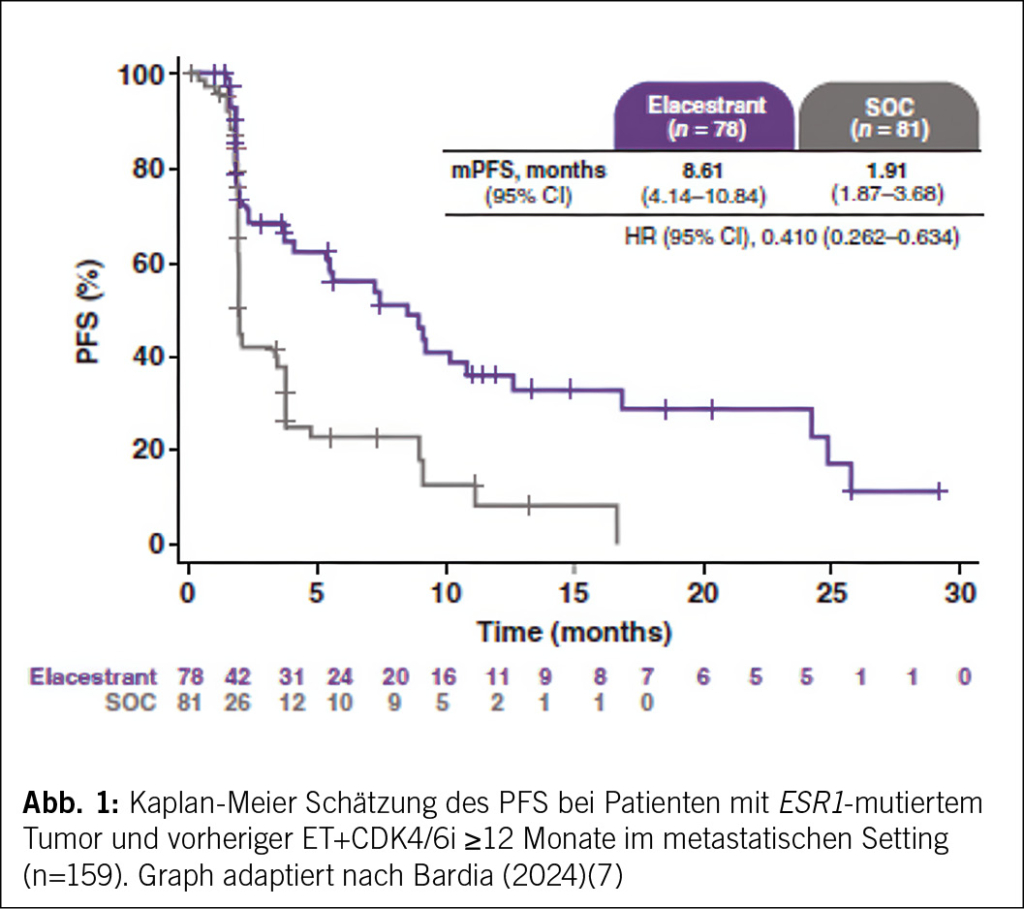
Bei Patientinnen mit ESR1-mutierten Tumoren und einer vorherigen Therapie mit ET+CDK4/6 Inhibitoren während 12 Monaten und mehr betrug das mediane PFS für Elacestrant vs. SOC 8.6 vs. 1.9 Monate (Abb. 1). Eine Verbesserung des PFS ging auch mit Elacestrant vs. SOC bei Patientinnen mit vorheriger ET+CDK4/6i-Therapie während ≥ 6 Monaten und während ≥ 18 Monaten einher. Elacestrant ging auch mit einem klinischen Nutzen in allen Subgruppen einher, wobei der klinische Nutzen bei Patientinnen, die ET+CDK4/6i während 12 Monaten oder länger erhielten, grösser war. In denjenigen Patientinnen, die Fulvestrant erhielten, lag das mediane PFS zwischen 1.9 bis 2.1 Monaten in den Subgruppen, die auf der Grundlage der vorherigen ET+CDK4/6i-Dauer bewertet wurden.
In allen untersuchten Subgruppen war eine klinisch bedeutsame Verbesserung des PFS mit Elacestrant im Vergleich zu SOC bei jenen Patientinnen mit ESR1-mutierten Tumoren assoziiert, die zuvor ET+CDK4/6i während 12 Monaten und mehr erhalten hatten, unabhängig vom Ort oder der Anzahl Metastasen, der Koexistenz von mutiertem PIK3CA, mutiertem TP53 oder low HER2–Expression oder der ESR1-Mutante.
Schlussfolgerung
Diese post-hoc-Analysen der explorativen Untergruppen deuten darauf hin, dass eine vorherige ET+CDK4/6i während 12 Monate und mehr mit einer klinisch bedeutsamen Verbesserung des progressionsfreien Überlebens mit Elacestrant im Vergleich mit endokriner SOC-Monotherapie bei Patientinnen mit ER+, HER2– metastasierendem Brustkrebs und ESR1-mutierten Tumoren ergibt. Der PFS-Vorteil mit Elacestrant war konsistent über klinisch relevante untersuchte Untergruppen, darunter Patienten mit Knochenmetastasen, Leber und/oder Lungenmetastasen, < 3 oder ≥ 3 metastasierenden Orten, PIK3CA-mutierten Tumoren, TP53-mutierten Tumoren, HER2–low Tumorexpression oder ESR1 Mutationsvarianten D538G oder Y537S/N.
Sicherheitsanalysen der Untergruppen haben gezeigt, dass Elacestrant ein handhabbares Sicherheitsprofil aufweist, das dem Profil in der Gesamtbevölkerung entspricht. Diese Daten unter stützen aktuelle Guidelines, die Routinetests für das Auftreten von ESR1-Mutationen in der ctDNA bei jedem Fortschreiten der Erkrankung empfehlen. Diese Resultate deuten darauf hin, dass Elacestrant eine ET Sequenzierung in der zweiten Linie erlauben, vor anderen zielgerichteten Therapien und Medikamentenkombinationen und dass Elacestrant Behandlungen mit Chemotherapie-basierten Regimes inklusive Medikamenten-Antikörperkonjugaten hinausschieben kann.
Quelle
Bardia A et al. Elacestrant in ER+, HER2− Metastatic Breast Cancer with ESR1-Mutated Tumors: Subgroup Analyses from the Phase III EMERALD Trial by Prior Duration of Endocrine Therapy plus CDK4/6 Inhibitor and in Clinical Subgroup. Clin Cancer Res 2024; 30:4299-4309.
riesen@medinfo-verlag.ch
1. Bihani T et al. Elacestrant (RAD1901), a selective estrogen receptor degrader (SERD), has antitumor activity in multiple ER+ breast cancer patient-derived xenograft models. Clin Cancer Res 2017; 23:4793-4804
2. Wardell SE et al. Evaluation of the pharmacological activities of RAD1901, a selective estrogen receptor degrader. Endocr Relat Cancer 2015; 22:713-724
3. Garner F et al. RAD1901: A novel, orally bioavailable selective estrogen receptor degrader that demonstrates antitumor activity in breast cancer xenograft models. Anticancer Drugs 2015 ; 26:948-956
4. Patel HK et al. Elacestrant (RAD1901) exhibits anti-tumor activity in multiple ER+ breast cancer models resistant to CDK4/6 inhibitors. Breast Cancer Res 2019 ; 21:146, 2019
5. Bardia A et al. Phase I study of elacestrant (RAD1901), a novel selective estrogen receptor degrader, in ER-Positive, HER2-negative advanced breast cancer. J Clin Oncol 39:1360-1370, 2021
6. Bidard FC et al. Elacestrant (oral selective estrogen receptor degrader) versus standard endocrine therapy for estrogen receptor–positive, human epidermal growth factor receptor 2–negative advanced breast cancer: Results from the randomized phase III EMERALD trial. J Clin Oncol 2022; 40: 3246–3256
7. Bardia A. et al. Elacestrant in ER+, HER2− Metastatic Breast Cancer with ESR1-Mutated Tumors: Subgroup Analyses from the Phase III EMERALD Trial by Prior Duration of Endocrine Therapy plus CDK4/6 Inhibitor and in Clinical Subgroup. Clin Cancer Res 2024; 30: 4299-4309
info@onco-suisse
- Vol. 14
- Ausgabe 8
- Dezember 2024






