- Entwicklung neuer Krebsmedikamente
Die bisherige Entwicklung neuer Therapien war dadurch gekennzeichnet, dass für eine bestimte Tumorentität ein neues Medikament gegen den bisherigen Standard verglichen wurde. Ein vertieftes molekularbiologisches Verständnis und die Erkenntnis, dass bestimmte genetische Veränderungen das Tumorwachstum antreiben, stellen diesen Grundsatz nun in Frage. Neue Medikamente werden basierend auf genetischen Veränderungen und unabhängig von der Tumorlokalisation – sogenannt tumoragnostisch – entwickelt.
Le développement précédent de nouvelles thérapies était caractérisé par le fait qu’ un nouveau médicament était comparé à l’ ancien standard pour une entité tumorale spécifique. Une meilleure compréhension de la biologie moléculaire et la reconnaissance du fait que certains changements génétiques sont à l’ origine de la croissance des tumeurs remettent maintenant ce principe en question. De nouveaux médicaments sont mis au point en fonction des modifications génétiques – et dans une approche dite agnostique – indépendamment de la localisation de la tumeur.
Die onkologische Therapie hat sich in den letzten Jahrzehnten stark verändert. Neben den herkömmlichen Chemotherapeutika wurden neue Medikamente entwickelt. Neuzulassungen von Medikamenten basierten in aller Regel auf randomisierten Phase III Studien, die eine Verbesserung des Gesamtüberlebens oder zumindest der progressionsfreien Zeit im Vergleich zur bisher bei dieser Tumorentität etablierten Standardtherapie zeigen mussten. Ein verbessertes molekularbiologisches Verständnis der Tumorentstehung und Tumorzellentwicklung mit Nachweis von spezifischen molekularen Veränderungen hat zur Entwicklung sogenannt zielgerichteter Medikamente geführt. Für zahlreiche Tumoren sind bestimmte somatische Genmutationen oder andere genetische Aberrationen bekannt, die für das Tumorwachstum verantwortlich sind (sogenannte «Treibermutationen»). Diese Treibermutationen können in Tumoren ausgehend von unterschiedlichen Ursprungsorganen auftreten. Diese Erkenntnis hat zur Entwicklung von zielgerichteten Medikamenten geführt. Solche Medikamente wirken entsprechend nur dann, wenn die entsprechende molekulare Veränderung in der Tumorzelle vorliegt. Solche spezifischen molekularen Veränderungen können innerhalb einer Tumorentität in unterschiedlicher Häufigkeit auftreten. Beim nicht-kleinzelligen Bronchialkarzinom (non-small cell lung cancer) beispielsweise liegt bei kaukasischen Patienten in rund 10-15% eine EGFR-Mutation vor (1). EGFR-TKIs wurden in randomisierten Phase III Studien gegen konventionelle Chemotherapie verglichen und zeigten in der Erstlinientherapie eine Verbesserung der progressionsfreien Zeit (2). Für die meisten Studien konnte kein Überlebensvorteil nachgewiesen werden, da ein grosser Teil der Patienten, die auf den Chemotherapie-Arm randomisiert wurden, später einen EGFR-TKI erhalten haben (sogenanntes «cross-over»). Dies ist dadurch begründet, dass schon vorgängig die hohe Aktivität von EGFR-TKIs gezeigt wurde und es daher unethisch gewesen wäre, den Patienten im Chemotherapie-Arm die nachgewiesenermassen aktive Therapie zu verwehren. Dieser Umstand führt jedoch dazu, dass es gelegentlich schwierig sein kann, Patienten für prospektiv randomisierte Studien zu rekrutieren, weil sowohl die behandelnden Ärzte als auch gut informierte Patienten eine hohe Erwartungshaltung an die neue Therapie haben. Dies wird insbesondere dadurch erschwert, wenn solche neuen Substanzen ausserhalb von Studien bereits verfügbar gemacht werden.
Basket-Studien für die Untersuchung zielgerichteter Therapien
Gewisse molekulare Veränderungen kommen in einigen Tumorentitäten nur sehr selten vor. Als Beispiel sei hier die BRAF-Mutation beim NSCLC genannt, welche bei rund 2% aller Patienten vorkommt (1). Beim metastasierten Melanom dahingegen sind diese Mutationen bei rund der Hälfte der Patienten zu finden. Nachdem gegen BRAF gerichtete Therapien beim Melanom etabliert wurden, stellte sich die Frage, ob sie auch beim NSCLC wirksam sind. Erste Hinweise zur Aktivität von BRAF-gerichteten Therapie beim NSCLC stammen aus Fallberichten (3, 4). Im weiteren Verlauf hat eine internationale retrospektive Kohortenstudie den Stellenwert von BRAF-gerichteten Therapien gezeigt (5). Auch in einer sogenannten Basket-Studie, in welcher 122 Patienten mit verschiedenen Tumorentitäten mit Vorliegen einer BRAF-Mutation eingeschlossen und mit dem BRAF-Inhibitor Vemurafenib behandelt wurden, zeigte sich bei 20 Patienten mit NSCLC eine vielversprechende Ansprechrate von 42% nach meist ausgiebiger chemotherapeutischer Vorbehandlung (6). Zur Zulassung von Dabrafenib und Trametinib führte die prospektive Phase II Studie BRF113928 mit insgesamt 93 Patienten. In Kohorte B wurden 57 Patienten nach Vorbehandlung mit Chemotherapie eingeschlossen (7) und in Kohorte C 36 therapie-naive Patienten (8). Dieses Beispiel zeigt bereits die Schwierigkeit der Etablierung neuer Therapien bei seltenen molekularen Subgruppen. Hier sind randomisierte Studien.
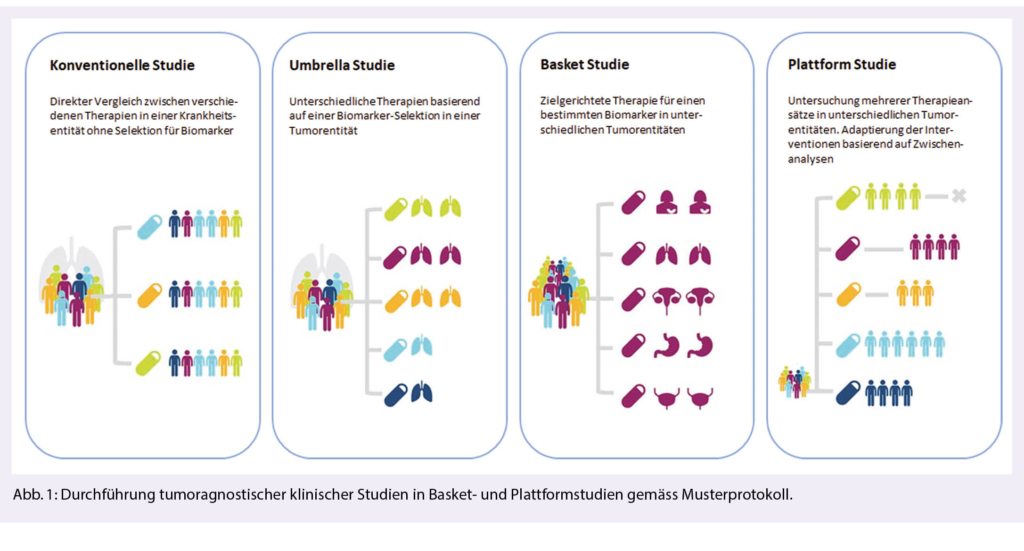
die traditionell die beste Evidenz liefern, aus vielerlei Hinsicht nicht durchführbar. Für solche Situationen werden häufiger sogenannte Basket-Studien durchgeführt, in welchen Patienten mit unterschiedlichen Tumorentitäten auf eine bestimmte molekulare Veränderung hin untersucht und bei Vorliegen derselben mit einer entsprechenden zielgerichteten Therapie behandelt werden. Dieser Ansatz wird auch als tumoragnostisch bezeichnet. Eine direkte Kontrollgruppe gibt es bei Basket-Studien nicht. Ihre hohe Aussagekraft erreichen sie durch das gezielte medikamentöse Ansteuern eines biologischen Mechanismus. Bis dato hat dieser Ansatz in der Schweiz noch nicht zu einer tumoragnostischen Zulassung von Medikamenten geführt. In den USA wurden in den letzten zwei Jahren durch die staatliche Zulassungsbehörde FDA erstmals neue Medikamente tumoragnostisch zugelassen. Auch die europäische Zulassungsbehörde EMA hat im Sommer diesen Jahres erstmals eine tumoragnostische Zulassung vorgenommen.
Tumoragnostische Studienprotokolle und Zulassungen neuer Medikamente
NTRK-Fusionen kommen bei rund 1% aller Tumoren vor (9). Am häufigsten zu finden sind sie bei Speicheldrüsenkarzinomen, bestimmten Weichteilsarkomen sowie beim infantilen Fibrosarkom. Zudem kommen sie bei einer Vielzahl weiterer solider Tumoren (u.a. Schilddrüsenkarzinom, NSCLC) vor. Basierend auf einer Phase I Studie (NCT02122913), einer Phase I/II bei Kindern (SCOUT, NCT02637687) sowie einer Phase II Basket-Studie für Patienten mit NTRK-Fusionen (NCT02576432) mit insgesamt 122 Patienten in allen drei Studien zusammen wurde der spezifische Inhibitor Larotrectinib in den USA und jüngst auch in Europa tumoragnostisch zugelassen (10-12). Die EMA hat eine bedingte Zulassung erteilt. Bedingte Zulassungen können erteilt werden, wenn ein hoher therapeutischer Bedarf vorliegt und die verfügbaren Daten zu einer günstigen Nutzen-Risiko-Abwägung führen. Die Zulassungsinhaber sind aufgefordert, weitere klinische Daten zu liefern, um dann später eine definitive Zulassung zu erreichen. Dies wird häufig über sogenannte Phase IV Studien erreicht. Ebenfalls durch die FDA zugelassen wurde Entrectinib, ein weiterer NTRK-Inhibitor, basierend auf der kombinierten Analyse der beiden Phase I Studien ALKA-372-001 und STARTRK-1 sowie der Phase II Studie STARTRK-2 (13, 14).
Eine weitere tumoragnostische Zulassung durch die FDA erfolgte für Pembrolizumab bei Patienten mit mikrosatelliteninstabilen (MSI-H) beziehungsweise Mismatch Repair defizienten (dMMR) Tumoren nach entsprechender Vorbehandlung und ohne etablierte Therapiealternativen. Erstmals konnte in einer Phase II Studie mit 10 Patienten mit dMMR kolorektalem Karzinom und 7 Patienten mit anderen Tumoren eine hohe Aktivität von Pembrolizumab bei Patienten mit dMMR-Tumoren gezeigt werden (15). In einer Expansion mit insgesamt 86 Patienten konnten diese Resultate bestätigt werden (16). In der Folge wurden zwei unabhängige Phase II Studien für Patienten mit MSI-H bzw. dMMR Tumoren initiiert, eine für Patienten mit kolorektalem Karzinom (KEYNOTE-164) (17) und eine für Patienten mit anderen soliden Tumoren (KEYNOTE-158) (18). In der zweiten Studie wurden 233 Patienten mit insgesamt 27 verschiedenen Tumoren eingeschlossen. Diese tumoragnostische Entwicklung von Pembrolizumab bei MSI-H/dMMR-Tumoren basiert auf einer biologischen Rationale, da diese Tumoren eine erhöhte Mutationslast und eine höhere Zahl von Neoantigenen tragen (19).
Tumoragnostischer Ansatz – ein Paradigmenwechsel mit Folgen
Die tumoragnostische Zulassung von neuen onkologischen Therapien bedeutet einen Paradigmenwechsel, da dadurch neue – durch Biomarker definierte – Krankheitsentitäten entstehen. Mit dieser tumoragnostischen Zulassung definiert neu das Vorhandensein eines bestimmten Biomarkers die Erkrankung nicht mehr das Ursprungsorgan. Auch schon früher wurden bestimmte Medikamente basierend auf einer Biomarkeranalyse zugelassen, jedoch stets für eine bestimmte Tumorentität. Für die zukünftige Entwicklung hat diese eine grosse Bedeutung. Wie bereits vorgängig diskutiert, ist die Durchführung von tumoragnostischen klinischen Studien schon seit längerem etabliert. Als Beispiel tumoragnostischer Studien wurden Basket-Studien erwähnt, es gehören aber auch sogenannte Plattform-Studien dazu, in welchen mehrere Studien in einem Masterprotokoll durchgeführt werden, als Beispiel hierzu sei die NCI-MATCH Studie erwähnt. Solche tumoragnostischen Studien können wichtige Resultate liefern, die dann in adaptierten Studien weiter untersucht werden und können gegebenenfalls in eine tumoragnostische Entwicklungsstrategie übergehen, in welcher dann neben weiteren klinischen Daten auch pharmakokinetische Daten und Medikamenteninteraktionen tumoragnostisch eingeschlossen werden. Die Durchführung solcher Studien mit adaptivem Studiendesign, bei welchem im Laufe der Studie basierend auf ersten Auswertungen Hypothesen verworfen und neue aufgestellt werden und diese dann die Weiterführung der Studie direkt beeinflussen, stellt ebenfalls grosse Herausforderungen an die Planer und Durchführer, aber auch an die Zulassungsbehörden, da viele der bisherigen Beurteilungskriterien ihre Gültigkeit verlieren. Diese Entwicklung bietet jedoch nicht nur Chancen, sondern bedarf auch einer kritischen Beurteilung. Es gilt, die Heterogenität und die unterschiedliche Biologie innerhalb einer Biomarker-definierten Gruppe von Tumoren zu berücksichtigen, was gegebenenfalls zusätzlicher Studien für bestimmte Tumorentitäten braucht. Hier können in Anbetracht der Seltenheit bestimmter Tumorentitäten und molekularer Veränderungen Daten aus Register- und Kohortenstudien von Bedeutung sein. In der Schweiz wird demnächst die SAKK 86/18 (ONCONAVIGATOR) Studie anlaufen. In diese Kohortenstudie können alle Patienten eingeschlossen werden, deren Tumor mittels moderner Sequenzierung (next-generation sequencing, NGS) analysiert wurde. Basierend auf der Sammlung von molekularen und klinischen Daten sollen durch artifizielle Intelligenz Behandlungsalgorithmen erstellt werden, die dann in einer nächsten Phase des Projekts prospektiv geprüft werden. Eine weitere Schwierigkeit tumoragnostischer Studien ist die Frage des klinischen Endpunktes. Progressionsfreie Zeit und Gesamtüberleben sind in solchen Studien aufgrund der Heterogenität und der damit verbundenen unterschiedlichen Prognose schwierig zu prüfen. Auch sollte man sich der Tatsache bewusst sein, dass eine rasche Zulassung basierend auf einem tumoragnostischen Ansatz gegebenenfalls die Weiterentwicklung, beispielsweise durch die Untersuchung von Therapiekombinationen bei bestimmten Tumorentitäten, verzögern oder verunmöglichen kann. Ein weiteres wichtiges Themengebiet bei der Entwicklung neuer zielgerichteter Therapieansätze ist die molekulare Testung. Wird ein Medikament aufgrund des Vorhandenseins eines bestimmten Biomarkers zugelassen, so muss die Detektion dieses Markers zuverlässig und reproduzierbar erfolgen können.
Zusammenfassend darf gesagt werden, dass ein verbessertes molekularbiologisches Verständnis der Tumorentstehung und -entwicklung zu einem Paradigmenwechsel in der klinischen onkologischen Forschung geführt hat. Die heutige Medikamentenentwicklung erfordert in vielen Fällen die Implementierung neuer Studiendesigns. Dies führt in vielen Fällen dazu, dass neue Medikamente schneller zu den Patienten kommen und damit deren Prognose verbessern können. Es gilt in dieser Entwicklung aber, kritische Punkte bei der Diagnostik, der Studienplanung und der Validierung von Studienergebnissen zu berücksichtigen.
Kantonsspital Baden
Zentrum für Onkologie & Hämatologie
Im Ergel 1
5404 Baden
sacha.rothschild@ksb.ch
Honorare für Advisory Boards von AstraZeneca, BMS, Boehringer-Ingelheim, Eisai, Eli-Lilly, Merck Serono, MSD, Novartis, Pfizer, Roche und Takeda (an die Institution). Forschungsgelder von AstraZeneca, Boehringer-Ingelheim, BMS, Eisai und Merck Serono.
- Ein verbessertes molekularbiologisches Verständnis der Tumorentstehung und -entwicklung hat zu einem Paradigmenwechsel in der klinischen onkologischen Forschung geführt
- Die Entwicklung zielgerichteter Therapien erfordert neue Studiendesigns, wie zum Beispiel Basket-Studien oder Plattform-Studien
- Die tumoragnostische Entwicklung neuer Medikamente bietet sich für zielgerichtete Therapien für gut validierte prädiktive Marker an
Messages à retenir
- Une meilleure compréhension de la biologie moléculaire de l’ apparition et du développement des tumeurs a conduit à un changement de paradigme dans la recherche clinique en oncologie.
- Le développement de thérapies ciblées nécessite de nouvelles conceptions d’ études, telles que des études de panier ou des études de plateforme.
- L’ approche dite agnostique du développement de nouveaux médicaments se prête à des thérapies ciblées pour des marqueurs prédictifs bien validés.
1 Barlesi F, Mazieres J, Merlio J-P, et al. Routine molecular profiling of patients with advanced non-small-cell lung cancer: results of a 1-year nationwide programme of the French Cooperative Thoracic Intergroup (IFCT). Lancet 2016; 387: 1415–26.
2 Hsu W-H, Yang JC-H, Mok TS, Loong HH. Overview of current systemic management of EGFR-mutant NSCLC. Ann Oncol Off J Eur Soc Med Oncol 2018; 29: i3–9.
3 Gautschi O, Pauli C, Strobel K, et al. A patient with BRAF V600E lung adenocarcinoma responding to vemurafenib. J Thorac Oncol 2012; 7: e23-4.
4 Peters S, Michielin O, Zimmermann S. Dramatic response induced by vemurafenib in a BRAF V600E-mutated lung adenocarcinoma. J Clin Oncol 2013; 31: e341-4.
5 Gautschi O, Milia J, Cabarrou B, et al. Targeted Therapy for Patients with BRAF-Mutant Lung Cancer: Results from the European EURAF Cohort. J Thorac Oncol 2015; 10: 1451–7.
6 Hyman DM, Puzanov I, Subbiah V, et al. Vemurafenib in Multiple Nonmelanoma Cancers with BRAF V600 Mutations. N Engl J Med 2015; 373: 726–36.
7 Planchard D, Besse B, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously treated BRAFV600E-mutant metastatic non-small cell lung cancer: an open-label, multicentre phase 2 trial. Lancet Oncol 2016; 17: 984–93.
8 Planchard D, Smit EF, Groen HJM, et al. Dabrafenib plus trametinib in patients with previously untreated BRAFV600E-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol 2017; 18: 1307–16.
9 Cocco E, Scaltriti M, Drilon A. NTRK fusion-positive cancers and TRK inhibitor therapy. Nat Rev Clin Oncol 2018; 15: 731–47.
10 Drilon A, Laetsch TW, Kummar S, et al. Efficacy of Larotrectinib in TRK Fusion–Positive Cancers in Adults and Children. N Engl J Med 2018; 378: 731–9.
11 Laetsch TW, DuBois SG, Mascarenhas L, et al. Larotrectinib for paediatric solid tumours harbouring NTRK gene fusions: phase 1 results from a multicentre, open-label, phase 1/2 study. Lancet Oncol 2018; 19: 705–14.
12 Lassen UN, Albert CM, Kummar S, et al. Larotrectinib efficacy and safety in TRK fusion cancer: an expanded clinical dataset showing consistency in an age and tumor agnostic approach. Annals of Oncology (2018) 29 (suppl_8): viii133-viii148. 10.1093/annonc/mdy279.
13 Drilon A, Siena S, Ou S-HI, et al. Safety and Antitumor Activity of the Multitargeted Pan-TRK, ROS1, and ALK Inhibitor Entrectinib: Combined Results from Two Phase I Trials (ALKA-372-001 and STARTRK-1). Cancer Discov 2017; 7: 400–9.
14 Paz-Ares L, Doebele RC, Farago AF, et al. Entrectinib in NTRK fusion-positive non-small cell lung cancer (NSCLC): integrated analysis of patients enrolled in STARTRK-2, STARTRK-1 and ALKA-372-001. Ann Oncol 2019;30 (suppl 2); abstract 113O
15 Le DT, Uram JN, Wang H, et al. PD-1 Blockade in Tumors with Mismatch-Repair Deficiency. N Engl J Med 2015; 372: 2509–20.
16 Le DT, Durham JN, Smith KN, et al. Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade. Science 2017; 357: 409–13.
17 Le DT, Kim TW, Van Cutsem E, et al. Phase II Open-Label Study of Pembrolizumab in Treatment-Refractory, Microsatellite Instability–High/Mismatch Repair–Deficient Metastatic Colorectal Cancer: KEYNOTE-164. J Clin Oncol 2019 Nov 14;JCO1902107.
18 Marabelle A, Le DT, Ascierto PA, et al. Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair–Deficient Cancer: Results From the Phase II KEYNOTE-158 Study. J Clin Oncol 2019; :Nov 4:JCO.19.02105.
19 Cancer Genome Atlas Network. Comprehensive molecular characterization of human colon and rectal cancer. Nature 2012; 487: 330–7.
info@onco-suisse
- Vol. 9
- Ausgabe 6
- Dezember 2019