- Entwicklungen in der Systemtherapie bei Tumoren des Kopf-Hals-Bereichs
Trotz intensiver multimodaler Therapie kommt es bei ca. 30% der Patienten mit lokal fortgeschrittenen Plattenepithelkarzinomen des Kopf-Hals-Bereichs (LAHNSCC) zu Lokalrezidiven oder Fernmetastasierung (r/m HNSCC). In einigen Fällen besteht die Möglichkeit, die Patienten mit einer Salvage-Operation oder Re-Bestrahlung nochmals in kurativer Intention zu behandeln. Die Mehrheit der Patienten befindet sich jedoch in einer Palliativsituation.
Malgré un traitement multimodal intensif, une récidive locale ou une métastase à distance (HNSCC r/m) survient chez environ 30% des patients atteints d’un carcinome épidermoïde de la tête et du cou (LAHNSCC) localement avancé. Dans certains cas, il est possible de traiter à nouveau les patients par une chirurgie de sauvetage ou une ré-irradiation à visée curative. Cependant, la majorité des patients sont en situation de soins palliatifs.
Die in 2008 publizierte «Extreme» Studie galt über viele Jahre als Standardbehandlung. Durch Zusatz des gegen EGFR-gerichteten monoklonalen Antikörpers (mAk) Cetuximab zur Chemotherapie mit Platin und 5-Fluorouracil (5-FU) konnten das Gesamtüberleben, das progressionsfreie Überleben und die Ansprechsraten signifikant verbessert werden. Das Gesamtüberleben in dieser Studie betrug 10.1 Monate (1).
Seit der Publikationen von Checkmate 141 Studie in 2016 und von Keynote 048 Studie in 2019 haben sich Checkpoint-Inhibitoren (CPI) in Behandlung von r/m HNSCC etabliert (2, 3). Weitere Studien im sowohl palliativen wie auch im kurativen Setting sind am Rekrutieren oder haben die Rekrutierung abgeschlossen und die Resultate werden erwartet. Die Ergebnisse von zwei Studien, welche die Rolle von Checkpoint-Inhibitoren in Behandlung von frühen Stadien untersucht haben, sind erstmals am ESMO 2020 präsentiert worden.
Checkpoint-Inhibitoren in der Erstlinientherapie des r/m HNSCC
Die frühen Daten betreffend die Wirksamkeit vom anti-PD-1 Checkpoint-Inhibitor Pembrolizumab (P) kamen aus den initialen und erweiterten Kohorten der Keynote 012, einer Phase 1b Basket-Studie. Die Resultate der beiden Kohorten mit Patienten mit r/m HNSCC wurden zusammen analysiert. Das mediane Überleben war 8 Monate (95% CI 6-10 Monate) und die Ansprechsraten 18% (95% CI, 13-24) mit prolongierter Dauer des Ansprechens. Die Daten zeigten zudem, dass PD-L1 combined positive score (CPS) ein prädiktiver Faktor für das Ansprechen und für das Überleben ist. Für die Berechnung des PDL-1 CPS werden die PD-L1 exprimierenden Zellen (Tumorzellen, Immunzellen und Makrophagen) zusammengezählt, durch Anzahl der Zellen im untersuchten Präparat dividiert und mit 100 multipliziert (4).
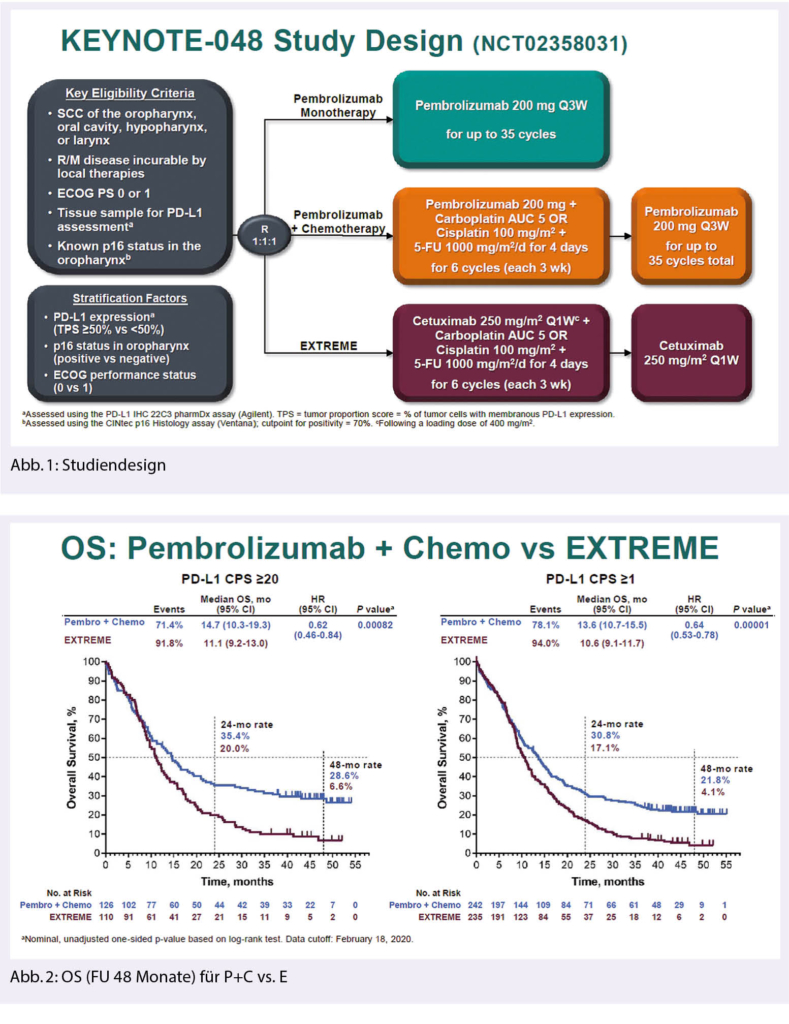
Keynote 048 war eine randomisierte Phase 3 Studie für die Patienten mit Fernmetastasierung oder Lokalrezidiven ohne Möglichkeit einer kurativ intendierten Behandlung (3). Der Zeitpunkt des Rezidivs. musste mindestens 6 Monate nach dem Abschluss der initialen Behandlung aufgetreten sein. Insgesamt wurden 882 Patienten 1:1:1 randomisiert: Pembrolizumab Monotherapie (P), Pembrolizumab in Kombination mit Platin und 5-FU (P+C) oder der bisherige Standard (SoC) mit Cetuximab, Platin und 5-FU nach Extreme Schema (E) (Abb. 1).
Die Stratifizierung erfolgte nach der PD L-1 Expression, HPV Status und ECOG Status. Die Endpunkte waren das Gesamtüberleben und das progressionsfreie Überleben für die Gesamtpopulation und für die Gruppen mit einem PD L-1 CPS von ≥1 und ≥ 20.
Circa 85% der Patienten hatten ein CPS≥ 1 und ca. 44% ein CPS≥ 20. Etwa 20% der Patienten waren p16 positiv und 80% waren aktive oder ehemalige Raucher.
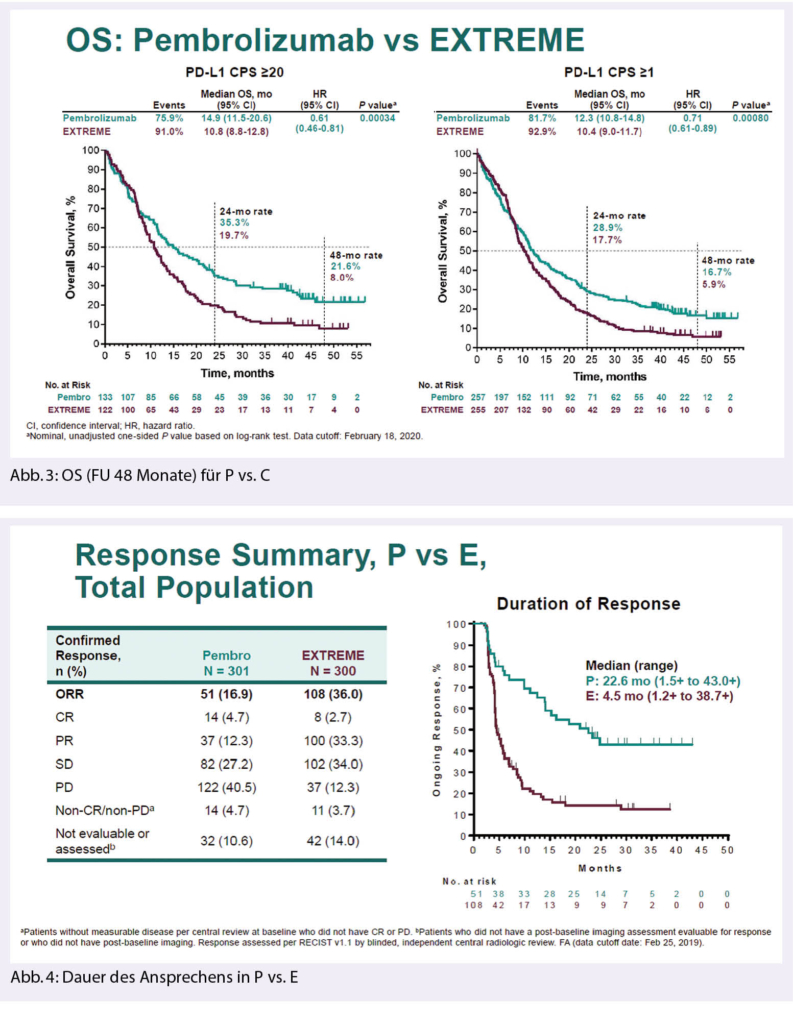
Im P+C vs. E Arm zeigte sich in allen Protokoll-definierten Gruppen eine signifikante Verbesserung des Gesamtüberlebens. Für die Gesamtpopulation betrug das Überleben für P+C vs. E 13.0 vs. 10.7 Monate, was mit einer hazard ratio (HR) von 0.77 (95% CI 0.63-0.93), und einem p=0.034 signifikant war. In der Gruppe von Patienten mit einem CPS≥1 war das Gesamtüberleben 13.6 vs. 10.4 Monate (HR 0.65, [95% CI 0.53-0.80], p<0.0001) und bei Patienten mit einem CPS≥20 14.7 vs. 11 Monate (HR 0.60 [0.45-0.82] p=0.0004) (Abb. 2).
Das progressionsfreie Überleben (PFS) und das objektive Ansprechen (ORR) wurden gegenüber dem Kontrollarm in keiner der nach CPS aufgeteilten Gruppen verbessert. Bei den Patienten, bei welchen es zu einem objektiven Ansprechen kam, dauerte dieser im P+C Arm länger als im E Arm (6.7 vs. 4.3 Monate in der Gesamtpopulation, 6.7 vs. 4.3 in CPS≤ 1 Gruppe und 7.1 vs. 4.2 Monate in der CPS ≥ Gruppe).
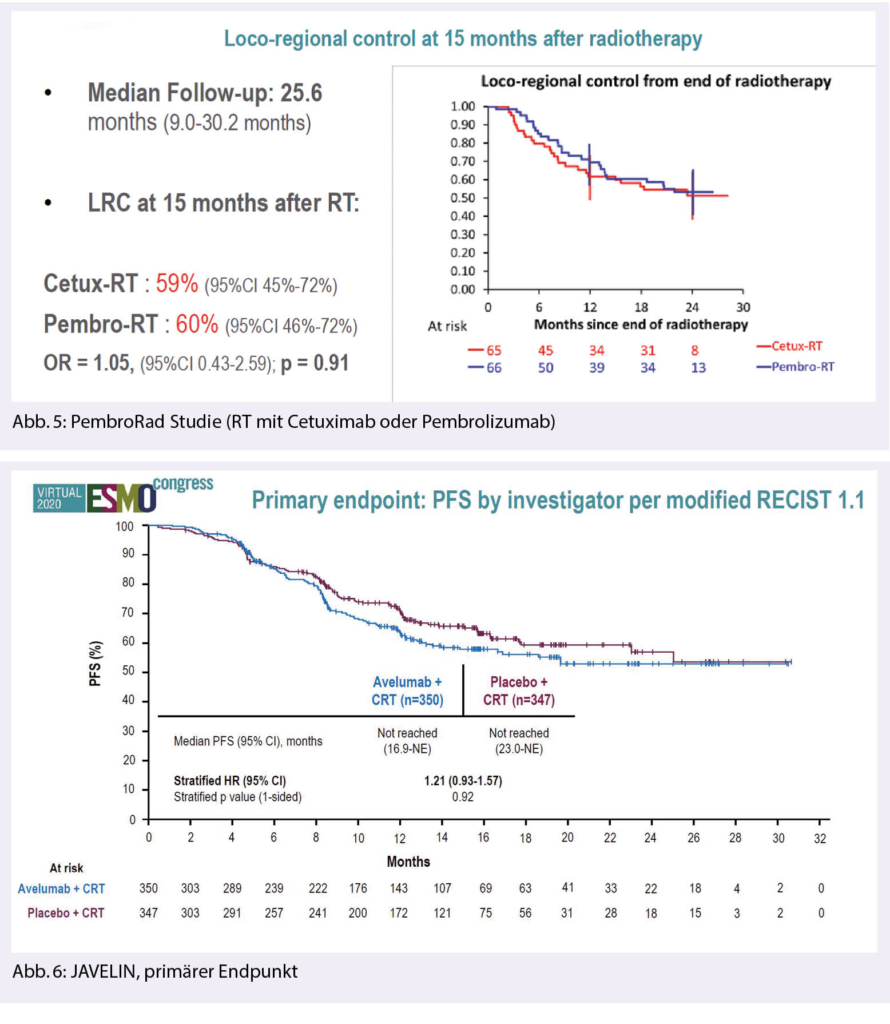
Die Pembrolizumab Monotherapie verbesserte bei Patienten mit einem CPS≥ 20 das mediane Überleben um 4 Monate (14.9 vs. 10.7, HR 0.61 [0.45-0.83], p = 0.0007) und bei Patienten mit einem CPS≥ 1 um 2 Monate (12.3. vs. 10.3, HR 0.78 [0.64-0.96], p = 0.0086). In der Gesamtpopulation war die Therapie mit P gegenüber dem Standardarm nicht unterlegen (11.6. vs. 10.7 Monate; HR 0.85 [0.71-1.03]) (Abb. 3). Die Ansprechraten unter einer Monotherapie mit Pembrolizumab sind wesentlich tiefer im Vergleich zum Kontrollarm (23% vs. 36% in der Gruppe mit CPS≥ 20 und 17%vs. 36% in der Gruppe mit CPS ≤ 1). Die Dauer des Ansprechens ist länger im P vs. E Arm (Abb. 4).
Bezüglich der Verträglichkeit zeigte der Chemotherapie-freie Arm P das günstigste Toxizitätsprofil mit wenigsten Nebenwirkungen Grad 3 oder höher (55%). Toxizität Grad 3 oder höher im P+C and im E+C Arm war 85% und 83%.
Die Langzeitdaten nach 48 Monaten Beobachtungszeit bestätigten die anhaltende signifikante Verbesserung des Gesamtüberlebens (5). Im P Arm war das Gesamtüberleben nach 48 Monate für Gruppen mit CPS≥2 0, CPS ≥1 und für die Gesamtpopulation 21.6%, 16.7% und 15.4 % verglichen mit 8.0%, 5.9% und 6.6% im E.
Im P+C Arm war das Gesamtüberleben nach 48 Monaten 28.6%, 21,8% und 19.4% für CPS≥ 20, CPA≥1 und für die Gesamtpopulation, verglichen mit 6.6%, 4.1% und 4.5% im Standardarm.
Am AACR 2019 wurden zusätzlich die Daten für die Subgruppen von Patienten mit einem CPS<1 sowie einem CPS zwischen 1-19 diskutiert. Zu bedenken ist, dass bei diesen retrospektiven Analysen die Patientenzahlen pro Gruppe relativ klein sind.
In der Gruppe von Patienten mit einem CPS<1 war P (n=44) in allen Hauptendpunkten dem Kontrollarm E (n=45) unterlegen. Das mediane Überleben war im P mehr als drei Monate kürzer als im E Arm (7.9 vs. 11.3 Monate, HR 1.05 [CI 0.96-2.37]). Sowohl das objektive Ansprechen wie auch das progressionsfreie Überleben waren höher im E (ORR 42.2 % vs. 4.5% und PFS 6.2 vs. 2.1 Monate (HR 4.31 [CI 2.63-7.08]). In der Gruppe mit einem CPS 1-19 war das Gesamtüberleben für P vs. E vergleichbar (10.8. vs. 10.1 ; HR 0.86 [0.66-1.12]). Die Ansprechraten waren im P Arm wesentlich tiefer (18% vs. 45%) und PFS kürzer (2.2 vs. 4.9. Monate, HR 1.25 [0.96-1.61]).
Im P+C Arm war in der Gruppe mit CPS<1 das mediane Überleben gegenüber E vergleichbar (11.7. vs. 10.7, HR 1.21 [0.76-1.94]). Ähnlich waren für P+C vs. E auch das Ansprechen (12% vs. 17%) und das progressionsfreie Überleben (4.7 vs. 6.2)
In der Gruppe mit CPS≥ 1-19 war das Gesamtüberleben im P+C höher als im E (12.7 vs. 9.9 Monate, HR 0.71 [0.54 vs. 0.94]). Das progressionsfreie Überleben war mit 4.9 Monaten in beiden Armen gleich (HR 0.93 (0.71-1.21)) und PFS numerisch etwas höher im E als in P+C Arm (42% vs. 34%).
Abgeschlossene Studien in der Erstlinientherapie bei r/m HNSCC
Mehrere Studien in der Erstlinientherapie haben die Rekrutierung abgeschlossen und die Resultate werden erwartet.
Checkmate 651 ist eine randomisierte Phase 3 Studie in welcher 950 Patienten mit r/m HNSCC entweder in den Studienarm mit Ipilimumab und Nivolumab, oder in den Standardarm mit Cetuximab, Platin und 5FU randomisiert worden sind. Die Rekrutierung ist abgeschlossen.
KESTREL ist eine dreiarmige Studie bei platin-sensitiven Patienten die in den Arm mit Durvalumab und Tremelimumab, Durvalumab Monotherapie oder Extreme randomisiert worden sind. Auch da werden die Resultate erwartet.
INDUCE-3 ist eine Phase 2/3 Studie in welcher Pembrolizumab in Kombination mit entweder Studienmedikament GSK609 oder Placebo geprüft wird. GSK609 ist ein IgG4 Antikörper mit agonistischer Wirkung auf T-Cells Inducible Co-Stimulatory Rezeptor (ICOS). ICOS ist involviert in Proliferation und Differenzierung von T-Zellen und wird auf den tumor-infiltrierenden Lymphozyten exprimiert. Die Rekrutierung ist im Oktober 2020 erreicht worden.
Checkpoint-Inhibitoren in kurativer Therapie der lokal fortgeschrittenen Kopf-Hals-Tumoren (LAHNSCC)
Der Stellenwert von Checkpoint-Inhibitoren in kurativ intendierter Therapie von LAHNSCC ist noch unklar und wird in mehreren laufenden Studien untersucht. Am ESMO 2020 sind zum ersten Mal zwei randomisierte Studien präsentiert worden. Diese Studien haben ihre Endpunkte nicht erreicht.
GORTEC 2015-01 («PembroRad») ist eine randomisierte Phase 2 Studie in welche 131 Patienten mit LAHNSCC Stadium III-IVb eingeschlossen worden sind.
Nur die Patienten, die für eine konkomitierende Radiochemotherapie (RCT) mit hochdosiertem Cisplatin nicht qualifiziert haben konnten in der Studie teilnehmen.
Die Patienten erhielten konkomitierend zu Radiotherapie (RT) entweder Pembrolizumab 200 mg q3w (P-RT) oder Cetuximab nach üblichem Schema (400 mg/m2d1, danach 250 mg/m2 wöchentlich) (C-RT). Es gab keine Erhaltungstherapie. Der primäre Endpunkt war die lokoregionäre Kontrolle (LRC) nach 15 Monaten. Es gab keinen Unterschied zwischen den beiden Armen (LRC von 59% im C-RT und 60% im P-RT Arm. HR = 1.05 (95%CI: 0.43- 2.59, p = 0.91).
Auch bezüglich des progressionsfreien Überlebens waren beide Arme gleich. Nach 2 Jahren waren 40% der Patienten im C-RT Arm und 42% im P-RT Arm progressionsfrei. Das Gesamtüberleben war mit HR=0.83 (95%CI:0.49-1.4, p=0.49) nicht signifikant verbessert. Nach 2 Jahren lebten 55% der Patienten im C-RT Arm vs. 62%im P-RT Arm (7) (Abb. 5). JAVELIN ist eine Phase 3 Studie für Patienten mit LAHNSCC Stadium III-IVb. Die Patienten sind mit konkomitierender definitiver RCT (70 Gy, Cisplatin 100 mg/m2 q3w) behandelt worden und erhielten zusätzlich entweder den anti-PD-L1 Antikörper Avelumab oder Placebo. Avelumab (10 mg/kg) wurde einmalig vor Beginn der RCT (lead-in), danach jede 2 Wochen konkomitiered zur RCT, und anschliessend während eines Jahres als Erhaltung gegeben.
Die Resultate der interim Analyse zeigen keine Verbesserung des Gesamtüberlebens bei einer HR von 1.31 (95% CI: 0.93-1.85) und einem p = 0.937. Das progressionsfreie Überleben wurde nicht verbessert (HR 1.21, [95%CI:0.93-1.57], p = 0.920). Toxizität Grad ≥ 3 war höher im Avelumab Arm. Aufgrund dieser Daten wurde die Studie frühzeitig gestoppt (6) (Abb. 6).
Neoadjuvante Immuntherapie gefolgt von Operation
Im Verlauf drr letzten 10 Jahre haben mehrere Studien die Rolle der neoadjuvanten Chemotherapie vor definitiver Radiochemotherapie geprüft. Die Ansprechraten waren hoch und die Fernmetastasierung konnte reduziert werden, jedoch zeigte sich wiederholt, dass neoadjuvante Chemotherapie das Gesamtüberleben nicht verbessert. Die neoadjuvante Chemotherapie hat heute einen Stellenwert als eine der Optionen in Therapie des Larynxkarzinoms.
Nun wird in laufenden Studien die Rolle einer präoperativen Immuntherapie geprüft. Eine vor kurzem publizierte randomisierte Phase 2 Studie prüfte die Rolle einer präoperativen neoadjuvanten Immuntherapie. Insgesamt 29 Patienten mit Stadium II-IVA wurden eingeschlossen, davon 14 in den Arm mit Nivolumab Monotherapie (N) und 15 in den Arm mit der Kombination von Nivolumab/Ipilimumab (N+I). Alle Patienten erhielten 2 Zyklen Nivolumab. Ipilimumab wurde im Arm N+I nur im ersten Zyklus gegeben. Die Nebenwirkungen Grad 3 und 4 traten in insgesamt 7 Patienten vor. Bei keinem Patienten musste die Operation verschoben werden.
Es wurden das Ansprechen gemäss RECIST, volumetrisches Ansprechen sowie pathologisches Ansprechen evaluiert. Das pathologische Ansprechen wurde in 54% der Patienten im N und 73% im N+I beschrieben. Die geplanten Operationen konnten wie vorbereitet durchgeführt werden, auch bei drei Patienten bei welchen es unter Immuntherapie zum Progress kam (8).
Am ESMO 2020 wurden die ersten Daten der Phase 1b/2 Studie IMCISION präsentiert. Bei 32 Patienten im Stadium II-IVB war eine kurativ intendierte Operation geplant, davon handelte es sich bei sechs Patienten um eine Salvage-Operation nach einer RCT. Die Patienten erhielten präoperativ entweder zwei Zyklen Nivolumab (240 mg) oder einen Zyklus Nivolumab und Ipilimumab (1mg/kg) gefolgt von einem Zyklus mit nur Nivolumab. Bei acht Patienten im Kombinationsarm und einem Patienten im Nivolumab-Arm zeigte sich ein fast vollständiges pathologisches Ansprechen (near complete pathological response, ncPR) definiert als Reduktion des «viablen» Anteils der Tumorzellen von 90% oder mehr. Weitere 31% hatten ein pathologisches Ansprechen zwischen 20-89%. Bei den Patienten mit einer nCPR kam es im bisherigen Beobachtungszeit zu keinen Rezidiven (9).
Weitere neue Substanzen
Xevinapant (Debio 1143)
Xevinapant ist ein Antagonist von «Inhibitor of Apoptosis Proteins» (IAPs). Die Patienten mit nicht operablem LAHNSCC Stadium III-IVB sind mit konkomitierender RCT behandelt worden. Zusätzlich erhielten sie Xevinapant (D1-14 für 3 Zyklen) oder Placebo.
Am ESMO 2020 präsentierte Daten zeigten eine Verbesserung der lokoregionären Kontrolle (LRC) mit einer HR von 0.47 ([CI 0.19-1.15]; p = 0.095). Das mediane progressionsfreie Überleben ist im Xevinanapant-Arm nicht erreicht und im Placebo-Arm 16.9 (HR 0.34 [0.17-0.68] p = 0.0023). Auch das mediane Überleben konnte signifikant verlängert werden (not reached vs. 36.1. Monate, HR 0.49 [0.26 vs. 0.92], p = 0.0261). Die Phase 3 Studie mit Xevinapant ist am Rekrutieren (10).
Rekrutierende Studien bei lokal fortgeschrittenen HNSCC
Keynote 689 ist eine randomisierte Phase 3 Studie für die Patienten mit LA HNSCC Stadium III-IVA welche mit einer Operation gefolgt von der Radiotherapie oder Radiochemotherapie behandelt werden sollen. Im Studienarm erhalten die Patienten Pembrolizumab neoadjuvant, danach konkomitierend zur adjuvanten RT oder RCT und anschliessend als Erhaltungstherapie.
Zusammenfassung: Erstlinientherapie bei r/m HNSCC und erste Daten im kurativen Setting
Die Studie Keynote 048 hat Pembrolizumab in Kombination mit Platin und 5FU oder als Monotherapie als Standard für Patienten in der Erstlinientherapie von r/m HNSCC etabliert. Die Wahl zwischen diesen beiden Optionen soll unter Berücksichtigung von CPS, Allgemeinzustand des Patienten, Symptomatik und dem Tumorload getroffen werden.
Die Kombination von Pembrolizumab mit Chemotherapie kann empfohlen werden für die Patienten bei welchen diese Therapie von Seite des Allgmeinzustandes und Komorbiditäten vertretbar ist, und insbesondere, wenn ein objektives Ansprechen erreicht werden soll. Diese Empfehlung basiert auf dem verbesserten Gesamtüberleben in den Gruppen mit CPS ≥ 1, CPS ≥ 20 sowie in der Gesamtpopulation bei vergleichbarem progressionsfreiem Überleben und Ansprechraten. In der Subgruppe der Patienten mit CPS<1 gab es im Vergleich zu Extreme keinen Unterschied in Bezug auf das Gesamtüberleben oder progressionsfreies Überleben. Pembrolizumab Monotherapie hat das Gesamtüberleben in der CPS≥ 20 und CPS ≥ 1 verbessert und ist in der Gesamtpopulation dem Standard nicht unterlegen. Die Ansprechraten sind im P Arm insgesamt, insbesondere aber bei tiefem PD-L1 CPS dem Standardarm E deutlich unterlegen. Bei einem CPS < 1 zeigten die präsentierten, bisher noch nicht publizierten Daten tieferes OS, PFS und ORR für P im Vergleich zu E.
Somit ist eine Chemotherapie-freie Behandlung mit Pembrolizumab Monotherapie eine Option für asymptomatische oder oligosymptomatische Patienten bei welchen aufgrund der Klinik und Lokalisation des Rezidivs kein Bedarf nach einem objektiven Ansprechen besteht und welche ein CPS von mindestens 1 aufweisen. Der Benefit steigt mit steigendem CPS. Das klar ungelöste Problem auch bei diesen neuen Optionen bleibt das objektive Ansprechen, welches bei einer Behandlung mit Pembrolizumab Monotherapie sehr niedrig ist und im P+C im Vergleich zum bisherigen Standard nicht verbessert werden konnte.
Gerade bei Patienten mit r/m HNSCC, bei denen die Lokalrezidive symptomatisch sind und wichtigen Funktionen wie Schlucken, Sprechen oder Atmen beeinträchtigen, wäre das objektive Ansprechen für die Lebensqualität von grosser Bedeutung. Es ist zu hoffen, dass in weiteren Studien mit neuen Substanzen und Kombinationen höhere Ansprechraten erreicht werden. Bezüglich der kurativ intendierten Therapie zeigten bis jetzt präsentierte Daten keinen Vorteil von Kombination von CPI und konkomitierender R(C)T. Die Ergebnisse von weiteren Studien sind ausstehend. Die ersten Daten für Checkpoint-Inhibitoren im neoadjuvanten Setting zeigen interessante Daten bezüglich des objektiven, vor allem pathologischen Ansprechens.
Copyright bei Aerzteverlag medinfo AG
Kantonsspital St. Gallen, Klinik für Hämatologie
und Onkologie und Brustzentrum
Rorschacherstrasse 95
9007 St. Gallen
Die Autorin deklariert Advisory board fees von BMS und MSD.
- 30% der Patienten mit lokal fortgeschrittenen Plattenepithelkarzinomen des Kopf-Hals-Bereichs (LAHNSCC) werden trotz initialer multimodaler Therapie Lokalrezidive oder Fernmetastasierung (r/m HNSCC) entwickeln.
- PD-L1 Combined Positive Score (CPS) ist ein prädiktiver Faktor für das Ansprechen und das Überleben.
- Mit den Studien Checkmate 141 und Keynote 048 haben sich Checkpoint-Inhibitoren (CPI) in Behandlung von r/m HNSCC etabliert.
- Der Stellenwert von Checkpoint-Inhibitoren in kurativ intendierter Therapie von LAHNSCC ist noch unklar und wird in mehreren laufenden Studien untersucht.
Messages à retenir
- 30% des patients atteints d’un carcinome épidermoïde de la tête et du cou localement avancé (LAHNSCC) développeront une récidive locale ou des métastases à distance (HNSCC r/m) malgré un traitement multimodal initial.
- Le score positif combiné PD-L1 (CPS) est un facteur prédictif de la réponse et de la survie.
- Les études Checkmate 141 et Keynote 048 ont établi l’existence d’inhibiteurs de point de contrôle dans le traitement du HNSCC r/m.
- Le rôle des inhibiteurs de point de contrôle dans la thérapie curative du LAHNSCC n’est pas encore clair et fait l’objet de plusieurs études en cours.
1. Vermorken JB, Mesia R, Rivera F et al. Platinum-based chemotherapy plus cetuximab in head and neck cancer. N Engl J Med 2008; 359: 1116-1127.
2. Ferris RL, Blumenschein G, Jr., Fayette J et al. Nivolumab for Recurrent Squamous-Cell Carcinoma of the Head and Neck. N Engl J Med 2016.
3. Burtness B, Harrington KJ, Greil R et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study. Lancet 2019; 394: 1915-1928.
4. Mehra R, Seiwert TY, Gupta S et al. Efficacy and safety of pembrolizumab in recurrent/metastatic head and neck squamous cell carcinoma: pooled analyses after long-term follow-up in KEYNOTE-012. Br J Cancer 2018; 119: 153-159.
5. Greil R, Rischin D, Harrington KJ et al. 915MO Long-term outcomes from KEYNOTE-048: Pembrolizumab (pembro) alone or with chemotherapy (pembro+C) vs. EXTREME (E) as first-line (1L) therapy for recurrent/metastatic (R/M) head and neck squamous cell carcinoma (HNSCC). Annals of Oncology 2020; 31: S660-S661.
6. Cohen EE, Ferris RL, Psyrri A et al. 910O Primary results of the phase III JAVELIN head & neck 100 trial: Avelumab plus chemoradiotherapy (CRT) followed by avelumab maintenance vs. CRT in patients with locally advanced squamous cell carcinoma of the head and neck (LA SCCHN). Annals of Oncology 2020; 31: S658.
7. Bourhis J, Sire C, Tao Y et al. LBA38 Pembrolizumab versus cetuximab, concomitant with radiotherapy (RT) in locally advanced head and neck squamous cell carcinoma (LA-HNSCC): Results of the GORTEC 2015-01 “PembroRad” randomized trial. Annals of Oncology 2020; 31: S1168.
8. Schoenfeld JD, Hanna GJ, Jo VY et al. Neoadjuvant Nivolumab or Nivolumab Plus Ipilimumab in Untreated Oral Cavity Squamous Cell Carcinoma: A Phase 2 Open-Label Randomized Clinical Trial. JAMA Oncol 2020.
9. Zuur L, Vos JL, Elbers JB et al. LBA40 Neoadjuvant nivolumab and nivolumab plus ipilimumab induce (near-) complete responses in patients with head and neck squamous cell carcinoma: The IMCISION trial. Annals of Oncology 2020; 31: S1169.
10. Bourhis J, Sun X, Pointreau Y et al. Double-blind randomized phase II results comparing concurrent high-dose cisplatin chemorradiation (CRT) plus debio 1143 or placebo in high-risk patients with locally advanced squamous cell carcinoma of the head and neck (SCCHN): A GORTEC study. Annals of Oncology 2019; 30: v902.
info@onco-suisse
- Vol. 10
- Ausgabe 7
- Dezember 2020