- Erleada® (Apalutamid)
Erleada® (Apalutamid)
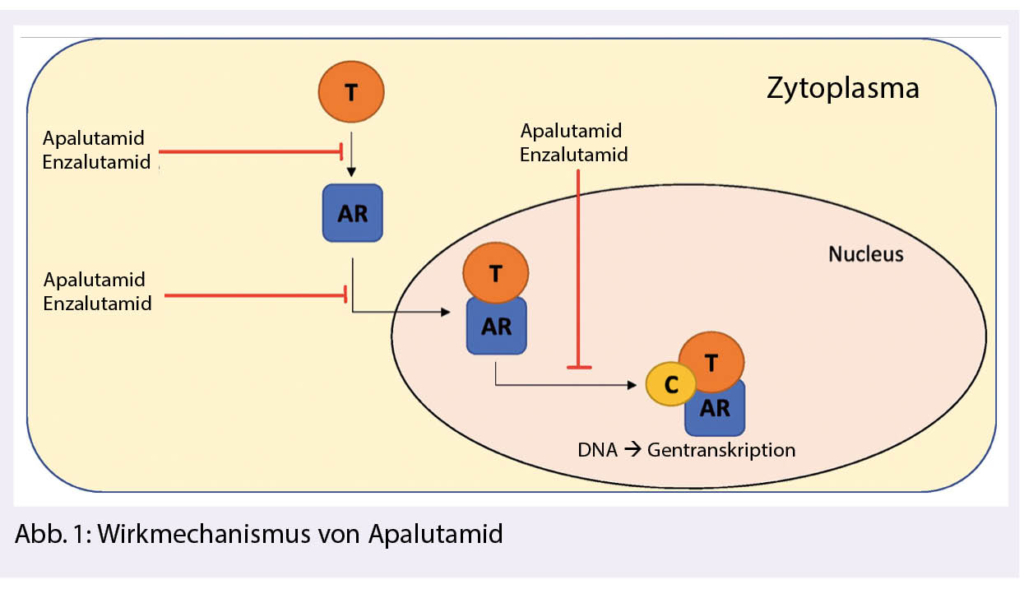
Wirkmechanismus
Erleada (Apalutamid) ist ein oraler nicht-steroidaler selektiver Androgenrezeptor (AR)-Inhibitor, der direkt an die Liganden-bindende Domäne des AR bindet. Erleada verhindert die nukleäre Translokation des AR, hemmt die DNA-Bindung und damit die AR-vermittelte Transkription. Erleada zeigt keine agonistische Aktivität am Androgenrezeptor. Die Behandlung mit Apalutamid hemmt die Proliferation der Tumorzellen und steigert die Apoptose, wodurch es zu einer ausgeprägten antitumoralen Aktivität kommt. Ein Hauptmetabolit, N-Desmethylapalutamid zeigte in vitro ein Drittel der Aktivität von Apalutamid. Erleada verstärkt somit insbesondere die durch ADA vermittelte antiandrogene Wirkung (Abb. 1).
Klinische Wirksamkeit
In einer multizentrischen, doppelblinden klinischen Studie (ARN-509-003), der sog. «Spartan-Studie», wurden insgesamt 1207 Studienteilnehmer mit nmCRPC 2:1 randomisiert und erhielten entweder (n=806) Apalutamid oral in einer Dosis von 240 mg einmal täglich in Kombination mit einer Androgendeprivationstherapie (ADT) (medikamentöse Kastration oder vorherige chirurgische Kastration) oder (n=401) Placebo mit ADT. Eine Steroidsubsitution war nicht vorgesehen. Alle eingeschlossenen Patienten wiesen eine Verdopplungszeit des prostataspezifischen Antigens (PSADT) von ≤ 10 Monaten auf. Daher wurde bei ihnen ein hohes Risiko für eine unmittelbar drohende Metastasierung und Tod aufgrund von Prostatakrebs angenommen. Alle nicht chirurgisch kastrierten Studienteilnehmer erhielten während der Studie eine fortlaufende ADT. Die PSA-Ergebnisse waren verblindet und wurden nicht als Grund für einen Behandlungsabbruch verwendet. Die Studienteilnehmer in beiden Armen setzten die Behandlung bis zum Fortschreiten der Erkrankung, dem Beginn einer neuen Behandlung, nicht akzeptabler Toxizität oder Studienabbruch fort.
Das mediane Alter betrug 74 Jahre (Bereich 48-97); 26% der Studienteilnehmer waren > 80 Jahre alt. Die Verteilung der Ethnien war: 66% kaukasisch, 5,6% schwarz, 12% asiatisch und 0,2% andere. 77% der Studienteilnehmer in beiden Behandlungsarmen hatten zuvor eine Operation oder eine Bestrahlung der Prostata. Die Mehrheit der Studienteilnehmer hatte einen Gleason-Score von >7 (81%). 15% Prozent hatten bei Studieneintritt Beckenlymphknoten von < 2 cm. 73% der Studienteilnehmer hatten zuvor eine Behandlung mit einem Antiandrogen der ersten Generation, 69% mit Bicalutamid und 10% mit Flutamid, erhalten. Alle in die Studie eingeschlossenen Patienten waren nicht metastasiert, beurteilt anhand der verblindeten zentralen Bildgebungsauswertung und hatten einen ECOG PS (Performance-Status der Eastern Cooperative Oncology Group) von 0 oder 1 bei Studieneintritt.
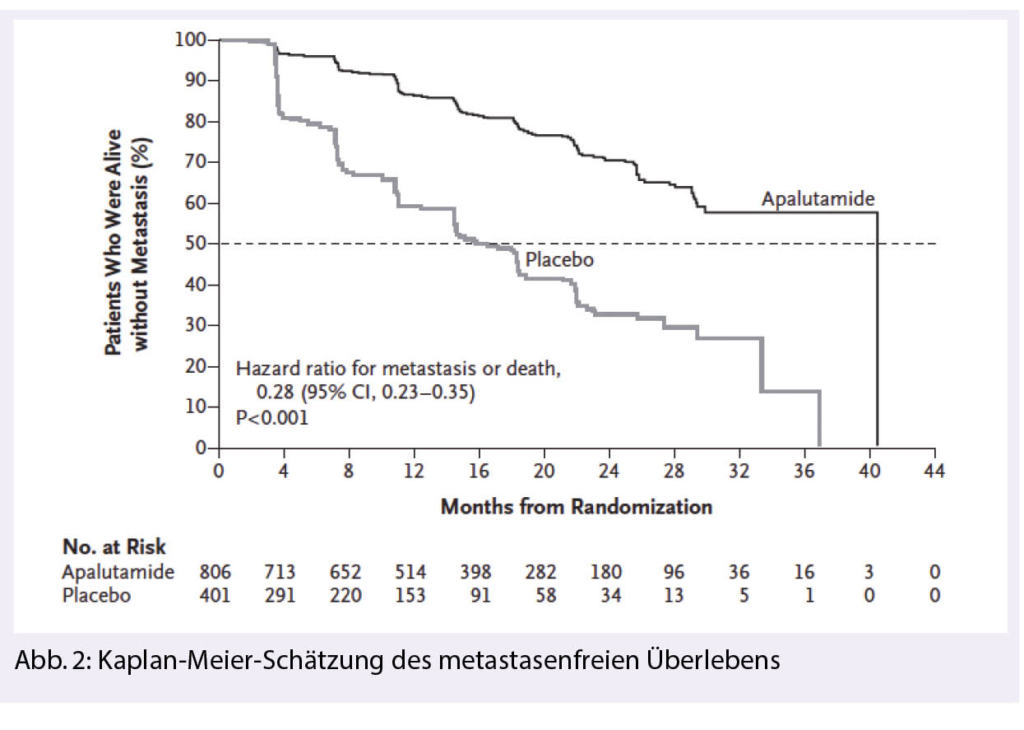
Primärer Endpunkt war metastasenfreies Überleben («metastasis-free survival», MFS), definiert als Zeit von der Randomisierung bis zum Zeitpunkt des ersten Nachweises von BICR-bestätigten Fernmetastasen in Knochen oder Weichteilen oder bis zum Tod jeglicher Ursache, je nachdem, was zuerst eintrat. Die Behandlung mit Erleada verbesserte das metastasenfreie Überleben signifikant. Erleada verminderte das relative Risiko für Fernmetastasen oder Tod im Vergleich zu Placebo um 70% (HR = 0,30; 95%-KI: 0,24; 0,36; p < 0,0001). Das mediane MFS betrug 41 Monate unter Erleada und 16 Monate unter Placebo (siehe Abb. 2). Unter Erleada wurde eine konsistente Verbesserung des MFS für alle vordefinierten Subgruppen beobachtet, wie Alter, ethnische Zugehörigkeit, Region, Lymphknotenstatus, Anzahl der früheren Hormontherapien, PSA-Wert bei Baseline, PSA-Verdopplungszeit, ECOG-Status bei Baseline und Anwendung von osteoprotektiven Wirkstoffen.
Sicherheit und Nebenwirkungen
Die am häufigsten beobachteten Nebenwirkungen sind Ermüdung (30%), Hautausschlag (24% davon 5% Grad 3 oder 4), Gewichtsverlust (16%), Arthralgie (16%) und Sturz (16%). Zu weiteren wichtigen Nebenwirkungen gehören Frakturen (12%) und Hypothyreose (8%). Bei den milden Nebenwirkungen traten Verwirrtheit, Hypothyreose und mentale Veränderungen gehäuft auf. Die therapieassoziierte Mortalität lag unter Apalutamid bei 1,2%, im Kontrollarm bei 0,3%. Die Abbruchrate aufgrund von Nebenwirkungen lag im Apalutamid-Arm bei 10.6% versus 7% im Placebo-Arm. Folgendes ist besonders zu beachten:
- Der mit Erleada assoziierte Hautausschlag wurde am häufigsten als makulös oder makulo-papulös beschrieben. Die mediane Zeit bis zum Auftreten von Hautauschlägen betrug median 82 Tage (1 bis 994 Tage). Bei 81% der Patienten bildete sich der Ausschlag nach median 60 Tagen wieder zurück. Zu den zur Therapie verwendeten Arzneimitteln gehörten topische Kortikosteroide, systemische Kortikosteroide und orale Antihistaminika.
- Wegen der höheren Rate von Patienten mit Verwirrtheit, Fallneigung und Frakturen. sollten gefährdete Patienten nur ausnahmsweise und mit entsprechender Vorsicht für eine Therapie mit Apalutamid evaluiert werden.
- Krampfanfälle traten bei 0,2% der Patienten auf, die Erleada im Rahmen klinischer Studien erhielten. Erleada wird bei Patienten mit Krampfanfällen in der Anamnese oder einer entsprechenden Prädisposition, wie unter anderem vorliegende Hirnverletzung, Schlaganfall innerhalb des letzten Jahres, primäre Hirntumoren oder Hirnmetastasen, nicht empfohlen.
- Patienten mit einer klinisch relevanten kardiovaskulären Erkrankung in den vergangenen 6 Monaten, sowie mit klinisch relevanten ventrikulären Arrhythmien waren von den klinischen Studien ausgeschlossen. Daher ist die Sicherheit von Apalutamid bei diesen Patienten nicht erwiesen. Wenn Erleada verordnet wird, sollten Patienten mit einer klinisch relevanten kardiovaskulären Erkrankung hinsichtlich Risikofaktoren wie Hypercholesterinämie, Hypertriglyzeridämie oder andere kardio-metabolische Störungen überwacht werden.
- Da eine Androgendeprivationstherapie das QT-Intervall verlängern kann, sollte die gleichzeitige Anwendung von Erleada mit Arzneimitteln, die bekanntermassen das QT-Intervall verlängern, oder mit Arzneimitteln, die Torsade-de-Pointes verursachen können, sehr vorsichtig abgewogen werden.
- Wechselwirkungen mit anderen Arzneimitteln: Apalutamid ist ein potenter Enzyminduktor und steigert die Synthese vieler Enzyme und Transporter. Deshalb werden Interaktionen mit vielen häufig verwendeten Arzneimitteln erwartet, die Substrate von Enzymen oder Transportern sind. Die Verringerung der Plasmakonzentration kann beträchtlich sein und zum Verlust oder einer Reduktion der klinischen Wirksamkeit führen. Es besteht auch das Risiko der erhöhten Bildung von aktiven Metaboliten.
- Bei der Behandlung von Patienten, die nicht chirurgisch kastriert sind, soll die medizinische Kastration mit einem Gonadotropin-freisetzenden Hormonanalogon (GnRHa) fortgeführt werden.
Es wird empfohlen, dass Patienten mit Apalutamid von einem Arzt mit Erfahrung in der Behandlung des Prostatakarzinoms initiiert und überwacht werden.
Kommentar:
Nach jahrzehntelangem Desinteresse der Pharmafirmen am Prostatakarzinom, folgen sich nun in hoher Kadenz gleich mehrere hochwirksame Medikamente als Ergänzung zur etablierten Hormonblockade mit LHRH-Medikamenten bei Patienten mit hormonsensitivem Prostatakarzinom. Das Ziel, die Krankheitsprogression gegenüber einer bisher etablierten Androgen deprivierenden Therapie (ADT) weiter hinauszuzögern und das Gesamtüberleben durch eine maximale Androgenblockade zu verlängern, wird damit klar erreicht. Die positiven Daten aus diesen sehr grossen Studien mit neuen oder erweiterten Indikationen sind letztlich vergleichbar. Nun haben wir also neben dem bewährten Abirateron (Zytiga) auch Apalutamid (Erleada), Enzalutamid (Xtandi) und bald auch Darolutamid zur Verfügung, um die Androgenblockade zu optimieren und die bisherigen weniger wirksamen ADT der nicht-steroidalen Anti-Androgene wie Bicalutamid, Nilutamid oder Flutamid weiter zu verdrängen. Ein direkter studienmässiger Vergleich dieser Medikamente liegt bisher nicht vor.
Neu und bemerkenswert in dieser pivotalen Spartan-Zulassungs-Studie für Apalutamid ist der primäre Endpunkt «metastasenfreies Überleben», der so zum ersten Mal zur Anwendung kommt und in einem begleitenden Kommentar im NEJM besprochen wurde. Es ist zu erwarten, dass wir diesem Endpunkt als Variante von PFS vermehrt begegnen werden. Er erklärt sich aus der besonderen Situation beim Prostatakarzinom, da mit dem PSA-Wert ein sensitiver Laborparameter zur Überwachung des Therapieansprechens zur Verfügung steht. Bei vielen Patienten steigt der PSA-Wert an, ohne dass bildgebend bereits Metastasen lokalisiert werden können. Diese Zulassungsstudie prüfte nun erstmals als primärer Endpunkt, ob der durch den PSA-Anstieg bereits dokumentierte rein labormässige Progress bis zur nächsten Stufe einer bildgebend dokumentierten Progression durch die Therapie mit Apalutamid verzögert werden kann als «metastasenfreies Überleben». Die Antwort fiel hier signifikant positiv aus. Die Zulassungsbehörden akzeptieren also neben dem progressionsfreien jetzt auch das metastasenfreie Überleben als Endpunkt.
Ein Jahr nach der Publikation der «Spartan-Studie» im NEJM wurden auch die Daten der analogen Phase-3 TITAN-Studie vorgestellt, welche jedoch nicht Hochrisko-Patienten, welche noch metastasenfrei waren, untersuchte, sondern Patienten mit bereits nachgewiesenen Metastasen. Apalutamid plus ADT führte hier bei 1052 Patienten, 1:1 randomisiert, im Vergleich zu Placebo plus ADT zu einer signifikanten Verlängerung des OS bei einer Reduktion des Mortalitätsrisikos um 33 Prozent (HR=0,67; 95 % CI, 0,51-0,89; P=0,0053). In beiden Studienarmen wurde das mediane OS noch nicht erreicht. Die Kombination aus Apalutamid plus ADT resultierte ausserdem in einer signifikanten Verbesserung des rPFS mit einer Reduzierung der radiologischen Progression oder der Mortalität um 52 Prozent im Vergleich zu Placebo plus ADT (HR=0,48; 95 % CI, 0,39-0,60; P<0,0001). Das mediane rPFS betrug 22,1 Monate bei dem Placebo-ADT-Arm und wurde im Apalutamid-ADT-Arm noch nicht erreicht. Die Zwei-Jahres-OS-Raten nach einer medianen Nachbeobachtungszeit von 22,7 Monaten betrugen 82% bei Apalutamid plus ADT im Vergleich zu 74% beim Placebo-ADT-Arm. Damit kann eine baldige Indikationserweiterung für Patienten mit bereits metastasierendem hormonsensitivem Prostatakarzinom für Apalutamid erwartet werden.
Dass hier noch weitere Substanzen am Horizont sind, zeigt die grosse randomisierte SAKK 08/16 Studie mit Darolutamid (einem weiteren Androgen-Rezeptor-Antagonist der 2. Generation) nun als Erhaltungstherapie bei hormonrefraktären metastasierenden Patienten eingesetzt, welche nach einer Antigenrezeptortherapie und anschliessender Taxan-Therapie nicht progredient sind. Diese Studie rekrutiert seit 2017 in der Schweiz und Italien und steht für geeignete Patienten offen.
Noch völlig offen ist die generelle Frage, inwieweit die maximale Androgenblockade eine dementielle Entwicklung auslösen oder beschleunigen könnte. Langzeitdaten aus den grossen prospektiven Studien werden wohl erst in einigen Jahren verlässliche Daten dazu liefern können.
Rosengartenstrasse 1d
9000 St. Gallen
thomas.cerny@kssg.ch
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Beitrag deklariert.
Wichtigste Referenzen:
https://compendium.ch/product/1423449-erleada-filmtabl-60-mg/MProHussain MR,
https://www.ema.europa.eu/en/documents/product-information/erleada-epar-product-information_de.pdf
Fizazi K, Saad F et al.: Enzalutamide in men with nonmetastatic, castration-resistant prostate cancer. N Engl J Med 378:2465-2474, 2018. DOI: 10.1056/NEJMoa1800536
Smith MR, Saad F, Chowdhury S et al.: Apalutamide treatment and metastasis-free survival in prostate cancer. N Engl J Med 378:1408-1418, 2018. DOI: 10.1056/NEJMoa1715546
Chi Kim N, Agarwal N, Bjartell A. et al.: Apalutamide for Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med 2019, May 31, 2019, DOI: 10.1056/NEJMoa1903307
Fizazi K, Shore N, Tammela TL et al.: Darolutamide in Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med 2019, Feb 14. DOI: 10.1056/NEJMoa1815671
Julia A. Beaver, M.D., Paul G. Kluetz, M.D., and Richard Pazdur, M.D. Metastasis-free Survival — A New End Point in Prostate Cancer Trials. N Engl J Med 378;26 nejm.org June 28, 2018
info@onco-suisse
- Vol. 10
- Ausgabe 2
- April 2020