- «HER2-low»-Brustkrebs – Neue Optionen und Herausforderungen in Onkologie und Pathologie
Brustkrebs ist weltweit die häufigste Krebsart bei Frauen (1). In der Schweiz wird die Erkrankung jährlich bei mehr als 6000 Frauen diagnostiziert (2). Der Expressionsstatus der Hormonrezeptoren (Estrogenrezeptor, ER; Progesteronrezeptor, PR), des humanen epidermalen Wachstumsfaktor-Rezeptors 2 (HER2), sowie die Proliferationsfraktion Ki67 sind für die Behandlungsstrategie von zentraler Bedeutung, denn die Expression insbesondere von ER, PR und HER2 gibt Auskunft über die Anwendbarkeit zielgerichteter Wirkstoffe. 15-20 % aller Brusttumore zeigen eine starke Überexpression der Rezeptortyrosinkinase HER2, ein Protoonkogen, welches zu besonders aggressiven Karzinomen mit einem hohen Metastasierungs- und Rezidivrisiko führt (3). Entsprechend war die Prognose für die Betroffenen sehr ungünstig, bis zielgerichtete Therapien eine spezifische Hemmung des onkogenen HER2-Signalwegs ermöglichten und so zu einer signifikanten Verbesserung der Überlebensraten beim HER2-positiven Brustkrebs führten (3).
Breast cancer is the most common type of cancer in women worldwide (1). In Switzerland, more than 6000 women are diagnosed with the disease every year (2). The expression status of the hormone receptors (estrogen receptor, ER; progesterone receptor, PR), the human epidermal growth factor receptor 2 (HER2) and the proliferation fraction Ki67 are of central importance for the treatment strategy, as the expression of ER, PR and HER2 in particular provides information on the applicability of targeted agents. 15-20 % of all breast tumors show a strong overexpression of the receptor tyrosine kinase HER2, a protooncogene that leads to particularly aggressive carcinomas with a high risk of metastasis and recurrence (3). Accordingly, the prognosis for those affected was very unfavorable until targeted therapies made it possible to specifically inhibit the oncogenic HER2 signaling pathway and thus led to a significant improvement in survival rates in HER2-positive breast cancer (3).
Key Words: HER2-positive breast cancer, metastatic breast cancer, hormone receptor-positive
Die Behandlung des HER2-positiven Brustkrebs
Die Bestimmung des HER2-Status erfolgt nach den Leitlinien der American Society of Clinical Oncology (ASCO) und dem College of American Pathologists (CAP) aus dem Jahr 2018, und nach der aktualisierten Version aus dem Jahr 2023 (4, 5). Dabei wird die HER2-Expression auf der Oberfläche der Krebszellen mithilfe von immunhistochemischer Färbung (IHC) sichtbar gemacht und mit einem vierstufigen Score von 0 bis 3+ bewertet. Ein IHC-Score von 0 (IHC 0) zeigt eine schwache, inkomplette Färbung bei ≤ 10% der Zellen an. IHC 3+ steht für eine starke, zirkuläre Färbung bei über 10% der Zellen. Zudem soll vor allem bei IHC 2+ mittels In-situ-Hybridisierung (ISH) untersucht werden, ob eine HER2-Genamplifikation vorliegt.
Der therapeutische Nutzen der bisherigen HER2-gerichteten Substanzen war meist auf Karzinome beschränkt, die entweder eine starke (IHC 3+) oder eine mässige HER2-Überexpression mit Genamplifikation (IHC 2+/ISH-positiv) oder eine alleinige ISH-Positivität unabhängig von Proteinexpression aufwiesen. Nur diese Brusttumore gelten daher gemäss den aktuellen ASCO/CAP-Leitlinien als HER2-positiv (4, 5). Für die Betroffenen stehen die monoklonalen Antikörper (mAbs) Trastuzumab und/oder Pertuzumab, meist in Kombination mit Chemotherapie, bereits ab dem neoadjuvanten Therapiesetting bis hin zur palliativen Situation, zur Verfügung. Antikörper-Wirkstoff-Konjugate (ADCs, antibody drug conjugates) sind eine Weiterentwicklung der mAb-Therapien und transportieren zytotoxische Wirkstoffe zielgenau an die Tumorzelle. Das erste HER2-gerichtete ADC Trastuzumab-Emtansin (T-DM1) wird heute im postneoadjuvanten Setting eingesetzt, wenn eine neoadjuvante Systemtherapie nicht zu einer pathologischen Komplettremission führt. Ausserdem war T-DM1 der Therapiestandard für die zweite Behandlungslinie des fortgeschrittenen oder metastasierten HER2-positiven Brustkrebses, bis in der DestinyBreast-03-Studie gezeigt wurde, dass das neuartige ADC Trastuzumab-Deruxtecan (T-DXd) (Abb. 1) im Direktvergleich hinsichtlich des Gesamtüberlebens (OS) signifikant überlegen war und im Juni 2022 in der Schweiz die Zulassungserweiterung für den Einsatz ab der zweiten Linie erhielt (6). Bei Progression der metastasierten Erkrankung unter den genannten Substanzen kommt in späteren Therapielinien auch der Tyrosinkinaseinhibitor Tucatinib in Kombination mit Capecitabin und Trastuzumab zum Einsatz (7).
Die Behandlung von HER2-negativen Tumoren
Tumore mit einem IHC-Score von 1+ oder 2+ ohne HER2-Genamplifikation (ISH-negativ) weisen zwar eine geringe HER2-Expression auf, diese reichte jedoch in der Vergangenheit nicht aus, um ein Ansprechen auf die bisher zur Verfügung stehenden zielgerichteten Therapien zu bewirken. In der 2018er-Ausgabe der ASCO/CAP-Leitlinien zur HER2-Testung wurden diese Tumore daher mit den tatsächlich HER2-negativen Tumoren (IHC 0) zusammengefasst (4). Betroffene werden je nach Expressionsstatus von Estrogen- und Progesteronrezeptor gemäss den Richtlinien für dreifach negativen Brustkrebs (TNBC, triple negative breast cancer) oder Hormonrezeptor (HR)-positiven Brustkrebs behandelt (11).
Bei metastasiertem Brustkrebs mit positivem HR-Status kommen zunächst endokrine Therapien, in der Regel in Kombination mit CDK4/6-Inhibitoren (CDK4/6i), zum Einsatz. Bei Progress richtet sich die weitere Therapie nach dem Vorhandensein von Targets in der Brustkrebszelle, wie ESR1-, PIK3CA- und BRCA-1/2-Mutationen. Sind keine solchen Mutationen vorhanden oder kommt es unter den zielgerichteten Substanzen zum erneuten Progress, gibt es nun neue ADCs, die den Einsatz der klassischen Chemotherapien hin zu späteren Therapielinien verschieben. Unter den klassischen Chemotherapien führen Arzneimittelresistenzen jedoch bereits nach kurzer Zeit zum Progress und die Wirksamkeit der verbleibenden Therapieoptionen ist begrenzt (12, 13).
Für die Behandlung des fortgeschrittenen oder metastasierten (m)TNBC stehen nur wenige zielgerichtete Therapieoptionen zur Verfügung. Bei Vorliegen einer BRCA-Mutation beispielsweise können PARP-Inhibitoren eingesetzt werden. Im Fall einer erhöhten PD-L1-Expression der Tumor- und/oder Immunzellen können Immuntherapien mit Immuncheckpoint-Inhibitoren in Kombination mit einer Chemotherapie wirksam sein (14). Ab der zweiten Therapielinie war die alleinige Chemotherapie jedoch für lange Zeit die einzige Behandlungsoption, mit geringen Ansprechraten und kurzem progressionsfreien Überleben (PFS) (15). Im Rahmen der Phase-III-Studie ASCENT zeigte Sacituzumab Govitecan (SG) bei Patientinnen mit mTNBC ein signifikant verlängertes PFS und Gesamtüberleben (OS) im Vergleich zur Standard-Chemotherapie und wurde infolgedessen in der Schweiz im September 2021 zur Behandlung des mTNBC zugelassen bei Patientinnen, die bereits mindestens zwei Vortherapien hatten, mindestens eine davon im metastasierten Setting (15).
HER2-low Brustkrebs: Das Ende der binären HER2-Klassifizierung
Das ADC T-DXd führte in der Phase-III-Studie DESTINY-Breast04 zu einem signifikant verlängerten PFS und OS im Vergleich zur Chemotherapie bei Mammakarzinomen mit geringer HER2-Expression (IHC 1+ oder IHC 2+/ISH-negativ), welche nach ASCO/CAP-Definition als HER2-negativ eingestuft werden (16). Diese Ergebnisse geben Anlass dazu, die binäre Einteilung der HER2-Klassifizierung zu revidieren und Brustkrebs mit niedriger HER2-Expression als dritte Entität zu erfassen, dem HER2-low-Brustkrebs (11). Etwa die Hälfte aller Karzinome, die bislang nach den Therapieleitlinien für HER2-negativen Brustkrebs behandelt wurden, fallen nun in diese neue Kategorie (Abb. 2) (11). Angesichts dieser grossen Patientinnenpopulation sind die Resultate der DESTINY-Breast04-Studie von enormer klinischer Signifikanz und führten schliesslich zur EMA-, FDA- und Swissmedic-Zulassung von T-DXd für den Einsatz beim HER2-low-Brustkrebs sowie zu einer Empfehlung in den NCCN-, ESMO- und ASCO-Behandlungsleitlinien (5, 17-19) (Abb. 1).
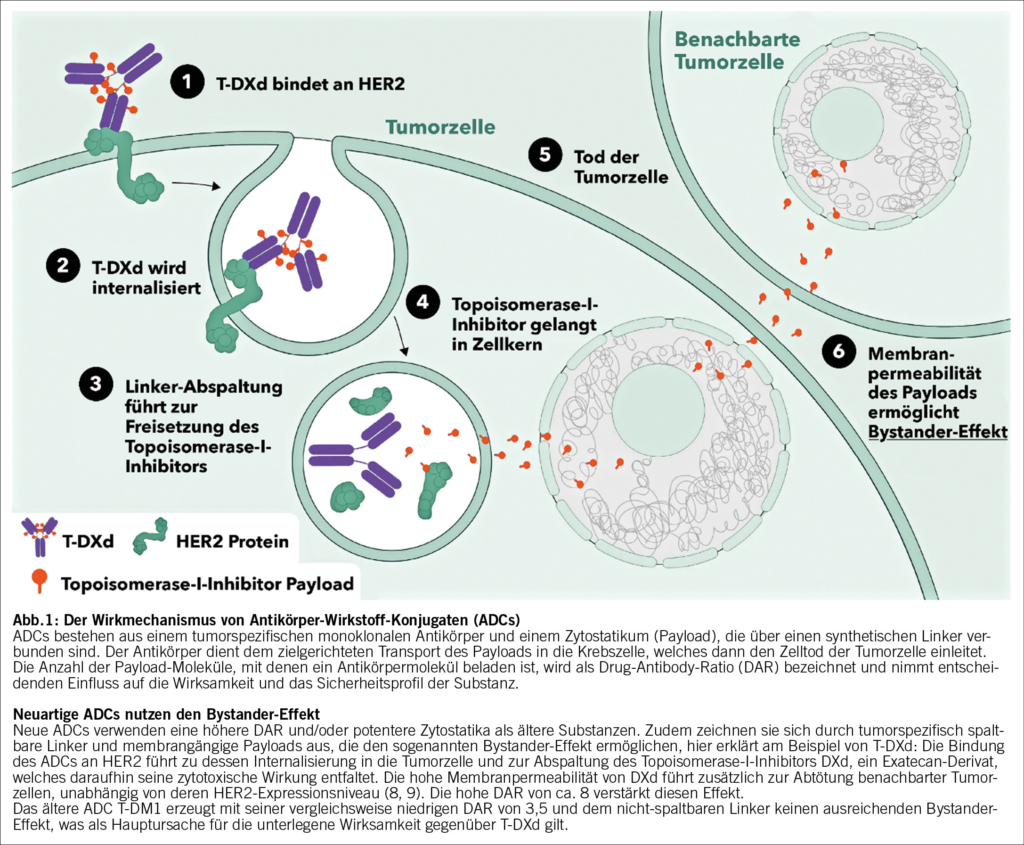

Implikationen für Therapiesequenz und Behandlungsalgorithmen
T-DXd steht nun einer grossen, zuvor als HER2-negativ eingestuften, Population von Patientinnen zur Verfügung und wirft so die Frage der optimalen Behandlungsstrategie auf. Bei Patientinnen mit metastasiertem HR-positivem HER2-low Brustkrebs sprechen die Ergebnisse der DESTINY-Breast04-Studie für den bevorzugten Einsatz von T-DXd nach Ausschöpfen der endokrinen Therapiemöglichkeiten, wobei gemäss Zulassung in der Schweiz aktuell der Einsatz erst nach einer Linie Chemotherapie im metastasierten Setting möglich ist (12). Aktuelle Daten zeigen, dass T-Dxd in diesem Setting auch zu besserem intrakraniellen Ansprechen bei HER2low-Patientinnen führt als andere Behandlungen nach ärztlicher Wahl (20).
Auch im HR-negativen Setting deutet eine explorative Analyse der DESTINY-Breast04-Studie auf einen OS- und PFS-Benefit von T-DXd hin (12). Aufgrund der deutlich robusteren Resultate der ASCENT-Studie bei TNBC-Patientinnen ist SG hier allerdings weiterhin vorzuziehen, T-DXd kommt jedoch nach Progress unter SG bei dieser Patientinnengruppe in Frage.
Zukünftige Studien müssen nun eine empirische Grundlage für die optimale Therapiesequenz von ADCs beim HER2-low Brustkrebs schaffen. Zudem bedarf es neuer klinischer Daten, die das Wirksamkeits- und Sicherheitsprofil neuer ADCs in Kombination mit oralen zielgerichteten Substanzen untersuchen.
Neue ADCs: Therapiemanagement
Das Nebenwirkungsprofil von T-DXd und SG ist vergleichbar mit dem etablierter Chemotherapien, Studienergebnisse deuten aber auf eine Überlegenheit hinsichtlich der gesundheitsbezogenen Lebensqualität hin (21, 22). Gastrointestinale Nebenwirkungen, vor allem Nausea, traten in Studien besonders häufig auf. Um einer einschneidenden Reduktion der Lebensqualität durch Nausea vorzubeugen, empfehlen ASCO und NCCN eine prophylaktische antiemetische Therapie (17, 23, 24).
Wie einige andere onkologische Therapien, birgt auch die Behandlung mit T-DXd ein signifikantes Risiko für die Entwicklung einer interstitiellen Lungenerkrankung (ILD), die tödlich verlaufen kann und zumeist mit unspezifischen Symptomen wie Dyspnoe, Husten oder Fieber beginnt (25). Während eine ILD ersten Grades mit Dosisunterbrüchen und Kortikosteroiden behandelbar ist, erfordern höhere Grade einen Therapieabbruch. Das frühzeitige Erkennen einer ILD bedarf eines proaktiven Managements mit aktiver Überwachung (25-27). Auch eine umfangreiche Aufklärung der Patientinnen über die ersten Anzeichen der ILD ist essenziell, damit sie diese rasch kommunizieren und eine Abklärung inklusive CT-Untersuchung umgehend in die Wege geleitet werden kann (25, 27).
Ob und wie häufig ein ILD-Monitoring bereits bei Patientinnen ohne ILD-Symptome stattfinden sollte und welche bildgebenden Verfahren hierfür geeignet sind, wird derzeit noch in klinischen Studien untersucht. Erste robuste Daten werden von der DESTINY-Breast12-Studie (NCT04739761) erwartet, in der regelmässige CT-Untersuchungen zum Zwecke des Tumor-Stagings und der ILD-Überwachung durchgeführt werden. Auch ein besseres Verständnis der Pathophysiologie ist erforderlich, um ILD-Risikogruppen gezielter identifizieren und überwachen zu können.
HER2-Testung: Neue Herausforderungen für die Pathologie
Neue Substanzen haben den Untersuchungsauftrag der Pathologie um die zuverlässige Abgrenzung HER2-niedrigexprimierender Karzinome von vollständig HER2-negativen erweitert. Dabei behält die in den ASCO/CAP-Leitlinien definierte HER2-Einteilung nach vier IHC-Scores zunächst ihre Gültigkeit und auch die Ermittlung dieser Scores erfolgt weiterhin über das etablierte Verfahren in drei Schritten, welches die Anwendung der sogenannten Objektivregel, die Prüfung auf Zirkularität und Stärke der Membranfärbung und die Ermittlung des Prozentsatzes der HER2-exprimierenden Zellen umfasst. Allerdings ist die Angabe, ob ein HER2-negatives oder -positives Karzinom vorliegt, für die Therapieentscheidung laut aktualisierten Leitlinien nicht mehr ausreichend. Vielmehr sollte im histologischen Bericht der konkrete IHC-Score und gegebenenfalls auch das ISH-Resultat festgehalten werden, damit eine klare Unterscheidung zwischen IHC 0 und IHC 1+ sowie IHC 2+ /ISH-negativ getroffen werden kann (5, 19). Die Autor/-innen der neuen ASCO/CAP-Leitlinien befinden es allerdings als verfrüht, die Terminologie für eine geringere HER2-IHC-Expression auf «HER2-low» zu ändern. Stattdessen empfehlen sie eine Fussnote in den Bericht einzufügen, in der zwischen HER2-Tumoren mit Überexpression/Amplifikation und solchen mit geringer Expression unterschieden wird. Sie raten Patholog/-innen Anstrengungen zu unternehmen, um vor allem IHC 1+ Ergebnisse von 0 zu unterscheiden, indem sie z. B. HER2-IHC mit hoher Brechkraft (40x) untersuchen, eine zweite Überprüfung bei knapper Diagnose in Betracht ziehen, und Kontrollen verwenden, um sicherzustellen, dass der Assay eine angemessene Nachweisgrenze hat (5).
Die Leitlinien der NCCN, ESMO und ASCO für die Behandlung des Mammakarzinoms haben die neue Entität des HER2-low-Brustkrebs bereits in ihre Empfehlungen aufgenommen. Es ist davon auszugehen, dass dies in den Leitlinien zur HER2-Testung in Zukunft auch Berücksichtigung finden wird. In der aktuellen Revision der französischen GEFPICS-Guidelines wurde die HER2-Dichotomie bereits aufgegeben, zugunsten der klinisch relevanten Dreiteilung in HER2-negative, HER2-positive und HER2-low-Karzinome (28). Auch in den Leitlinien der AGO-Kommission Mamma ist die Entität des HER2-low-Brustkrebs seit 2023 aufgenommen (29).
Die Limitationen immunhistochemischer Nachweisverfahren
Immunhistochemische Verfahren sowie ISH bilden derzeit die einzig validierte Grundlage für die HER2-Testung.
Insbesondere zur Identifizierung jener Tumore mit sehr niedrigen HER2-Expressionsniveau können IHC-Assays jedoch infolge der Formalinfixierung, die zu einem Verlust von HER2-Molekülen führt, ungeeignet sein, da ein IHC-Score von 0 in diesem Fall das Resultat eines technischen Artefaktes wäre. Eine Reevaluierung der Eignung immunhistochemischer Nachweisverfahren für die zuverlässige Identifizierung von HER2-low-Karzinomen ist daher sinnvoll. Weitere Testverfahren wie next generation sequencing (NGS), RNA-Nachweis und RT-qPCR sollten erst in klinischen Studien evaluiert werden, bevor sie als Standardverfahren für HER2-Testung in den Richtlinien genehmigt werden. Bis neue Methoden zur HER2-Testung validiert wurden, sollten IHC-Testungen stets mit den standardisierten und von der FDA zugelassenen Assays HercepTest (Agilent) und dem Ventana 4B5-Testkit durchgeführt werden, um so die Validität und Reproduzierbarkeit der HER2-Bestimmung zu gewährleisten.
Gezielte Schulungsprogramme und Ringversuche zur Erhöhung der Konkordanz
Frühere Untersuchungen ergaben bei der Bewertung eines Karzinoms als IHC 0 oder 1+ eine Konkordanz von lediglich 26%, wobei diese Analysen zu einem Zeitpunkt stattfanden, als die Unterscheidung noch keine therapeutischen Implikationen hatte (30, 31). Daher ist zu erwarten, dass die Konkordanz mit dem Bewusstsein über die neue Behandlungsindikation bei IHC 1+ Karzinomen deutlich ansteigen wird.
Zur Qualitätskontrolle sollten Ringversuche, die bei HER2-positiven Karzinomen bereits etabliert sind, auch auf HER2-low Karzinome ausgeweitet werden. Zudem sollte die Evaluierung vor allem in der Anfangsphase unter Einbezug erfahrener Brustpatholog/-innen erfolgen. Patholog/-innen sollten darüber hinaus gezielte Schulungsangebote für die Unterscheidung zwischen IHC 0 und IHC 1+ Karzinomen nutzen. In der Schweiz haben zu diesem Zweck bereits zwei virtuelle TARGOS-Trainings stattgefunden.
Ausblick: Wie «low» können wir gehen?
Angesichts der gesteigerten Wirksamkeit neuer HER2-gerichteter Therapien stellt sich die Frage, wo die therapeutisch relevante Grenze zwischen IHC 0 und IHC 1+ tatsächlich verläuft. Aktuelle Analysen der DAISY-Studie im HR-negativen Setting deuten darauf hin, dass selbst Patientinnen mit einem IHC-Score von 0 noch von T-DXd profitieren (32). Die Phase-III-Studie DESTINY-Breast06 (NCT04494425) widmet sich nun gezielt der Frage, wie sich T-DXd bei HR-positivem, metastasierten Brustkrebs auswirkt, der einen HER2 IHC-Score von >0 und <1+ aufweist.
Zudem befinden sich weitere Substanzen in der klinischen Entwicklung, darunter ADCs wie Disitamab-Vedotin und Trastuzumab-Duocarmacin, sowie bispezifische und trispezifische mAbs und HER2-Vakzinen, die bei niedrigen HER2-Expressionsniveaus vielversprechende Aktivität zeigen und die etablierten diagnostischen Verfahren und Kategorien weiter auf den Prüfstand stellen (33).
Copyright Aerzteverlag medinfo AG
Interdisziplinäres Brustzentrum Kantonsspital Baden
Frauenklinik, Kantonsspital Baden
Im Ergel 1
5404 Baden
Institut für Pathologie und Molekularpathologie
Universitätsspital Zürich
Schmelzbergstrasse 12
8091 Zürich
Daiichi Sankyo (Schweiz) AG und AstraZeneca AG haben die Erstellung des Artikels initiiert und die finanziellen Ressourcen für einen Medical Writer zur Unterstützung der Autorinnen zur Verfügung gestellt. Daiichi Sankyo (Schweiz) AG und AstraZeneca AG hatten keinen Einfluss auf den Inhalt der Publikation.
info@onco-suisse
- Vol. 14
- Ausgabe 3
- Juni 2024







