- Hochdosistherapie mit autologem Ersatz hämatopoetischer Stammzellen
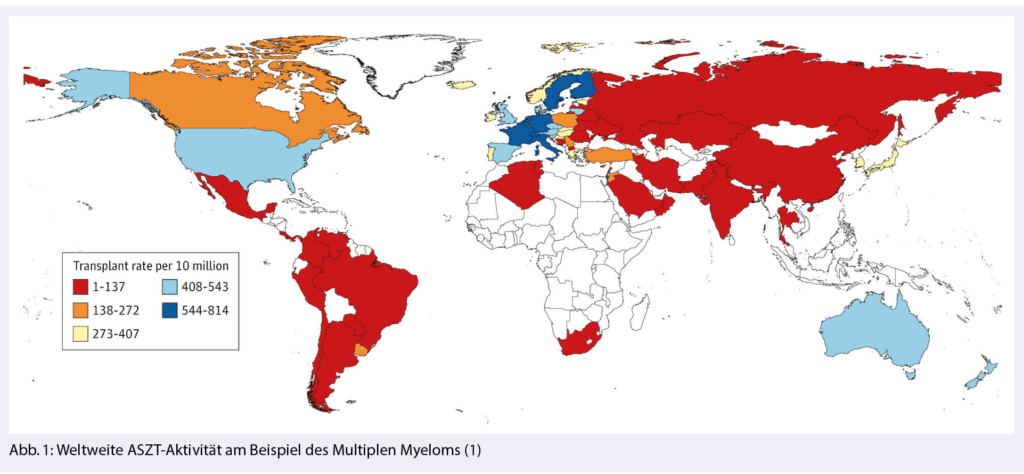
Die hämatopoetische Stammzelltransplantation ist ein seit ca. 40 Jahren etabliertes Verfahren und wird an speziell ausgebildeten und akkreditierten Zentren in der Schweiz und den meisten westlichen Ländern durchgeführt (1) (Abb. 1). Ihr Stellenwert in der Behandlung hämato-onkologischer wie auch Autoimmunerkrankungen ist in den letzten Jahren zunehmend gewachsen und sie konnte sich bisher auch im Zeitalter neuer Immun- und Zelltherapien behaupten.
La transplantation de cellules souches hématopoïétiques est une procédure établie depuis environ 40 ans et est réalisée dans des centres spécialement formés et accrédités en Suisse et dans la plupart des pays occidentaux (1) (fig. 1). Son importance dans le traitement des maladies hémato-oncologiques et auto-immunes s’ est accrue ces dernières années et elle a pu s’ affirmer à l’ ère des nouvelles thérapies immunitaires et cellulaires.
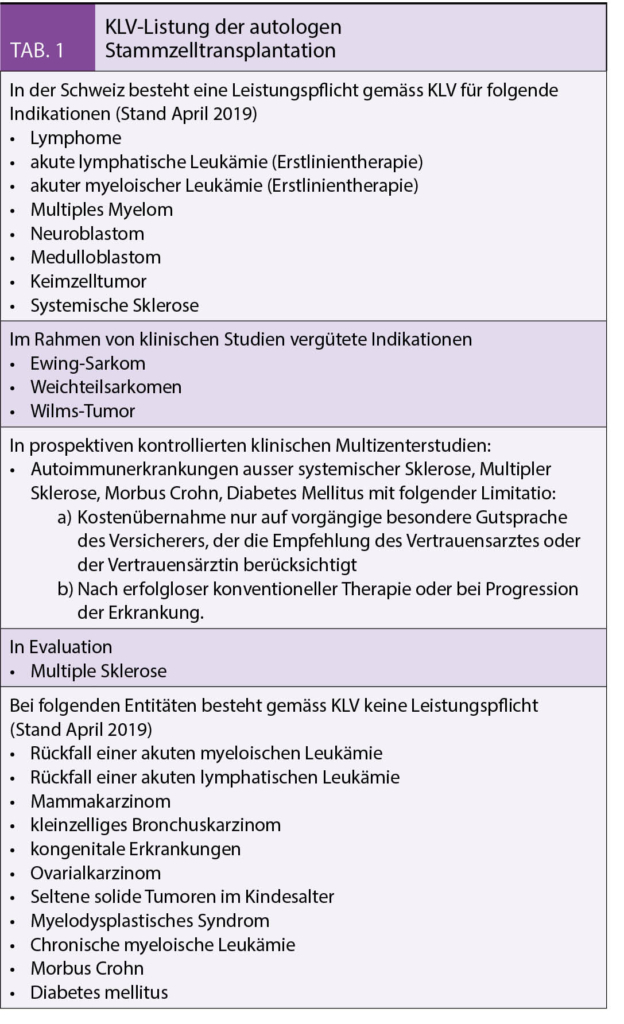
Die Krankenpflege-Leistungsverordnung (KLV) regelt in der Schweiz die Leistungen der obligatorischen Krankenpflegeversicherung und legt auch den Leistungskatalog für die ASZT fest (Tab. 1). Dabei gibt es neben den generell akzeptierten hämato-onkologischen Entitäten auch mögliche Einsatzgebiete bei soliden Tumoren und Autoimmunerkrankungen.
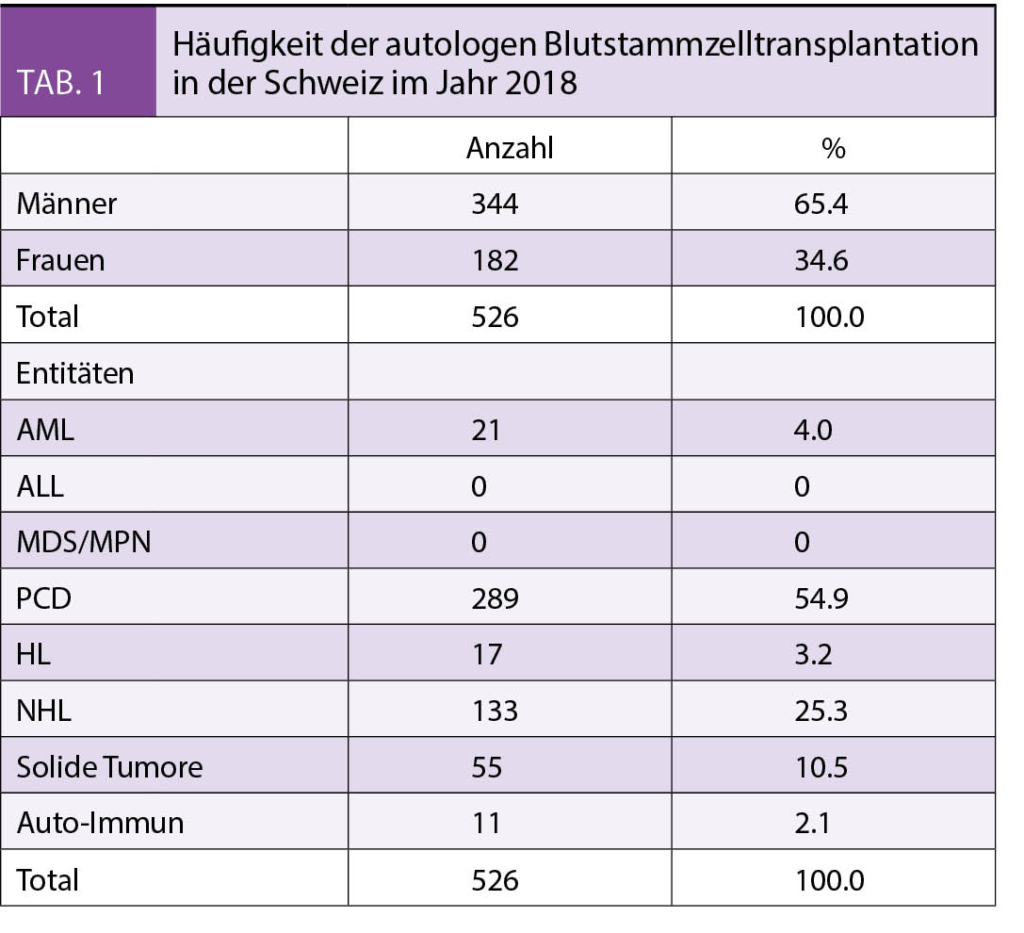
Im Jahre 2018 wurden in der Schweiz insgesamt 526 Patienten mit einer Hochdosistherapie (HDT) und einer Autologen Stammzelltherapie (ASZT) behandelt (www.blutspende.ch, Jahresbericht 2018). Vergleicht man die ASZT Aktivitäten über die letzten Jahre, so lässt sich eine stetige Zunahme dokumentieren. Betrug die Anzahl an Patienten 2015 noch 473, so waren es im Jahre 2017 bereits 485 und 2018 die bereits genannten 526 Patienten. Von den 526 Patienten waren 344 (65%) Männer und 182 (35%) Frauen, 17 Patienten waren zum Zeitpunkt der Transplantation jünger als 18 Jahre. In der Altersverteilung dominiert die 6. bis 7. Lebensdekade mit 148 bzw. 194 Patienten. Bei den Erwachsenen-Patienten dienten ausschliesslich periphere Blutstammzellen als Stammzellquelle. Von den 526 Patienten erhielten 406 Patienten (77%) zum ersten Mal eine Transplantation, die restlichen 120 (23%) Patienten wurden bereits vorgängig mind. einmal mit einer Transplantation behandelt. Bei der Verteilung der 526 Patienten auf einzelne Entitäten sind Plasmazellerkrankungen gefolgt von Lymphomen führend (Tab. 2). Im folgenden möchte ich nun kurz die Datengrundlage als auch die gängigen Therapieempfehlungen für die häufigsten hämato-onkologischen Entitäten im Erwachsenenalter darlegen.
Myelome
Bei jungen fitten Myelom-Patienen gilt die HDT mit Melphalan (100 bis 200 mg/m2) gefolgt von einer ASZT fast immer als Standard im Rahmen der Erstlinientherapie (sog. TE ndMM Patienten). Die Definition eines jungen bzw. fitten Patienten hat sich in den letzten Jahren gewandelt und wird nicht einheitlich gehandhabt. Im Gegensatz zu früher, sollten nicht mehr alleine das Alter sondern insbesondere bestehende Komorbiditäten Berücksichtigung finden. Grundlage für den frühen Einsatz der Transplantation sind vornehmlich Studien der französischen IFM Studiengruppe (2). Sie konnten zeigen, dass die Ansprechrate für Myelom-Patienten nach HDT und ASZT mit 81% gegenüber 57% in der Kontrollgruppe signifikant erhöht war (P < 0,001). Die Wahrscheinlichkeit eines Ereignis-freien Überlebens (EFS) über 5 Jahre betrug in der Hochdosisgruppe 28% und in der konventionellen Dosisgruppe 10% (P = 0,01). Die geschätzte Gesamtüberlebensrate (OS) für 5 Jahre betrug in der Gruppe mit hohen Dosen 52% und in der Gruppe mit konventioneller Behandlung 12% (P = 0,03). Die behandlungsbedingte Mortalität war in beiden Gruppen ähnlich und zeigte damit keine signifikant höhere langfristige Toxizität im Transplantationsarm.
Als nächstes analysierte die IFM Gruppe die Bedeutung einer Doppeltransplantation, d.h. eine Wiederholung der HDT mit ASZT innerhalb von 2-3 Monaten (3). So erhöhte sich die Wahrscheinlichkeit, nach der Diagnose 7 Jahre lang ereignisfrei zu überleben von 10% in der Gruppe mit einfacher Transplantation auf 20% in der Gruppe mit doppelter Transplantation (P = 0,03). Das geschätzte OS nach 7 Jahren stieg von 21% in der Einzeltransplantationsgruppe auf 42% in der Doppeltransplantationsgruppe (P = 0,01). Zeigten Patienten innerhalb von drei Monaten nach einer Transplantation keine sehr gute partielle Remission (VGPR), so betrug das 7-Jahre OS in der Gruppe mit einer Transplantation 11% und 43% in der Gruppe mit zwei Transplantationen (P < 0,001). Damit weisen insbesondere Patienten mit unzureichendem Ansprechen nach einer Transplantation einen Benefit auf. Heutzutage wird neben einem unzureichenden Ansprechen das genetische Risikoprofil häufig als Diskriminator genommen, um Patienten mit einer sog. Hochrisiko-Zytogenetik eine Doppeltransplantation zu empfehlen. Auch wenn sich die Art der Induktionstherapien in den letzten 15 Jahren gewandelt hat, so konnte sich die Hochdosistherapie mit autologer Stammzelltransplantation bis zum heutigen Tag noch immer als wichtiger Baustein in der Erstlinientherapie jüngerer bzw. fitterer Myelom-Patienten behaupten. Gemäss der kürzlich am ASCO 2019 präsentierten FORTE Studie (4) kann eine 12 monatige konventionelle Therapie mit Kyprolis, Revlimid und Dexamethason (KRD) zwar ähnlich hohe Ansprechraten wie eine KRD Induktion (4 Zyklen) gefolgt von einer HDT mit ASZT (und dann nochmals 4 Zyklen KRD Konsolidation) erreichen, die Tiefe des Ansprechens war aber im ASZT Arm höher und es kam zu weniger Frührezidiven. Damit gilt die ASZT weiterhin als fester Bestandteil in der Erstlinientherapie TE ndMM Patienten.
Auch im ersten Rezidiv einer Myelomerkrankung ist die Transplantation bei fitteren Patienten etabliert und akzeptiert. Hier gilt die Faustregel, dass eine Krankheitskontrolle durch die erste Hochdosistherapie mit autologem Stammzellersatz für mind. 18-24 Monate erreicht sein sollte, um dann im Rezidiv bei erneuter Krankheitsprogression eine zweite Hochdosistherapie mit Transplantation propagieren zu können.
Lymphome
In der Lymphombehandlung ist aufgrund der Vielzahl an Entitäten mit zum Teil recht unterschiedlicher Pathogenese und Prognose das Einsatzgebiet der HDT mit ASZT sehr indivuell zu betrachten. Die Rezidivtherapie aggressiver Lymphome (inkl. Patienten mit Hodgkin Lymphom und zum Teil auch follikulärem Lymphom) gilt jedoch als klassisches Einsatzgebiet. Entsprechende Studien aus den 90iger Jahren des letzten Jahrhunderts belegten die Wirksamkeit der HDT mit ASZT, auch wenn z. T. nur etwas mehr als 50 Patienten pro Arm behandelt wurden (5). Verglichen mit einer konventionellen Therapie (ST) zeigte die HDT gefolgt von einer ASZT eine Verbesserung des 5-Jahres OS mit 53% zu 32% in der ST-Gruppe (P = 0,038). Mehrere Forscher haben die Verwendung der ASZT-Konsolidierung in der Erstlinientherapie aggressiver Lymphome (vornehmlich diffuser aggressiver B-Zell Lymphome (DLBCL) untersucht und zum Teil widersprüchliche Daten generiert (6, 7). Damit ist die HDT mit ASZT in der Rezidivtherapie akzeptiert, ihr Stellenwert in der Erstlinientherapie jedoch weiterhin umstritten.
Relativ unstrittig ist der Einsatz der HDT mit ASZT in der Erstlinientherapie des jüngeren bzw. fitteren Patienten mit Mantelzell- (MCL) oder auch primärem ZNS-Lymphom (PCNSL). Beides sind eher seltenere Entitäten (ca. 6 bzw. 1-2% aller Lymphomentitäten), scheinen aber von der frühen Dosiseskalation mit Stammzellersatz zu profitieren. In der MCL Behandlung wurde dieses Konzept zunächst vom europäischen MCL Netzwerk (EU MCL) positiv getestet (8): Patienten im HDT mit ASZT-Arm hatten ein signifikant längeres progressionsfreies Überleben (PFS) mit einem Median von 39 Monaten im Vergleich zu 17 Monaten im Kontrollarm (P = 0,0108). Das 3-Jahres-OS zeigte jedoch keinen signifikanten Unterschied (83% vs. 77%, P = 0,18). Die Bedeutung der HDT mit ASZT in der MCL-Erstlinientherapie wurde inzwischen in prospektiven Studien sowohl der französischen (LYMA (9)) als auch nordischen (NORDIC (10)) Arbeitsgruppe bestätigt. Durch die Hinzunahme einer Rituximab-Erhaltungstherapie konnte in der LYMA MCL Studie zudem ein OS Benefit belegt werden. Damit ist der Behandlungskomplex bestehend aus einer Induktions Immun-Chemotherapie gefolgt von einer HDT mit ASZT und anschliessender Rituximab Erhaltung der derzeitige Standard bei fitten MCL Patienten. Es ist offen und Gegenstand laufender Studien, ob neuere zielgerichtetere Medikamente die HDT mit ASZT in diesem Behandlungskomplex ersetzen werden.
Solide Tumoren
Erwachsene Patienten mit Keimzell-Tumoren des Hodens stellen innerhalb der Gruppe solider Tumoren mit Einsatz einer HDT und ASZT das grösste Kollektiv dar. Im Rahmen von Studienprotokollen werden auch andere Entitäten wie z.B. Sarkome (Ewing-Sarkome) behandelt. Die HDT mit ASZT wird bei männlichen Keimzell-Tumoren seit den 80iger Jahren des letzten Jahrhunderts eingesetzt, da auch dieser Tumor prinzipiell eine Chemotherapie-empfindliche Erkrankung darstellt und somit von einer Eskalation der Chemotherapie-Intensität profitieren könnte. Kleinere Phase-II-Studien bzw. retrospektive Vergleiche hatten in der Erstlinien-Therapie für Patienten mit ungünstiger Prognose den Einsatz der HDT mit ASZT nahegelegt. In einer prospektiven randomisierten Studie konnte jedoch kein eindeutiger Vorteil belegt werden und damit wird dieses Therapieverfahren nicht generell empfohlen. Dies ist im Gegensatz zur Rezidivsitutation, wobei die Empfehlungen zum grössten Teil auf Phase-II-Studien bzw. auch hier retrospektiven Analysen beruhen. Eine multizentrische retrospektive Analyse von 1594 auswertbaren Patienten (11) verglich die Standard- und Hochdosis-Chemotherapie und zeigte im 2-Jahres PFS (49,6% vs. 27,8% (HR = 0,44; P < 0,001)) und 5-Jahres OS (53,2% vs. 40,8% (HR = 0,65; P < 0,001)) einen signifikanten Vorteil für den HDT mit ASZT Arm in allen prognostischen Gruppen mit Ausnahme der Niedrigrisikogruppe. Dabei werden sequenziell bis zu 3 HDT mit ASZT konsekutiv durchgeführt (12).
Onkozentrum Hirslanden Zürich und Onkozentrum Zürich
Witellikerstrasse 40
8032 Zürich
Christoph.renner@hirslanden.ch
Der Autor hat in Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Zum jetzigen Zeitpunkt ist die HDT mit ASZT eine etablierte und akzeptierte Behandlungsmodalität für eine Vielzahl Chemotherapie-empfindlicher Malignome.
- Es ist Gegenstand laufender Studien, Stammzelltransplantationen mit neuen Zelltherapien wie z.B. umprogrammierten T-Zellen (sog. CAR T-Zellen) zu vergleichen.
- Dabei wird ein besonderer Fokus auf eine Reduktion der Nebenwirkungen bei hoffentlich noch weiter gesteigerter Wirksamkeit gelegt werden.
Messages à retenir
- À l’ heure actuelle, la thérapie à forte dose suvie par une transplantation autologue de cellules souches est une modalité de traitement établie et acceptée pour une large gamme de tumeurs malignes sensibles à la chimiothérapie.
- Des études sont en cours pour comparer les autogreffes de cellules souches avec de nouvelles thérapies cellulaires telles que les cellules T reprogrammées (cellules dites CAR T).
- Une attention particulière sera accordée à la réduction des effets secondaires tout en espérant améliorer encore l’ efficacité.
1. Cowan AJ et al. Global Burden of Multiple Myeloma: A Systematic Analysis for the Global Burden of Disease Study 2016. JAMA Oncol. 4(9), 1221-1227 (2018).
2. Attal, M. et al. A prospective, randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. Intergroupe Francais du Myelome. N. Engl. J. Med. 335, 91–97 (1996).
3. Attal, M. et al. Single versus double autologous stem-cell transplantation for multiple myeloma. N Engl J Med. 349(26), 2495-2502 (2003).
4. Gay, F. et al. Efficacy of carfilzomib lenalidomide dexamethasone (KRd) with or without transplantation in newly diagnosed myeloma according to risk status: Results from the FORTE trial. J Clin Oncol 37, suppl; abstr 8002 (2019).
5. Philip, T. et al. Autologous bone marrow transplantation as compared with salvage chemotherapy in relapses of chemotherapy-sensitive non-Hodgkin’s lymphoma. N Engl J Med. 333(23), 1540-1545 (1995).
6. Stiff PJ, Unger JM, Cook JR, Constine LS, Couban S, Stewart DA, Shea TC, Porcu P, Winter JN, Kahl BS, Miller TP, Tubbs RR, Marcellus D, Friedberg JW, Barton KP, Mills GM, LeBlanc M, Rimsza LM, Forman SJ, Fisher RI. Autologous transplantation as consolidation for aggressive non-Hodgkin’s lymphoma.
N Engl J Med. 369(18), 1681-1690 (2013)
7. Schmitz, N. et al. Conventional chemotherapy (CHOEP-14) with rituximab or high-dose chemotherapy (MegaCHOEP) with rituximab for young, high-risk
patients with aggressive B-cell lymphoma: an open-label, randomised, phase
3 trial (DSHNHL 2002-1). Lancet Oncol. 13(12), 1250–1259 (2012).
8. Dreyling, M. et al. Early consolidation by myeloablative radiochemotherapy
followed by autologous stem cell transplantation in first remission significantly prolongs progression-free survival in mantle-cell lymphoma: results of a prospective randomized trial of the European MCL Network. Blood. 105(7), 2677-2684 (2005).
9. Le Gouill, S. et al. Rituximab after Autologous Stem-Cell Transplantation in
Mantle-Cell Lymphoma. N Engl J Med. 377(13),1250-1260 (2017).
10. Eskelund, C.W. et al. 15-year follow-up of the Second Nordic Mantle Cell Lymphoma trial (MCL2): prolonged remissions without survival plateau. Br J Haematol. 175(3), 410-418 (2016).
11. Lorch, A. et al. Conventional-dose versus high-dose chemotherapy as first salvage treatment in male patients with metastatic germ cell tumors: evidence from a large international database. J Clin Oncol. 29(16), 2178-2184 (2011).
12. Einhorn, L. et al. High-dose chemotherapy and stem-cell rescue for metastatic germ-cell tumors. N Engl J Med. 357(4), 340-348 (2007).
info@onco-suisse
- Vol. 9
- Ausgabe 4
- August 2019