- Immun- und Radiotherapie beim Melanom
Jedes Jahr erkranken in der Schweiz rund 2700 Menschen an einem Melanom. Dies entspricht ungefähr 7% aller Krebserkrankungen und macht das Melanom zur fünfthäufigsten Krebsart. Die UV-Strahlung mit Ihrer DNA-schädigenden Wirkung gilt als eine der Hauptursachen für die Melanom-Entstehung und der optimale Sonnenschutz gilt als die wichtigste präventive Massnahme. Die Früherkennung ist wegen der Neigung zur Metastasierung ein wichtiges Instrument um die Prognose günstig zu beeinflussen. In den fortgeschrittenen Tumorstadien und bei nodalem Befall kommen neben der Chirurgie die Immuntherapie oder die Radiotherapie als weitere Massnahmen zur Verbesserung der Tumorkontrolle in Frage.
Chaque année, environ 2700 personnes en Suisse développent un mélanome. Cela correspond à environ 7 % de tous les cancers et fait du mélanome le cinquième type de cancer le plus fréquent. Le rayonnement UV avec son effet néfaste pour l’ADN est considéré comme l’ une des principales causes du mélanome et une protection solaire optimale est considérée comme la mesure préventive la plus importante. En raison de sa tendance aux métastases, la détection précoce est un instrument important pour influencer positivement le pronostic. Aux stades avancés de la tumeur et en cas d’infestation nodale, l’ immunothérapie ou la radiothérapie peuvent être considérées comme des mesures supplémentaires pour améliorer le contrôle de la tumeur en plus de la chirurgie.
The melanoma is completely excised whenever possible, with the extent of the operation on breslow tumor thickness (in millimeters), mitotic rate, and possible ulceration. Surgical repair should be done within two weeks of the suspected diagnosis. A previous trial biopsy performed without deteriorating the prognosis compared to primary total excision. The melanoma in situ is located at a safety distance of 0.5 cm. If the invasion depth of Breslow is <1 mm, the recommended safety distance is 1 cm, for Breslow ≥ 1 mm or> 0.8 mm with ulceration, the safety margins are 1 cm (<2 mm) and 2 cm (> 2 mm) Sentinel lymph node biopsy (SLNB) comes from an invasion depth after Breslow ≥ 1 mm or> 0.8 mm with ulceration into consideration and should be performed at a center with experience. If there is an invasion depth of Breslow> 4 mm or status after lymph node metastases, a staging examination should be performed before the SLNB using PET-CT or whole-body CT. If not distant metastases are present, the excision with 2 cm distance and the SLNB is recommended. If distant metastases are present, it is advisable to evaluate the patients for systemic therapy (immunotherapy) (1). If not distant metastases are present, the excision with 2 cm distance and the SLNB is recommended. If distant metastases are present, it is advisable to evaluate the patients for systemic therapy (immunotherapy) (1).If not distant metastases are present, the excision with 2 cm distance and the SLNB is recommended. If distant metastases are present, it is advisable to evaluate the patients for systemic therapy (immunotherapy) (1).
The role of radiotherapy in the treatment of melanoma
Since the successful application of immunotherapy, the role of radiotherapy in melanoma has improved over the last few years to improve both local and regional tumor control. Despite the success of immunotherapy, radiotherapy in selected situations is justified in the multidisciplinary treatment of affected patients.
Als alleinige Therapie anstelle der Chirurgie kommt die Bestrahlung beim Lentigo-maligna-Melanom (LMM) in Frage. Die Patientengruppe mit LMM sind in der Regel in fortgeschrittenem Lebensalter und präsentieren sich nicht selten mit grossflächigem Befall im Gesichtsbereich. Die Radiotherapie führt in dieser Population bezogen auf das kosmetische und funktionelle Resultat oft zu besseren Ergebnissen als die primäre Exzision bei vergleichbarer lokaler Tumorkontrolle (2, 3). Das LMM wird je nach Grösse und Lokalisation mit einer hypofraktionierten Radiotherapie über wenige Wochen behandelt, was dem Patientenkomfort Rechnung trägt.
Eine spezielle Stellung nimmt das uveale Melanom ein. In enger Zusammenarbeit mit der Ophthalmologie erfolgt die primäre Radiotherapie mit Protonen an hierfür spezialisierten Zentren, was den organ-erhaltenden Ansatz erlaubt (4, 5).
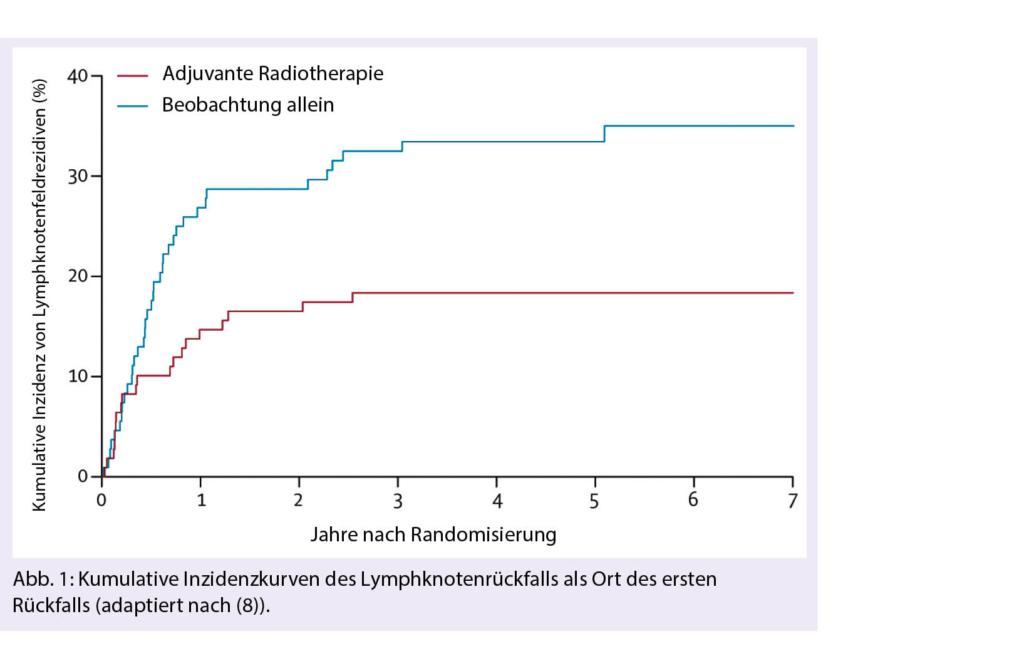
Bei Patientinnen und Patienten, welche sich mit einem lymphogen metastasierendem Melanom präsentieren, wird die Radiotherapie als adjuvante Massnahme nach kompletter regionärer Lymphadenektomie zur Verbesserung der regionären Tumorkontrolle angewendet. Die randomisierte Phase 3 Studie der Trans-Tasman Radiation Oncology Group (TROG) untersuchte den Stellenwert der postoperativen moderat hypofraktionierten Radiotherapie (48 Gy in 20 Sitzungen) der betroffenen regionären Lymphknotenstationen und konnte zeigen, dass diejenigen Patientinnen und Patienten mit hohem Rezidivrisiko (Befall von mindestens 1 Lymphknoten parotideal, mindestens 2 Lymphknoten zervikal oder axillär und mindestens 3 Lymphknoten inguinal oder Grösse des Lymphknotens ≥ 3 cm zervikal und ≥ 4 cm axillär oder inguinal) von einer adjuvanten Radiotherapie profitierten. Nach einer medianen Beobachtungszeit von 6 Jahren zeigten Patientinnen und Patienten in der Radiotherapiegruppe (n = 109) gegenüber der Beobachtungsgruppe (n = 108) signifikant weniger Erstrezidive in den regionären Lymphknoten als auch Rezidive im gesamten Beobachtungszeitraum (18% versus 33%). Bezogen auf die isolierten Rezidive in den regionären Lymphknotenstationen war der Unterschied mit 8.3% versus 23% noch deutlicher. Mit Blick auf die Fernmetastasierung, dem rezidivfreien Überleben oder Gesamtüberleben ergaben sich keine Unterschiede. Im Radiotherapiearm kam es zu häufigeren, jedoch geringgradig ausgeprägten subkutanen Fibrosierungen sowie Lymphödemen der unteren Extremitäten nach Therapie im Inguinalbereich (15% versus 7.7%) was die Lebensqualität beeinträchtigte (6-8). Aufgrund dieser Ergebnisse kann bei ausgewählten Patientinnen und Patienten mit lymphogen metastasierendem Melanom und einem hohen regionären Rezidivrisiko eine adjuvante Radiotherapie in Betracht gezogen werden, wenn auch der Preis eine höhere Morbidität darstellt (9) und die Studie in der Ära vor der zielgerichteten und immunologischen Therapie geplant und durchgeführt wurde.
Obwohl das Melanom als ein wenig radio-sensitiver Tumor gilt zeigt der Blick in die aktuelle Literatur, dass die Kombination der Radiotherapie mit der Immuntherapie synergistisch zu wirken scheint und neue Therapieansätze erlauben mit vielversprechenden Resultaten aus vorwiegend noch Phase 1 Studien (10). Die Kombination von Radiotherapie und dem CTLA-4 Inhibitor Ipilimumab führt beim fortgeschrittenen Melanom zu einem sogenannten apskopalen Effekt mit Verstärkung der anti-tumor Immunantwort und Regression von Metastasen auch ausserhalb des Radiotherapiefeldes und entfernt vom primären Tumorherd. Koller et al. zeigte in einer retrospektiv durchgeführten Analyse bei 101 Patienten, dass die Kombination Ipilimumab/Radiotherapie (n=70) sowohl das Gesamtüberleben (19 Monate versus 10 Monate) als auch das Progressions-freie Überleben (5 Monate versus 3 Monate) günstig beeinflusste ohne Erhöhung der Toxizität (11). Dieser synergistische Effekt wird noch verstärkt mit der Anwendung neuer Radiotherapietechniken wie der stereotaktischen ablativen Radiotherapie mit hohen Einzeldosen pro Fraktion, was zu vermehrten letalen DNA-Strangbrüchen in der Tumorzelle mit Zelltod sowie Schädigung der Tumorgefässversorgung führt. Dies wiederum verstärkt die Immunantwort aufgrund der erhöhten Freisetzung von Tumor-Antigenen (Cancer-Immune Cycle (12)) und macht die Kombination der Radiotherapie mit der Immuntherapie sehr vielversprechend (13, 14). Bevor die Kombinationstherapien mit Radiotherapie und Immuntherapie im klinischen Alltag zur Anwendung kommen, müssen die Resultate der laufenden klinischen Studien abgewartet werden und Patientinnen und Patienten sollten zur Zeit nur innerhalb von Protokollen behandelt werden, um die Sicherheit der Kombinationsbehandlungen zu überprüfen und mehr über die möglichen Nebenwirkungen zu erfahren, gerade auch bei Patientinnen und Patienten mit Hirnmetastasen, wo eine rege Forschungsaktivität herrscht (15-17).
Eine weiterhin bedeutende Rolle hat die Radiotherapie in der Behandlung von symptomatischen Hirnmetastasen, welche beim Melanom gehäuft vorkommen(18). Hier sind vor allem die Fortschritte der stereotaktischen Radiotherapie, als Einzelfraktion (Radiochirurgie) oder über wenige Sitzungen, mit Verlassen der Ganzhirnbestrahlung zugunsten der verbesserten Lebensqualität der Betroffenen. Diese hochpräzise Radiotherapie hat die Behandlung von Hirnmetastasen revolutioniert hinsichtlich der verbesserten lokalen Tumorkontrolle als auch der besseren Verträglichkeit für die betroffenen Patientinnen und Patienten gegenüber der Ganzhirnbestrahlung (19-21).
Die Rolle der Immuntherapie in der Behandlung des Melanoms bei ZNS Metastasen
(Literatur beim Verfasser)
Der Fokus wird auf die Rolle der Immuntherapie bei Hirnmetastasen gelegt. Das Hirn ist natürlicherweise von der Blut Hirnschranke geschützt. Nach einer Metastasierung ist diese Blut Hirnschranke gestört. Derweil in der Ära der Chemotherapie beim Melanom die alleinige Radiotherapie die Standard Behandlung darstellte hat sich im Zeitalter der Immun- und Molekulartherapien sehr vieles geändert. Leider war es auch bei der Entwicklung dieser Therapien so, dass Patienten nicht in grossen randomisierten Phase III Studien eingeschlossen wurden, sondern dass die Datenlage hauptsächlich auf Phase I und Phase II Studien beruht. Bei BRAF mutierten Patienten mit Hirnmetastasen konnten durch den Einsatz von BRAF und MEK Inhibitoren in Kombination oder auch Immuntherapie hervorragende Ansprechraten gezeigt werden, so dass diese Therapie als erste Wahl zu gelten hat, vor allem in der Patientengruppe mit asymptomatischen Metastasen, die im Zeitalter des ZNS MRI Screenings immer häufiger wird. Bei allen wild-type Patienten geht die Diskussion in Richtung Immuntherapie oder lokale Behandlungen wie Chirurgie und/oder Radiotherapie. Im Rahmen von nicht randomisierten Studien konnte gezeigt werden, dass Patienten welche von Seiten der Hirnmetastasen asymptomatisch waren und keine Steroide benötigten eine deutlich höhere Disease-control Rate hatten als Patienten mit Symptomen und Steroiden (24 vs 10%). Dennoch sind sowohl Überleben als auch Ansprechrate mit Ipilimumab (5 respektive 10%) allein gering. In einer 3 Arm Studie, bei welcher Patienten mit asymptomatischen Hirnmetastasen randomisiert wurden in eine Behandlung mit Nivolumab allein versus die Kombination mit Ipilimumab plus Nivolumab zeigten sich bei der Kombination deutlich höhere Response Raten (20 vs 46%). Im dritten Arm wurden Patienten mit symptomatischen Hirnmetastasen und Steroiden mit Nivolumab behandelt, dabei zeigte sich nur in 1/16 Patienten ein partielles Ansprechen.
Die Resultate zur Kombination bestätigten sich eindrücklich in einer jüngst im NEJM publizierten Studie mit 101 Patienten. Die Response Rate war 54%, 26% der Patienten erreichten eine komplette Remission. 64% der Patienten waren nach 6 Monaten progressionsfrei. Aufgrund dieser Daten ist bei Patienten mit asymptomatischen Hirnmetastasen die Systemtherapie gegenüber der Radiotherapie zu bevorzugen und eine Radiotherapie erst in der Rezidiv Situation oder bei neuen Symptomen in Erwägung zu ziehen.
Direkte Vergleichs-Studien zu BRAF und MEK Inhibition bei Hirnmetastasen gibt es nicht. Es konnte einzig gezeigt werden (COMBI MB) dass Dabrafenib und Trametinib bei Hirnmetastasen ähnlich gute Response Raten wie bei systemischen Metastasen zeigten (58%), derweil aber das PFS bei Hirnmetastasen deutlich kürzer war als bei systemischen Metastasen (5.6 respektive 10.2 Monate).
Die Kombination von Radiotherapie und Immuntherapie (Ipilimumab) zeigte in retrospektiven Untersuchungen keine erhöhte Toxizität. Zwei Arbeiten zeigten eine Verbesserung des Gesamtüberlebens, eine dritte Arbeit bestätigte dies nicht. Allen drei Arbeiten ist zu eigen, dass es kleine Fallserien waren.
Die Kombination mit BRAF Inhibitoren und Radiotherapie waren von zusätzlichen Toxizitäten begleitet. Vor allem bei Ganzhirnbestrahlungen zeigte sich eine Hauttoxizität, bei stereotaktischer Radiotherapie eine erhöhte Rate von Radionekrosen (22 vs 11%). Somit ist eine Kombinationstherapie prinzipiell möglich, eine sequentielle Therapie sollte aber bevorzugt werden.
Bei Patienten mit symptomatischen Hirnmetastasen ist nach wie vor die lokale Therapie (Chirurgie respektive Radiotherapie) zu bevorzugen. Bei asymptomatischen Patienten sollte bei nicht vorbehandelten Patienten zuerst eine Systemtherapie erfolgen insbesondere dann, wenn extrazerebral eine relevante Tumormasse zu verzeichnen ist. Ob bei BRAF mutierten Patienten eine Immun- oder Target Therapie zu bevorzugen ist bleibt aktuell noch unklar. Bei BRAF wild-type sollte möglichst eine Kombinationstherapie mit Ipilimumab und Nivolumab angestrebt werden, falls dies nicht möglich scheint eine Behandlung mit Nivolumab oder Pembrolizumab, da die PD1 AK deutlich effektiver zu sein scheinen als Ipilimumab alleine.
Direktor Tumor- und Forschungszentrum
Kantonsspital Graubünden
7000 Chur
tumorzentrum@ksgr.ch
Klinik für Radio-Onkologie
Kantonsspital Winterthur
Brauerstrasse 15
8401 Winterthur
daniel.zwahlen@ksw.ch
Die Autoren haben keinen Interessenskonflikt im Zusammenhang mit diesem Beitrag deklariert.
- Als alleinige Therapie anstelle der Chirurgie kommt die Bestrahlung beim Lentigo-maligna-Melanom (LMM) in Frage.
- Bei ausgewählten Patientinnen und Patienten, welche sich mit einem lymphogen metastasierendem Melanom präsentieren, wird die Radiotherapie als adjuvante Massnahme nach kompletter regionärer Lymphadenektomie zur Verbesserung der regionären Tumorkontrolle angewendet.
- Die Systemtherapien mit TKI oder Immuntherapie stellen den Standard des metastasierten Melanoms dar. Bei ungenügender lokaler Tumorkontrolle durch die Systemtherapie kommt die Radiotherapie zum Tragen.
- Der apskopale Effekt durch die Radiotherapie zur Verstärkung der Immunotherapie ist zum aktuellen Zeitpunkt in seiner klinischen
Relevanz noch unklar. - Bei asymptomatischen Hirnmetastasen sollte initial eine Systemtherapie erwogen werden. Je nach Mutationsstatus kann dies eine Immun- oder TKI Therapie sein.
- Bei symptomatischen Hirnmetastasen insbesondere, wenn Steroide wegen des Hirnödems notwendig sind sollten primär lokale Therapien wie Operation und/oder Radiotherapie erwogen werden. Dabei nimmt die stereotaktische RT einen immer grösseren Raum gegenüber der Ganzhirnbestrahlung ein und sollte wenn immer möglich bevorzugt werden.
- Patientinnen und Patienten mit lokal fortgeschrittenem und metastasiertem Melanom sollen am Tumorboard besprochen werden. Dies garantiert eine optimierte Therapieempfehlung und die Möglichkeit der Studienteilnahme.
Messages à retenir
- Le traitement du mélanome de maligna de lentigo par radiothérapie peut être considéré comme la seule thérapie au lieu de la chirurgie.
- Chez certains patients présentant un mélanome métastatique lymphogène, la radiothérapie est utilisée comme mesure adjuvante après une lymphadénectomie régionale complète pour améliorer le contrôle
régional des tumeurs. - Les thérapies systémiques avec inhibiteur de tyrosine kinase ou immunothérapie représentent le standard du mélanome métastatique. En cas de contrôle local insuffisant de la tumeur par la thérapie systémique, la radiothérapie est utilisée.
- L’ effet apscopal de la radiothérapie pour améliorer l’ immunothérapie n’est actuellement pas clair dans sa pertinence clinique.
- Dans les métastases cérébrales asymptomatiques, il faut d’ abord
envisager une thérapie systémique. Selon le statut mutationnel, il peut s’agir d’un traitement immunitaire ou d’ un traitement par inhibiteur de tyrosine kinase. - Dans les métastases cérébrales symptomatiques, surtout lorsque des stéroïdes sont nécessaires en raison d’ un œdème cérébral, il faut
envisager principalement des traitements locaux comme la chirurgie
et/ou la radiothérapie. La tomodensitométrie stéréotaxique devient de plus en plus importante par rapport au rayonnement du cerveau entier et devrait être préférée dans la mesure du possible.
1. Dummer, R., et al., The updated Swiss guidelines 2016 for the treatment and follow-up of cutaneous melanoma. Swiss Med Wkly, 2016. 146: p. w14279.
2. Barker, C.A. and N.Y. Lee, Radiation therapy for cutaneous melanoma. Dermatol Clin, 2012. 30(3): p. 525-33.
3. Farshad, A., et al., A retrospective study of 150 patients with lentigo maligna and lentigo maligna melanoma and the efficacy of radiotherapy using Grenz or soft X-rays. Br J Dermatol, 2002. 146(6): p. 1042-6.
4. Hrbacek, J., et al., Practice Patterns Analysis of Ocular Proton Therapy Centers: The International OPTIC Survey. Int J Radiat Oncol Biol Phys, 2016. 95(1): p. 336-43.
5. Krantz, B.A., et al., Uveal melanoma: epidemiology, etiology, and treatment of primary disease. Clin Ophthalmol, 2017. 11: p. 279-289.
6. Burmeister, B.H., et al., Adjuvant radiotherapy versus observation alone for patients at risk of lymph-node field relapse after therapeutic lymphadenectomy for melanoma: a randomised trial. Lancet Oncol, 2012. 13(6): p. 589-97.
7. Gutzmer, R. and H. Christiansen, [Reduction of relapse in the radiation area by adjuvant lymph-node field radiotherapy in metastatic malignant melanoma patients at high risk of recurrence]. Strahlenther Onkol, 2016. 192(3): p. 190-2.
8. Henderson, M.A., et al., Adjuvant lymph-node field radiotherapy versus observation only in patients with melanoma at high risk of further lymph-node field relapse after lymphadenectomy (ANZMTG 01.02/TROG 02.01): 6-year follow-up of a phase 3, randomised controlled trial. Lancet Oncol, 2015. 16(9): p. 1049-1060.
9. Brady, M.S., Adjuvant radiation for patients with melanoma. Lancet Oncol, 2015. 16(9): p. 1003-1004.
10. Tang, C., et al., Ipilimumab with Stereotactic Ablative Radiation Therapy: Phase I Results and Immunologic Correlates from Peripheral T Cells. Clin Cancer Res, 2017. 23(6): p. 1388-1396.
11. Koller, K.M., et al., Improved survival and complete response rates in patients with advanced melanoma treated with concurrent ipilimumab and radiotherapy versus ipilimumab alone. Cancer Biol Ther, 2017. 18(1): p. 36-42.
12. Chen, D.S. and I. Mellman, Oncology meets immunology: the cancer-immunity cycle. Immunity, 2013. 39(1): p. 1-10.
13. Espenel, S., et al., Melanoma: Last call for radiotherapy. Crit Rev Oncol Hematol, 2017. 110: p. 13-19.
14. Youland, R.S., et al., Role of radiotherapy in extracranial metastatic malignant melanoma in the modern era. Clin Transl Radiat Oncol, 2017. 6: p. 25-30.
15. Kroeze, S.G., et al., Toxicity of concurrent stereotactic radiotherapy and targeted therapy or immunotherapy: A systematic review. Cancer Treat Rev, 2017. 53: p. 25-37.
16. Nguyen, S.M., et al., Stereotactic Radiosurgery and Ipilimumab Versus Stereotactic Radiosurgery Alone in Melanoma Brain Metastases. Cureus, 2017. 9(7): p. e1511.
17. Stokes, W.A., et al., Impact of immunotherapy among patients with melanoma brain metastases managed with radiotherapy. J Neuroimmunol, 2017. 313: p. 118-122.
18. Kruser, TJ, et al., Omitting radiosurgery in melanoma brain metastases: a drastic and dangerous de-escalation. Lancet Oncol, 2018. 19 (8): p. E366.
19. Aoyama, H., et al., Stereotactic Radiosurgery With or Without Whole-Brain Radiotherapy for Brain Metastases: Secondary Analysis of the JROSG 99-1 Randomized Clinical Trial. JAMA Oncol, 2015. 1 (4): p. 457-64.
Brown, PD, et al., Effect of Radiosurgery Alone Vs. Radiosurgery Using Whole Brain Radiation Therapy on Cognitive Function in Patients With 1 to 3 Brain Metastases: A Randomized Clinical Trial. JAMA, 2016. 316 (4): p. 401-409.
21. Yamamoto, M., et al., Stereotactic radiosurgery for patients with brain metastases – authors’ reply. Lancet Oncol, 2014. 15 (7): p. E248.
info@onco-suisse
- Vol. 9
- Ausgabe 3
- Juni 2019