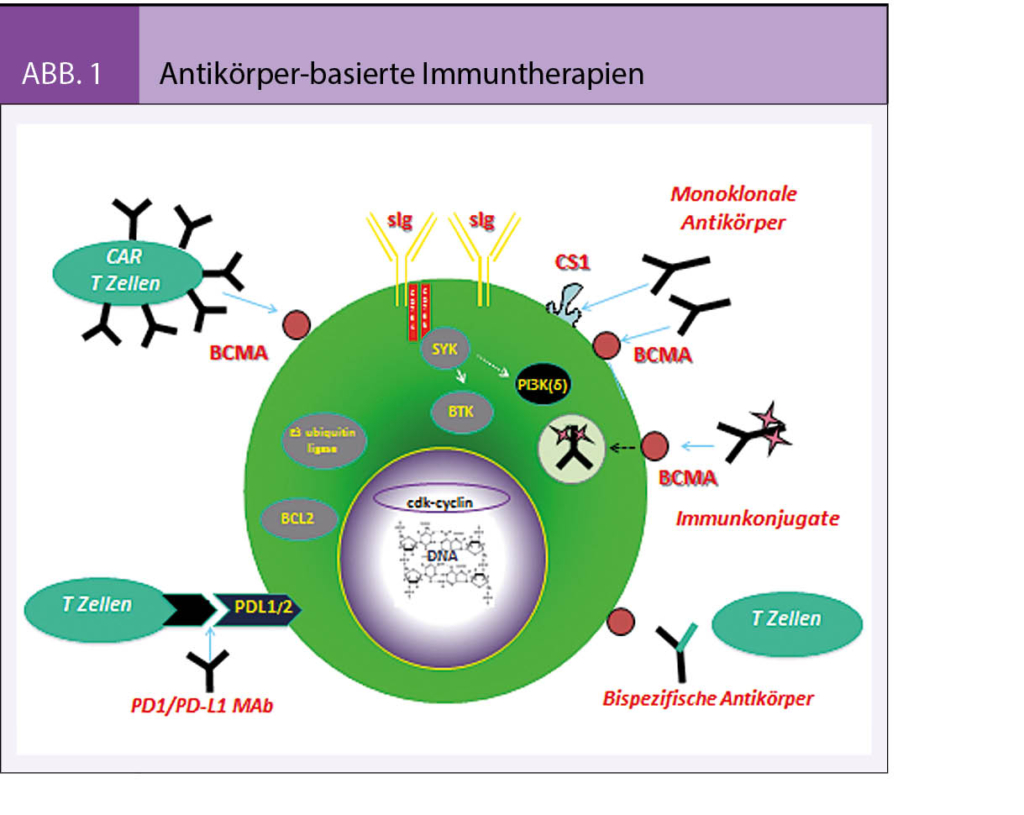
- Immuntherapie des Multiplen Myeloms
Der Begriff Immuntherapie wird heutzutage sehr weit gefasst und beinhaltet viele verschiedene Ansätze. Fokussiert man sich auf Antikörper-basierte Konzepte, so besitzen monoklonale Antikörper bereits einen festen Platz in der Myelombehandlung und Antikörpervarianten wie Immuntoxine, bispezifische Antikörper oder auch Antikörper-beladene T-Zellen befinden sich in der klinischen Erprobung bzw. Zulassung. Allen Ansätzen gemeinsam ist eine möglichst optimale Aktivierung des patienteneigenen Immunsystems gegen Myelomzellen. Damit könnte das Multiple (MM) Myelom in Zukunft eine heilbare Erkrankung werden.
Le terme immunothérapie est aujourd’hui compris dans un sens très large et comprend de nombreuses approches différentes. Si l’accent est mis sur les concepts basés sur les anticorps, les anticorps monoclonaux ont déjà une place ferme dans le traitement du myélome et les variantes d’anticorps telles que les immunotoxines, les anticorps bispécifiques ou les cellules T chargées d’anticorps sont en cours d’essai clinique ou d’approbation. Toutes les approches ont en commun la meilleure activation possible du système immunitaire du patient contre les cellules myélomateuses. Cela pourrait faire du myélome multiple (MM) une maladie guérissable à l’avenir
Monoklonale Antikörper
Die passive Immuntherapie mittels monoklonaler Antikörper (Mab) hat sich in der Lymphomtherapie schon seit fast 20 Jahren und in der Myelomtherapie nun in den letzten Jahren erfolgreich etabliert. Dabei werden in der Myelom-Behandlung vornehmlich Antikörper mit Spezifität für das CS1 Antigen (z.B. Elotuzumab) bzw. das CD38 Antigen (z.B. Daratumumab) verwendet. Diese monoklonalen Antikörper erkennen spezifisch ihr Zielantigen und lösen über eine Komplementaktivierung (CDC) oder Rekrutierung zytotoxischer Zellen (ADCC) eine Immunantwort aus. MAb können als Monotherapie oder in Kombination mit bereits etablierten Therapeutika eingesetzt werden. Den grössten Stellenwert besitzen zur Zeit CD38 spezifische MAb wie Daratumumab, da sie sowohl als Monotherapie als auch in Kombinationstherapien eine hohe Aktivität gegenüber Plasmazellen aufweisen.
Therapie mit dem CD38 spezifischen Antikörper Daratumumab
Daratumumab ist ein humaner CD38-IgG1κ Antikörper, der an zwei β-stranghaltige Aminosäuren 233-246 und 267-280 des CD38 Antigens bindet. Seine Wirkung entfaltet er u.a. über den Fc Anteil des Antikörpers mit Komplementaktivierung im Sinne einer effizienten CDC als auch einer ADCC. Auf Grundlage verschiedener Studien wurde die optimale Dosierung von 16 mg/kg KG mit einer zunächst wöchentlichen (8 Gaben), dann zweiwöchentlichen (8 Gaben) und anschliessend monatlichen Applikation als Standard definiert. Die Gesamtansprechrate (RR) für Patienten mit weit fortgeschrittenem bzw. refraktärem MM beträgt ca. 31% mit einem medianen OS von 20 Monaten (1). Die Daratumumab Monotherapie ist in der Schweiz zugelassen und kassenpflichtig.
Kombinationstherapien Daratumumab plus Velcade/Dexamethason bzw. Revlimid/Dexamethason
Es gibt aktuell 2 grosse, randomisierte Phase III Studien, die Daratumumab (D) + Revlimid/Dexamethason (Rd) bzw. Velcade/Dexamethason (Vd) bei MM Patienten ab der 2. Therapielinie getestet haben. In der CASTOR-Studie (DVd vs. Vd) mit 498 Patienten, die im Median zwei Therapielinien durchlaufen hatten, wurde in beiden Armen nach 8 Zyklen die Therapie mit Vd gestoppt und Daratumumab im experimentellen Arm bis zur Progression weitergegeben. Nach einem medianen Follow-Up von 7,4 Monaten war das mediane PFS im Daratumumab-Arm deutlich länger als im Kontrollarm (nicht erreicht vs. 7,16 Monate, HR 0,39, p<0,0001) (2). Die zusätzliche Gabe von Daratumumab führte zu einer Verdopplung an qualitativ sehr guten Remissionen (VGPR oder CR). In der kürzlich präsentierten Aktualisierung (medianes Follow-up 19 Monate) betrug das PFS für alle Patienten 17 vs. 7 Monate. Auch die Kombination DRd führte im Vergleich zu Rd (POLLUX-Studie) zu einer signifikanten Verlängerung des medianen PFS (nicht erreicht vs. 18 Monate, HR 0,37, p<0,0001) (3). In beiden Studien traten Infusionsreaktionen fast ausschliesslich (>90%) im ersten Behandlungszyklus auf und nur sehr wenige waren Grad 3 (5-10%) Reaktionen, Grad 4 Reaktionen wurden nicht beobachtet. Auch profitierten in beiden Studien alle vordefinierten Subgruppen von der Daratumumab Therapie. Besonders hervorzuheben ist die hohe Rate an MRD Negativität (für DRd im Standardrisikoarm bis 30% und im Hochrisikoarm bis 21%). Diese tiefe Krankheitskontrolle könnte eventuell einen ersten Schritt Richtung Krankheitselimination andeuten.
Monokolonale Antikörper sind in der Regel passive Immuntherapeutika, d.h. ihre Aktivität ist nicht langfristig im Organismus nach Applikation vorhanden und sobald der Wirkspiegel im Blut unterhalb der jeweils erforderlichen Mindestkonzentration fällt (in der Regel nach 2-3 Halbwertszeiten), ist auch kein Effekt mehr vorhanden. Zur Steigerung der Mab Aktivität kann dieser z.B. an ein Zellgift gekoppelt werden (sog. Immuntoxin). Damit wird der Antikörper als Trägermolekül verwendet und führt ein in der Regel hochpotentes Zellgift direkt an die gewünschte Zielzelle.
Immuntoxine
Immuntoxine (IT) machen sich zwei Eigenschaften von Antikörpern zunutze: die Spezifität für das Zielmolekül und die Fähigkeit, nach Bindung an der Zelloberfläche in die Zelle zu internalisieren und dort das gekoppelte Toxin frei zu setzen (sog. Antibody-Drug-Conjugate(ADC) (Abb.1). Prototyp ist Brentuximab Vedotin (BV) als Konjugat eines CD30-spezifischen Antikörpers mit Monomethylauristatin E, das die mitotische Spindel zerstört und damit Apoptose in Lymphomzelle auslöst. Ähnliche Ansätze werden auch in der Myelombehandlung verfolgt und am erfolgversprechendsten sind Konstrukte mit Spezifität für das B cell maturation antigen (BCMA). BCMA wird in späten Stadien der B Zelldifferenzierung membranständig exprimiert und ist für das Überleben langlebiger Plasmazellen erforderlich. Monomethyl-Auristatin-F gekoppelt an einen BCMA spezifischen Antikörper wird nach Bindung an der Myelomzelle rasch internalisiert und setzt sein aktives Toxin frei. In einer offenen Phase-I Studie bei Patienten mit rezidiviertem / refraktärem MM (rrMM) wurde das IT alle 3 Wochen intravenös bei guter Verträglichkeit infundiert. Bei keinem der 24 MM-Patienten gab es unerwünschte Ereignisse, die zum Abbruch der Behandlung führten. Bei vier Patienten war eine Dosisreduktion aufgrund von Nebenwirkungen des Toxins erforderlich: okuläre Toxizität (n = 1), Hornhauterkrankung / okuläre Toxizität (n = 1), trockene Augen (n = 1) und Keratitis (n = 1). Es wurden jedoch keine DLTs berichtet und damit kann auf eine insgesamt akzeptable Verträglichkeit geschlossen werden (4). Sehr rudimentäre Daten existieren bzgl. der Wirksamkeit: Bei 0,24 mg / kg 1 MR und 1 VGPR, bei Dosen ≥ 0,96 mg / kg 3 PR und 1 MR. Damit ergibt sich eine sog. clinical benefit rate (CBR) von 25% und es müssen sicherlich noch grössere Studien durchgeführt werden, um den klinischen Benefit eindeutig zu belegen.
Immunmodulierende Antikörper
Dieser recht neue Immuntherapieansatz verwendet zumeist auch Mab (Abb. 1). Diese erkennen aber nicht zwangsläufig ein Tumor-antigen, sondern schalten das Immunsystem im Sinne einer aktiven Immunisierung an und können zudem durch die Etablierung sog. Gedächtniszellen eine langfristige Immunität – ähnlich einer Impfung – erzielen. Paradebeispiel sind Checkpoint Inhibitoren (CPI) in der Behandlung solider Tumoren, vornehmlich CTLA4 oder PD1/PDL-1 blockierende MAbs. Deren Einsatz hat sich beim Multiplen Myelom (MM) insbesondere aufgrund einer recht hohen (pulmonalen) Toxizität bisher nicht durchgesetzt. Erfolgsversprechend sind derzeit jedoch zwei neue Ansätze basierend auf bispezifischen Antikörpern und Tumor-spezifischen T-Zellen.
Bispezifische Antikörper
Bispezifische Antikörper (BiMab) entstehen durch die Kombination zweier Antikörperdomänen (Abb.1): Eine erkennt ein Zielantigen auf der Myelomzelle (z.B. BCMA), und die zweite erkennt ein Aktivierungsantigen (z.B. CD3) auf T Zellen. Damit werden T Zellen an Myelomzellen gebunden und lokal aktiviert. Paradebeispiel ist auch hier wieder ein Konstrukt (CD3-CD19, Blinatumumab) zur Behandlung von B Zell Leukämien und Lymphomen. In der Myelombehandlung befindet sich diese Technik noch in der präklinischen Entwicklung, zeigt aber z.B. für einen BCMA-CD3 spezifischen BiMab hoffnungsvolle Resultate. So konnte für die Ko-Kultivierung autologer Myelom- und T Zellen in Präsenz eines BCMA-CD3 Konstrukts unabhängig vom Krankheitsstatus ein hoher Grad der T Zellaktivierung mit entsprechender Tumorzelllyse beobachtet werden. In ersten Primatenversuchen wurde neben der guten Verträglichkeit eine Elimination BCMA-positiver Plasmazellen im Knochenmark verzeichnet (5). Daher befinden sich derzeit mehrere BiMAb Studien in der Planung und werden in Kürze aktiviert.
Tumorspezifische T-Zellen
Die Umprogrammierung autologer oder allogener T Zellen durch viralen Gentransfer tumorspezifischer Antikörpersequenzen (sog. CAR T Zell-Technologie) stellt momentan eines der interessantesten klinischen Forschungsgebiete dar. Bisher werden dafür Abwehrzellen des jeweiligen Patienten aus dem Blut entnommen, im Labor genetisch manipuliert und durch Einschleusung einer Antikörperdomäne (z.B. mit BCMA Spezifität) gegen Myelomzellen gerichtet (Abb.1). Nach Rückgabe in den Patienten können diese modifizierten Abwehrzellen die Myelomzellen aufspüren und zerstören. Hauptnebenwirkung ist das sog. cytokine release syndrome (CRS), das typischerweise zwischen Tag 4 und 8 nach Zellrückgabe entstehen kann. Inzwischen sind aber Massnahmen zur Therapie eines einsetzenden CRS etabliert und damit die Verträglichkeit gegeben. Von den vier bisher präsentierten klinischen BCMA CAR T Zellstudien lässt sich folgern, dass hohe Ansprechraten (bis zu 100%) in den zum Teil doch intensiv vorbehandelten Patienten (median bis zu 7 Vortherapien) mit CR Raten von bis zu 40% erreicht werden können (6-9).
Eine vorgängige Lymphodepletion mittels Chemotherapie (z.B. Cyclophosphamid oder Fludarabin) erwies sich als vorteilhaft, da dadurch eine bessere Verträglichkeit bei höheren Zelldosen erzielt werden konnte Langfristige Remissionen sind trotz der bereits genannten multiplen Vortherapien beobachtet worden, wobei man wahrscheinlich noch einige Jahre warten muss, um zu beurteilen, ob auch die erhofft hohen Heilungsraten ein realistisches Ziel sind. Die Kosten einer Zelltherapie stellen derzeit sicherlich noch eine schwer zu nehmende Hürde dar und es ist ungewiss, wann diese Technologie auch in der Schweiz verfügbar sein wird.
Onkozentrum Hirslanden Zürich und Onkozentrum Zürich
Witellikerstrasse 40
8032 Zürich
Christoph.renner@hirslanden.ch
Onkozentrum Hirslanden
Witellikerstrasse 40
8032 Zürich
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Beitrag deklariert.
- Monoklonale Antikörper sind 40 Jahre nach ihrer Erstbeschreibung Eckpfeiler einer Immuntherapie bei vielen Tumorerkrankungen und konnten auch beim Multiplen Myelom einen festen Platz im Behand-lungskonzept einnehmen.
- Antikörpervarianten werden noch effektiver und gezielter Myelom-
zellen abtöten können und damit hoffentlich die Effektivität als auch Verträglichkeit der Therapie verbessern können. - Die neuartigen Zelltherapien versprechen zudem eine langfristige zelluläre Kontrolle der Erkrankung und lassen sogar Heilungen als mögliches Therapieziel erscheinen
Message à retenir
- 40 ans après leur description initiale, les anticorps monoclonaux sont la pierre angulaire de l’immunothérapie pour de nombreuses maladies tumorales et font désormais partie intégrante du concept de traitement du myélome multiple.
- Les variantes d’anticorps seront capables de tuer les cellules myélomateuses encore plus efficacement et spécifiquement, ce qui, nous l’espérons, améliorera l’efficacité et la tolérabilité de la thérapie.
- Les nouvelles thérapies cellulaires promettent également un contrôle cellulaire à long terme de la maladie et font même apparaître la guérison comme un objectif thérapeutique possible.
1 Usmani SZ, Weiss BM, Plesner T et al. Clinical efficacy of daratumumab monotherapy in patients with heavily pretreated relapsed or refractory multiple myeloma. Blood. 2016 Jul 7;128(1):37-44.
2. Palumbo A, Chanan-Khan A, Weisel K et al. Daratumumab, Bortezomib, and Dexamethasone for Multiple Myeloma. N Engl J Med. 2016 Aug 25; 375(8):754-66.
3. Dimopoulos MA, Oriol A, Nahi H et al. Daratumumab, Lenalidomide, and Dexamethasone for Multiple Myeloma. N Engl J Med. 2016 Oct 6; 375(14):1319-1331.
4. Trudel S, MD, Lendvai N, Popat R, et al. Deep and durable responses in patients (Pts) with relapsed/refractory multiple myeloma (MM) treated with monotherapy GSK2857916, an antibody drug conjugate against B-cell maturation antigen (BCMA): preliminary results from part 2 of study BMA117159. Presented at: ASH Annual Meeting and Exposition; Dec. 9-12, 2017; Atlanta, Georgia. Abstract 741.
5. Hipp S, Tai YT, Blanset D et al. A novel BCMA/CD3 bispecific T-cell engager for the treatment of multiple myeloma induces selective lysis in vitro and in vivo. Leukemia. 2017 Aug; 31(8): 1743-1751.
6. Berdeja JG, Lin Y, Raje NS, et al. First-in-human multicenter study of bb2121 anti-BCMA CAR T-cell therapy for relapsed/refractory multiple myeloma: updated results [abstract]. J Clin Oncol. 2017;35(suppl 15). Abstract 3010.
7. Fan F, Zhao W, Liu J, et al. Durable remissions with BCMA-specific chimeric antigen receptor (CAR)-modified T cells in patients with refractory/relapsed multiple myeloma [abstract]. J Clin Oncol. 2017;35(suppl 18). Abstract LBA3001.
8. Cohen AD, Garfall AL, Stadtmauer EA, et al. B-cell maturation antigen (BCMA)-specific chimeric antigen receptor T cells (CART-BCMA) for multiple myeloma (MM): initial safety and efficacy from a phase I study [abstract]. Blood. 2016;128(22). Abstract 1147.
9. Ali SA, Shi V, Maric I, et al. T cells expressing an anti-B-cell maturation antigen chimeric antigen receptor cause remissions of multiple myeloma. Blood. 2016;128(13):1688-1700.
info@onco-suisse
- Vol. 8
- Ausgabe 4
- August 2018