- Immuntherapie-Standards bei nicht-kleinzelligem Bronchial-CA ohne Treiberalterationen
Das Bronchialkarzinom ist mit einer Inzidenz von 4700 (m: 2800, f: 1900) Neuerkrankungen pro Jahr die dritthäufigste Krebserkrankung in der Schweiz. Bei einer Mortalität von 3300 verstorbenen Patienten pro Jahr hat das Bronchialkarzinom mit 19% den grössten Anteil an allen Krebs-Todesfällen pro Jahr in der Schweiz. Durch den Einsatz von Immuntherapie konnte bei Patienten in metastasierten Stadien eine Verlängerung des Überlebens erreicht werden. Bei Patienten mit kurativ behandelten resezierbaren Tumoren besteht in Abhängigkeit des Stadiums trotz Gabe einer adjuvanten Chemotherapie ein relevantes Rezidivrisiko, sodass der Einsatz von Immuntherapie nun auch in diesen Stadien zunehmend untersucht wird, mit ersten positiven praxisrelevanten Studienergebnissen.
With an incidence of 4700 (m: 2800, f: 1900) new cases per year, bronchial carcinoma is the third most common cancer in Switzerland. With a mortality rate of 3300 patients per year, bronchial carcinoma accounts for 19% of all cancer deaths per year in Switzerland. The use of immunotherapy has resulted in prolonged survival in patients in metastatic stages. Patients with resectable tumors treated in curative intent, risk of recurrence depending on the stage remains high despite use of adjuvant chemotherapy. Therefore checkpoint inhibitors are now increasingly being investigated in this setting, with practice-changing positive phase III study results recently published.
Key Words: Bronchialkarzinom, NSCLC, Checkpoint-Inhibitoren
Immun-Checkpoint-Inhibitoren (ICI) sind beim fortgeschrittenen nicht-kleinzelligen Lungenkarzinom (non small cell lung cancer-NSCLC) als Monotherapie oder in Kombination mit Chemotherapie bereits ein therapeutischer Standard (1). Im letzten Jahr wurden nun zusätzlich wegweisende Studienresultate für den Einsatz von ICI auch beim resektablen NSCLC präsentiert.
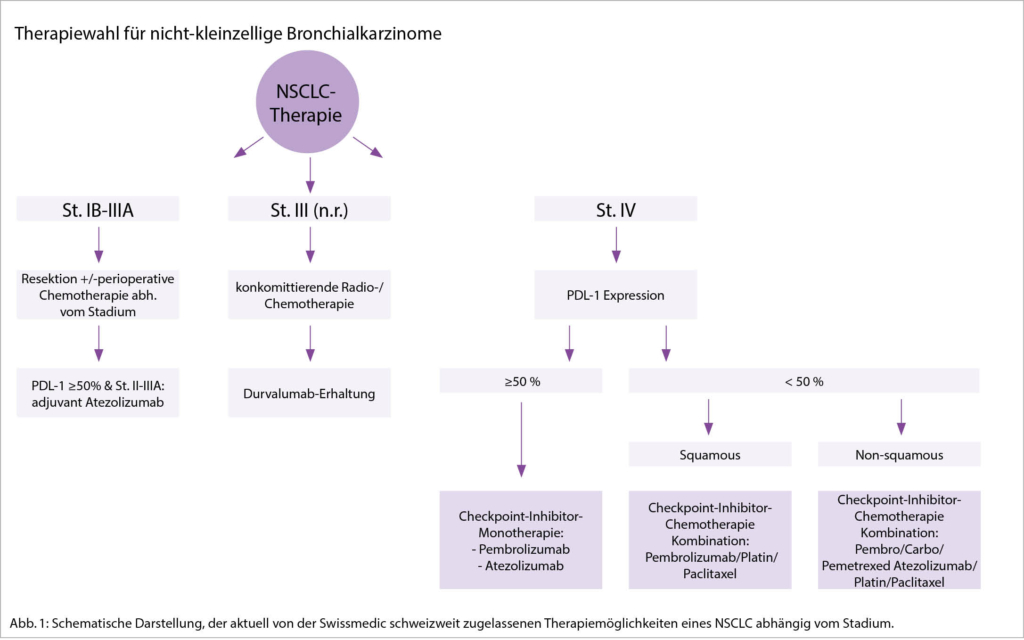
Dieser Artikel bietet eine Übersicht über die aktuellen sowie den zu erwartenden ICI-Standards bei nicht-kleinzelligen Bronchialkarzinomen. Aufgrund der Fülle an Daten beschränken wir uns beim fortgeschrittenen NSCLC primär auf die Wahl der ersten Therapielinie bei Patienten ohne zielgerichtet angehbare molekulare Alterationen.
Fortgeschrittenes, metastasiertes NSCLC
Die wegweisende Phase I KEYNOTE-001 Studie mit Pembrolizumab hat, mit 2019 publizierten 5-Jahres Überlebensraten von 22.2% bei therapienaiven und 15.5% bei vorbehandelten NSCLC-Patienten ohne bestehende Alterationen des Epidermal Growth Factor Rezeptor (EGFR) oder der Anaplastic Lymphoma Kinase (ALK), den Grundstein für den Einsatz von ICI beim fortgeschrittenen NSCLC gelegt (2).
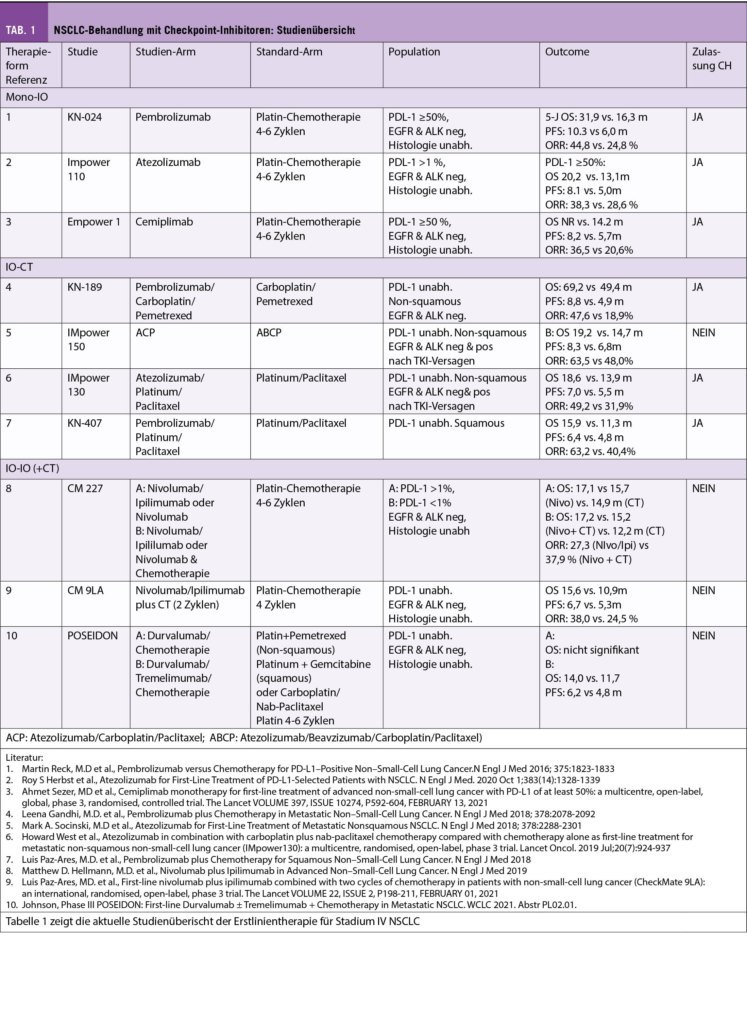
Die Wahl der ersten Systemtherapie bei Patienten mit einem fortgeschrittenem, nicht kurativ behandelbaren NSCLC wird heute neben klinischen Faktoren wie Allgemeinzustand, Komorbiditäten und Tumorlast in erster Linie basierend auf den molekularen Charakteristika gefällt und des programmed death-ligand 1 (PD-L1) Status gefällt. Tabelle 1 gibt eine Übersicht über die wichtigsten Studien in diesem Setting.
Checkpoint Inhibitor Monotherapie
Bereits in der KEYNOTE-001 Studie zeigte sich eine Korrelation der Wirksamkeit von Pembrolizumab in Abhängigkeit der PD-L1 Expression mit 5-Jahres Überlebensraten von 29.6%, 15.7% und 8.6% bei Patienten mit einer PD-L1 Expression ≤50%, ≤1% und <1% (2). In der Folge wurden Checkpoint-Inhibitor-Monotherapien in der ersten Therapielinie gegenüber dem vorherigen Stan-dard einer platin-basierten Kombinationschemotherapie bei Patienten mit einer PD-L1 Expression von <50% untersucht.
In der KEYNOTE-024 Studie konnte für Pembrolizumab ein signifikant verbessertes progressionsfreies (progression-free survival=PFS), als auch Gesamtüberleben (overall survival=OS) gegenüber einer platin-basierten Chemotherapie gezeigt werden, mit kürzlich publizierten 5-Jahres-Überlebensraten von 31.9% versus 16.3 % (3).
Vergleichbare Resultate konnten auch für eine Atezolizumab-Monotherapie in der IMPower-110 (4) und kürzlich für Cemiplimab in der EMPOWER Lung 1 Studie (5) in diesem Setting gezeigt werden. Somit stellt eine Monotherapie in diesem Setting einen klaren Therapiestandard dar und ist so auch zugelassen.
ICI-Monotherapien wurden auch bei Patienten mit einer PD-L1 Expression von <50% untersucht. Diese Studien waren entweder gesamthaft negative Studien wie die Checkmate-026, welche keinen OS-Vorteil einer Nivolumab-Monotherapie gegenüber einer platin-basierten Chemotherapie in einer PD-L1-positiven Population zeigte (6) oder der dokumentierte OS-Benefit wurde, wie mit Pembrolizumab in der KEYNOTE-024 (3) oder mit Atezolizumab in der IMpower-110 (4) Studie, in erster Linie durch die PD-L1-hohe Population getriggert, so dass Checkpoint-Inhibitor-Monotherapien unabhängig von der Substanz in dieser Patientenpopulation in der Schweiz keinen Standard darstellen.
Kombinierte Immun-/Chemotherapie
Für Patienten mit einer PD-L1 Expression <50% konnte in mehreren randomisierten Phase III Studien ein signifikanter PFS und insbesondere OS-Vorteil für die Kombination eines Checkpoint-Inhibitors mit einer platin-basierten Chemotherapie gegenüber einer Chemotherapie alleine gezeigt werden (Tab. 1). Die KEYNOTE-189, IMpower-150 und Impower-130 Studien schlossen exklusiv Patienten mit nicht-Plattenepithelkarzinomen ein, die KEYNOTE-407 hingegen nur Patienten mit Plattenepithelkarzinomen. In allen Studien konnten Patienten unabhängig des PD-L1 Status rekrutiert werden, jedoch waren Patienten mit einer EGFR oder ALK Alteration in beiden KEYNOTE-Studien im Gegensatz zu den IMpower-Studien explizit ausgeschlossen.
Alle 4 Studien waren positive Phase III Studien mit einem relevanten OS-Benefit unabhängig der PD-L1 Expression. Eine Swissmedic Zulassung besteht für die Kombination von Pembrolizumab sowie Atezolizumab mit Chemotherapie, wobei die letzte Kombination bislang noch nicht auf der Spezialitätenliste aufgeführt ist.
Die Kombination von Chemo-Immuntherapie und Bevacizumab, wie sie in der IMpower-150 Studie untersucht wurde, ist so in der Schweiz für diese Indikation nicht zugelassen.
In allen Studien wurde ein signifikanter Benefit der Chemo-Immuntherapie auch bei Patienten mit einer hohen PD-L1 Expression gezeigt, ein direkter Vergleich von Chemo-Immuntherapie versus ICI-Monotherapie in dieser Patientenpopulation steht noch aus, wobei entsprechende Phase III Studien aktuell rekrutieren (PERSEE trial: NCT04547504; INSIGNA trial: NCT03793179). Am ASCO 2022 (7) wurde eine gepoolte FDA-Analyse von 12 randomisierten Studien mit Chemo-IO- respektive ICI-Monotherapie gezeigt, welche zwar höhere Ansprechraten und ein verlängertes PFS für die Kombination zeigen konnte, jedoch keinen signifikanten OS-Benefit. Bei Nie-Rauchern zeigte sich in der Subgruppenanalyse interessanterweise ein signifikanter Vorteil auch bezüglich des Gesamtüberlebens. Aktuell ist eine Kombinationstherapie bei dieser Patientenpopulation in der Schweiz grundsätzlich nicht vergütet, könnte aber bei Patienten mit einer hohen Tumorlast und Notwendigkeit eines schnellen Tumoransprechens oder auch bei Nie-Rauchern eine gute Option darstellen und basierend auf dieser FDA-Analyse angefragt werden.
Duale Checkpoint-Inhibitoren
Neben einer Chemo-Immun-Kombinationsstrategie wurde in mehreren Studien auch eine duale Checkpoint-Inhibition mit einem PD-1- oder PD-L1-Antikörper sowie einem CTL4-Antikörper untersucht. In der Phase III Checkmate-227 Studie wurde die Kombination von Nivolumab und Ipilimumab gegenüber einer platin-basierten Chemotherapie in Patienten mit Nichtplatten- und Plattenepithelkarzinomen in der PD-L1 positiven (primärer Endpunkt) sowie in der Gesamtpopulation unabhängig des PD-L1 Status untersucht. Die Studie zeigte einen signifikanten OS-Benefit für die duale Checkpoint-Inhibition mit kürzlich publizierten 5-Jahres Überlebensraten von 24% mit Nivolumab/Ipilimumab verglichen mit 14% (HR: 0.77) mit Chemotherapie in der PD-L1-positiven Population (8). In der Subgruppenanalyse der PD-L1 negativen Patienten zeigte sich ebenfalls ein signifikanter Benefit (19% versus 7%, HR 0.65). Ein vergleichbares Studiendesign wählte die POSEIDON-Studie, eine dreiarmige Phase III Studie, die eine Kombination von Durvalumab/Tremelimumab gegenüber einer platinbasierten Chemotherapie alleine oder in Kombination mit Durvalumab untersucht hat. Auch hier zeigte sich ein signifikanter Überlebensvorteil der dualen Checkpoint Inhibition gegenüber der alleinigen Chemotherapie, wobei dieser in erster Linie bei Patienten mit Nichtplattenepithelkarzinomen gesehen wurde (9).
Die Checkmate 9LA Studie untersuchte die Kombination von Nivolumab/Ipilimumab mit zwei Zyklen platinbasierter Chemotherapie wiederum gegenüber einer alleinigen Chemotherapie. Auch dies war eine positive Phase III Studie mit 2022 publiziertem 2-Jahres-Überlebensraten von 38% versus 26% (HR 0.72). In dieser Studie zeigte sich ebenfalls ein signifikanter Benefit in der PD-L1 negativen Population und Patienten mit einem Plattenepithelkarzinom (10).
Bislang hat die duale Checkpoint-Inhibition (alleine oder in Kombination mit Chemotherapie) in der Schweiz keine Zulassung erhalten, kann aber über Artikel 71 angefragt werden.
Lokal fortgeschrittenes nicht resezierbares NSCLC
In der PACIFIC-Studie konnte bei Patienten mit lokal fortgeschrittenem NSCLC ohne Progression nach Abschluss der konkomittierenden Radiochemotherapie ein signifikanter PFS- und OS-Benefit für ein Jahr Konsolidierung mit Durvalumab im Vergleich zu Observation gezeigt werden mit 5-Jahres-Überlebensraten von 42.9% versus 33.4% (11). Am ESMO 2021 präsentierte Real-World-Daten zeigen zudem einen vergleichbaren Benefit bei Patienten, die mit einer sequentiellen Radiotherapie behandelt wurden (12). Aktuell wird der frühere Einsatz respektive auch eine duale Checkpoint-Inhibition sowie eine kürzere Konsolidierungszeit zur weiteren Verbesserung der Wirksamkeit untersucht.
Am diesjährigen ASCO wurden vielversprechende 2-Jahres-Überlebensraten der nicht-randomisierten Phase II KEYNOTE-799 Studie gezeigt, die den Einsatz von Pembrolizumab bereits während der Radiochemotherapie gefolgt von einer Pembrolizumab-Konsolidierung untersuchte. In Kohorte A (Nicht-Plattenepithelkarzinome und Plattenepithelkarzinome) zeigten sich 2-Jahres-Überlebensraten von 64% respektive 71% in Kohorte B (exklusiv Nicht-Plattenepithelkarzinome), dies bei vertretbarer Toxizität (Grad ≥ 3 Pneumonitis in 8% respektive 7%) (13). Eine andere Strategie hat die ebenfalls am ASCO 2022 präsentierte LUN16-081 Studie verfolgt: Patienten wurden nach Abschluss der konkomittierenden Radiochemotherapie entweder sechs Monate mit Nivolum-ab alleine oder in Kombination mit Ipilimumab behandelt. Das mediane PFS in beiden Armen lag bei 25 Monaten (Vgl. PACIFIC: 16.9 Monate), wobei die Gesamtüberlebensdaten noch unreif sind. Wichtig ist aber die Tatsache, dass hier die Rate an ≥ G3 Pneumonitiden im Kombinationsarm deutlich erhöht war (17% vs. 9%) (14).
Zusammenfassend stellen Checkpoint Inhibitoren in dieser Patientenpopulation einen integralen Bestandteil der Therapie dar, mit in der Zukunft möglicherweise früherem Einsatz analog der KEY-NOTE-799 Studie. Ob eine Dauer der Konsolidierung für sechs statt 12 Monate, zumindest bei gewissen Patienten ausreichend sein könnte, muss noch weiter untersucht werden.
Nicht-metastasiertes, resezierbares NSCLC
Bisheriger Therapiestandard stellte bei dieser Patientenpopulation die Resektion mit (neo-) adjuvanter platin-basierter Chemotherapie in Abhängigkeit vom Stadium dar. Mehrere Phase III Studien untersuchen aktuell die Rolle der Checkpoint-Inhibitoren in der perioperativen Situation.
Im adjuvanten Setting liegen aktuell die Resultate der IMpower-010 sowie der KEYNOTE-91 (PEARLS) Studie vor. In der IMpower-010 Studie wurde die Gabe von 12 Monaten Atezolizumab versus Observation nach Resektion und adjuvanter Chemotherapie untersucht mit dem primären Endpunkt Disease-free survival (DFS) in der Population der Patienten mit PD-L1 positiven Tumoren Stadium II-IIIA: hier zeigte sich ein signifikanter DFS-Benefit (HR 0.66). Der Benefit einer ad-juvanten Atezolizumab-Therapie zeigte sich auch in der Gesamtpopulation aller Patienten mit NSCLC Stadium II-IIIA unabhängig des PD-L1 Status (HR 0.79), wobei eine Subgruppenanalyse eine klare Korrelation der Wirksamkeit mit der PD-L1 Expression dokumentieren konnte (PD-L1≥50%: HR 0.43, ≥1%: HR 0.66, PD-L1 <1% HR 0.97) (16).
In der Schweiz wurde Atezolizumab im adjuvanten Setting von der Swissmedic Mitte Januar 2022 zugelassen, jedoch nur in der Subgruppe der Patienten mit einer PD-L1 Expression von ≥50%.
Die KEYNOTE-091/PEARLS Studie evaluierte Pembrolizumab adjuvant für 12 Monate in Patienten mit reseziertem Stadium IB-IIIA NSCLC gegenüber Placebo. Diese Studie hatte die Co-primären Endpunkte DFS in der Gesamtpopulation der Patienten mit Stadium IB-IIIA unabhängig der PD-L1 Expression sowie DFS in Patienten mit Stadium IB-IIIA und einer PD-L1 Expression ≥50%. Eine adjuvante Chemotherapie war in Patienten mit Stadium II-IIIA empfohlen, jedoch nicht obligatorisch. Die Resultate der PEARLS-Studie wurden im Rahmen eines ESMO Virtual Plenary im März 2022 erstmals präsentiert. Es zeigte sich ein signifikanter DFS-Benefit für die Patienten unabhängig der PD-L1 Expression mit adjuvant Pembrolizumab (medianes DFS 53.6 vs. 42.0 Monate, HR: 0.76) (17). Interessanterweise konnte in Patienten mit einer PD-L1 Expression ≥50 (Co-primärem Endpunkt) keine signifikante Verbesserung des DFS beobachtet werden (HR 0.82, p= 0.14); ein Resultat, das konträr zu den Resultaten der IMpower-010 Studie sowie der meisten Studienevidenz in fortgeschrittenen Stadien steht und eine Einordnung schwierig macht (18).
Neben adjuvanten Therapiestrategien untersuchen mehrere Studien auch einen neoadjuvanten Chemo-ICI Ansatz. In dieser Hinsicht wegweisend sind die Daten der Phase III Checkmate-816 Studie, in der Patienten mit resezierbaren NSCLC Stadium IB-IIIA eine neoadjuvante Therapie mit platin-basierter Chemotherapie alleine oder in Kombination mit Nivolumab erhielten. Die Studie war positiv bezüglich ihrer beiden Co-primären Endpunkte pathologic complete response rate (pCR) und event-free-survival (EFS). Es zeigte sich eine signifikante Erhöhung der pCR-Rate (24% vs. 2.2%, P= <0,001) sowie eine signifikante Verlängerung des EFS von 31.6 vs. 20.8 Monate (HR: 0.63) (19).
Weitere Phase III Studien untersuchen den Einsatz der Checkpoint-Inhibitoren perioperativ sowohl mit einer neoadjuvanten sowie einer adjuvanten ICI-Therapiephase. Die Resultate dieser Phase III Studien sind noch ausstehend, die Einordnung wird eine Herausforderung sein, da letztendlich die Frage, welche Patienten nach dem neoadjuvanten Einsatz von Checkpoint-Inhibitoren noch von einer zusätzlichen adjuvanten Therapiekomponente profitieren, durch diese Studien nicht beantwortet wird. Sicherlich wird der perioperative Einsatz von Checkpoint-Inhibitoren ein neuer Standard in der Therapie des resektablen NSCLC werden, wobei die genaue Population bezüglich Stadium und PD-L1 Status, die Rolle der adjuvanten Chemotherapie und auch des optimalen Zeitpunktes sicher noch zu diskutieren sind.
Zusammenfassung
Immuncheckpoint-Inhibitoren sind bei Patienten mit NSCLC ohne Treibermutationen aus dem Therapiearmentarium nicht wegzudenken. Der jetzt bekannte Benefit auch in nicht-metastasierten Stadien wird die Therapielandschaft nochmals grundlegend verändern, wobei viele Fragen bezüglich optimaler Patientenselektion und Therapiesequenz noch offen sind.
Copyright bei Aerzteverlag medinfo AG
Kantonsspital St.Gallen
Rorschacherstrasse 95
9007 St.Gallen
Universitätsklinik für Medizinische Onkologie
Inselspital
Freiburgstrasse 18
3010 Bern
S. Schmid: Research grants (all institutional): AstraZeneca, BMS, Janssen. Advisory board (all institutional): AstraZeneca, BMS, MSD, Boehringer Ingelheim. Travel support: MSD, Takeda, Boehringer Ingelheim. L. Markhardt deklariert keine Interessenkonflikte im Zusammenhang mit diesem Beitrag.
◆ Checkpoint-Inhibitoren sind integraler Bestandteil der Systemtherapie bei lokal fortgeschrittenen NSCLC ohne molekulare Alteration.
◆ Basierend auf den kürzlich präsentierten Daten von 3 grossen Phase III Studien werden Checkpoint-Inhibitoren Einzug ins perioperative Management von resektablen NSCLC erhalten.
◆ Atezolizumab ist für die adjuvante Therapie bei Patienten mit reseziertem Stadium II-IIIA NSCLC und einer PDL-1 Expression bereits neu von der Swissmedic zugelassen.
◆ Der PDL-1 Status dient insbesondere in der metastasierten Situation als Biomaker zur Therapieselektion, in der perioperativen Situation ist sein Stellenwert bislang kontrovers diskutiert
1. Hirva Mamdani et al., Immunotherapy in Lung Cancer: Current Landscape and Future Directions, Front Immunol. 2022 Feb 9;13:823618.
2. N.B. Leighl, MD et al., Pembrolizumab in patients with advanced non-small-cell lung cancer (KEYNOTE-001): 3-year results from an open-label, phase 1 study. The Lancet VOLUME 7, ISSUE 4, P347-357, APRIL 01, 2019
3. Martin Reck, M.D. et al., Pembrolizumab versus Chemotherapy for PD-L1–Positive Non–Small-Cell Lung Cancer, N Engl J Med 2016; 375:1823-1833
4. Roy S. Herbst, M.D, Atezolizumab for First-Line Treatment of PD-L1–Selected Patients with NSCLC, N Engl J Med 2020; 383:1328-1339
5. Ahmet Sezer, MD et al., Cemiplimab monotherapy for first-line treatment of advanced non-small-cell lung cancer with PD-L1 of at least 50%: a multicentre, open-label, global, phase 3, randomised, controlled trial; The Lancet, Vol-ume 397, issue 10274, p592-604, february 13, 2021
6. David P. Carbone, MD et al., First-Line Nivolumab in Stage IV or Recurrent Non–Small-Cell Lung Cancer, N Engl J Med 2017; 376:2415-2426
7. Akinboro O, et al. Outcomes of anti–PD-(L)1 therapy with or without chemotherapy (chemo) for first-line (1L) treat-ment of advanced non–small cell lung cancer (NSCLC) with PD-L1 score ≥ 50%: FDA pooled analysis; J Clin Oncol 2022;40(suppl):Abstr 9000
8. PRINCETON, N.J, Landmark Five-Year Data from Phase 3 CheckMate -227 Trial Demonstrate Long-Term, Durable Survival Outcomes with Opdivo(nivolumab) Plus Yervoy (ipilimumab) in First-Line Treatment of Patients with Metastat-ic Non-Small Cell Lung Cancer. BMS 06.06.2022
9. M. Johnson et al., PL02.01 Durvalumab ± Tremelimumab + Chemotherapy as First-line Treatment for mNSCLC: Results from the Phase 3 POSEIDON Study; jto, volume 16, issue 10, supplement , s844, october 01, 2021
10. Prof Luis Paz-Ares, MD, First-line nivolumab plus ipilimumab combined with two cycles of chemotherapy in pa-tients with non-small-cell lung cancer (CheckMate 9LA): an international, randomised, open-label, phase 3 trial; The Lancet Oncology, volume 22, issue 2, p198-211, february 01, 2021
11. David R. Spigel, MD et al., Five-Year Survival Outcomes From the PACIFIC Trial: Durvalumab After Chemoradio-therapy in Stage III Non–Small-Cell Lung Cancer, J Clin Oncol. 2022 Apr 20; 40(12): 1301–1311
12. Alex A. Adjei, MD, PhD et al., Expansion of treatments and insights in the early-stage disease setting, Springer-Verlag GmbH Austria, part of Springer Nature Vol. 14 · Suppl 7/2021
13. Reck M. et al., Two-year update from KEYNOTE-799: Pembrolizumab plus concurrent chemoradiation therapy (cCRT) for unresectable, locally advanced, stage III NSCLC.; ASCO 2022, 8508
14. Greg Andrew Durm et al., Consolidation nivolumab plus ipilimumab or nivolumab alone following concurrent chemoradiation for patients with unresectable stage III non-small cell lung cancer: BTCRC LUN 16-081. 2022 ASCO Annual Meeting I
15. Jean-Pierre Pignon et al., Lung Adjuvant Cisplatin Evaluation: A Pooled Analysis by the LACE Collaborative Group, Clinical Oncology 26, no. 21 (July 20, 2008) 3552-3559.
16. Enriqueta Felip et al., Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial; Lancet. 2021 Oct 9;398(10308):1344-1357
17. L. Paz-Ares, VP3-2022: Pembrolizumab (pembro) versus placebo for early-stage non-small cell lung cancer (NSCLC) following complete resection and adjuvant chemotherapy (chemo) when indicated: Randomized, triple-blind, phase III EORTC-1416-LCG/ETOP 8-15 – PEARLS/KEYNOTE-091 study, oncologypro, published: March 17, 2022
18. O’Brien MER, et al. J Clin Oncol 2022;40(suppl):Abstr 8512
19. Patrick M. Forde et al., Neoadjuvant Nivolumab plus Chemotherapy in Resectable Lung Cancer, N Engl J Med 2022; 386:1973-1985
20. Provencio-Pulla M, et al, Nivolumab + chemotherapy versus chemotherapy as neoadjuvant treatment for re-sectable stage IIIA-B NSCLC: Primary endpoint results of pathological complete response (pCR) from phase II NADIM II trial; J Clin Oncol 2022;40(suppl):Abstr 8501
21. Hanfei Guo et al., Advances and challenges in immunotherapy of small cell lung cancer, Chin J Cancer Res. 2020 Feb; 32(1): 115–128.
22. S. Peters et al., First-line nivolumab plus ipilimumab versus chemotherapy in patients with unresectable malignant pleural mesothelioma: 3-year outcomes from CheckMate 743, Annals of oncology VOLUME 33, ISSUE 5, P488-499, MAY 01, 2022
23 Naoyuki Nogami et al, IMpower150 Final Exploratory Analyses for Atezolizumab Plus Bevacizumab and Chemo-therapy in Key NSCLC Patient Subgroups With EGFR Mutations or Metastases in the Liver or Brain, J Thorac Oncol, 2022 Feb;17(2):309-323.
24 Leena Gandhi, M.D. et al., Pembrolizumab plus Chemotherapy in Metastatic Non–Small-Cell Lung Cancer, N Engl J Med 05/2018; 378:2078-2092
25. Howard West et al., Atezolizumab in combination with carboplatin plus nab-paclitaxel chemotherapy compared with chemotherapy alone as first-line treatment for metastatic non-squamous non-small-cell lung cancer (IMpow-er130): a multicentre, randomised, open-label, phase 3 trial; Lancet Oncol. 2019 Jul; 20 (7):924-937
26. Jose M. Pacheco; KEYNOTE-407: changing the way we treat stage IV squamous non-small cell lung cancer; Transl Lung Cancer Res. 2020 Feb; 9(1): 148–153.
info@onco-suisse
- Vol. 12
- Ausgabe 6
- September 2022