- Karzinosarkome des weiblichen Genitaltrakts (MMMT)
Karzinosarkome / MMMT des weiblichen Geschlechtstrakts sind, ähnlich wie Endometriumkarzinome hochmaligne biphasische Tumoren mit mesodermalen sowie epithelialen Komponenten und haben eine schlechte Prognose, wobei die erfolgte Therapie ausschlaggebend ist. Wegen ihres seltenen Vorkommens fehlen bisher grosse epidemiologische Studien. Die Autoren diskutieren die verschiedenen Therapiemöglichkeiten und fassen die Literatur zur Systemtherapie zusammen, mit Einbezug der Daten ihrer retrospektiven Kohortenstudie.
Les carcinosarcomes /MMMT de l’appareil reproductif féminin sont, comme les carcinomes endométriaux, des tumeurs biphasiques hautement malignes avec des composantes mésodermiques et épithéliales et ont un mauvais pronostic, le traitement effectué étant déterminant. En raison de leur rareté, les grandes études épidémiologiques font encore défaut. Les auteurs discutent des différentes options thérapeutiques et résument la documentation sur la thérapie systémique,
y compris les données de leur étude de cohorte rétrospective.
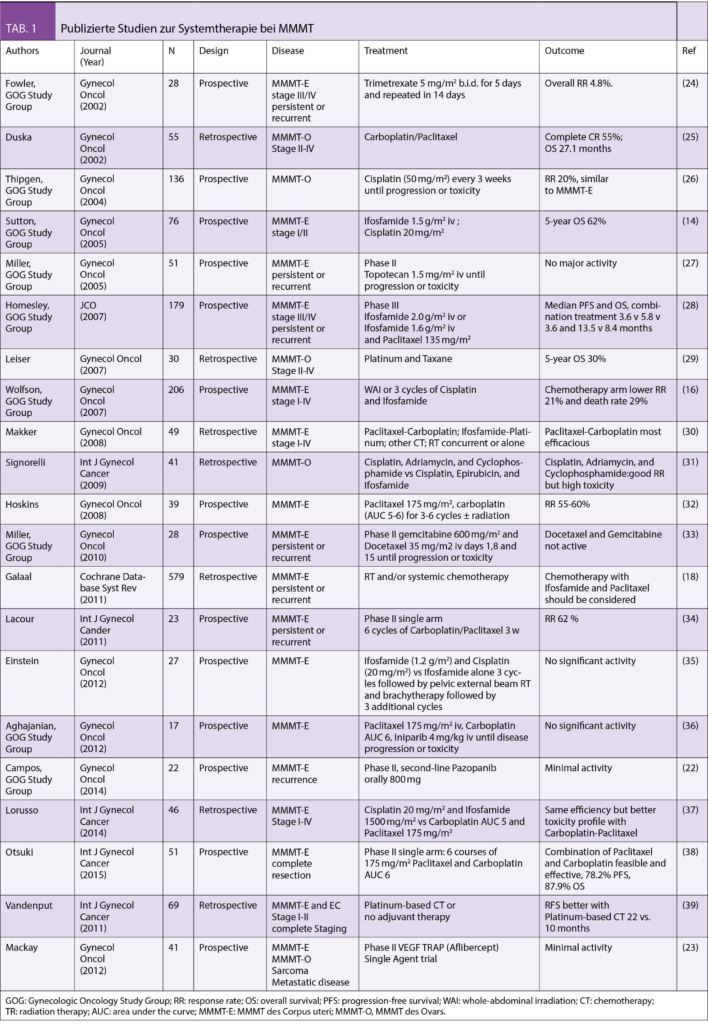
Karzinosarkome/MMMT des weiblichen Genitaltraktes sind hochmaligne biphasische Tumoren, die sowohl maligne mesodermale als auch epitheliale Komponenten besitzen (1). Typischerweise besteht die Histologie der Metastasen meist aus karzinosarkomatösen Elementen (2, 3, 4). Aufgrund der Rarität der MMMT, gibt es keine grossen epidemiologischen Studien. In Analogie zum Endometriumkarzinom wurde das MMMT des Corpus uteri entsprechend dem aggressiven Typ II Karzinom des Endometriumkarzinoms subsumiert. Generell ist die Prognose bei MMMT des Corpus uteri nicht gut, mit einem medianen Überleben von 21 Monaten aufgrund des fortgeschrittenen Stadiums in 35% der MMMT, bei denen der Tumor zum Diagnosezeitpunkt nicht auf den Uterus begrenzt ist (5, 6). Allerdings ist hierbei die erfolgte Therapie wichtig und ausschlaggebend, d.h. eine gynäkologisch-onkologisch durchgeführte Hysterektomie, Adnexektomie und mindestens pelvine Lymphonodektomie (11). Im Falle einer metastasierten Erkrankung jedoch braucht es die komplette zytoreduktive Operation (siehe auch Abb. 1-3). Das 5-Jahres-Überleben bei MMMT des Corpus uteri beträgt 59% im FIGO Stadium I-II, 22% im Stadium III und 9% im Stadium IV (7). Ein Problem dabei ist das Auftreten von möglichen okkulten Metastasen im Bauchraum, die dann zum Rezidiv führen (8-10). Die Zytoreduktion kann auch in den metastasierten Stadien zu einer deutlichen Verbesserung der Prognose führen (12).
«Mutational Landscape» des MMMT
Eine kürzlich publizierte Studie untersuchte die «Mutational Landsacpe» des MMMT und verglich dies mit dem epithelialen Ovarialkarzinom. Hierbei wurden 110 MMMT des Ovars (MMMT-O), 141 MMMT des Corpus uteri (MMMT-U) und 1587 Ovarialkarzinome (OC) aller Histotypen miteinander verglichen. Eine p53 Mutation war die am Häufigsten nachzuweisende (76.4% in MMMT-O, 68.8% in MMMT-E und 69% in OC)(20). Genetische Veränderungen in den PI3K/AKT/mTOR und MAPK Pathways waren ähnlich häufig vorhanden bei den MMMT des Ovars und Ovarialkarzinomen, aber weniger häufig bei MMMT des Corpus uteri (p<0.001). Bei den Ovarialkarzinomen bestand die grösste Chance eine BRCA1 Mutation nachzuweisen (20% und 9-18% bei den MMMT). Kein Unterschied bestand bei RB, NOTCH, Angiogenese und FGFR Pathways, währenddessen Östrogen- sowie Androgenrezeptoren weniger häufig bei den MMMT exprimiert waren als beim Ovarialkarzinom. Dies hat sicher therapeutische Konsequenz, da Ovarialkarzinome mehr und mehr mit Aromatasehemmern behandelt werden.
Systemtherapie beim MMMT
Der prognostische Benefit der Chemotherapie bei den MMMT des Corpus uteri wurde bewiesen. Die wichtigsten Substanzen sind: Cisplatin, Carboplatin, Ifosfamid, Anthrazykline und Paclitaxel (13, 14, 15). Eine Cochrane-Analyse an 579 Patientinnen verglich adjuvante Radiotherapie mit Kombinations-Chemotherapie (mit Ifosfamid und Paclitaxel versus Ifosfamid allein) in rezidivierten Stadien III/IV MMMT. Die Autoren fanden hierbei ein verbessertes Überleben in den Kombinations-Chemotherapie Armen, so dass man einer Kombinations-Chemotherapie vor Radiotherapie den Vorzug geben sollte (13, 16, 17, 18). Beim MMMT-U hat sich in Analogie zum Endometriumkarzinom die Systemtherapie mit 6 Zyklen Carboplatin/Paclitaxel (qw3) durchgesetzt. Hierzu gibt es allerdings prospektiv randomisierte Daten gegen ein Platin/Anthracyline-haltiges Schema (11, 15). Viele Therapieansätze wurden von Studien zum Endometrium- oder Ovarialkarzinom exploriert, was die Biologie der Erkankung nicht immer widerspiegelt (21). Tabelle 1 gibt eine Übersicht über die wichtigsten Systemtherapiestudien für das MMMT.
«Quo vadis» Anthracyline?
Wir haben selbst eine grosse Kohorte an MMMT des Corpus uteri und Ovars am Gynecological Cancer Centre im Royal Hospital for Women retrospektiv analysiert, bestehend aus Patientinnen mit Carboplatin/Anthrazyklinen, Carboplatin/Ifosfamid oder Carboplatin/Paclitaxel. Zusätzlich haben wir NGS- und IHC-Analysen durchgeführt (41 und unpublizierte Daten). Unsere Daten zeigen, dass jede Kombination ohne Paclitaxel besser ist als die Kombination Carboplatin/Paclitaxel.
Am ASCO 2019 hat Matthew Powell die GOG261-Studie vorgestellt (42). Hierbei wurden Patientinnen mit FIGO-Stadium I-IV persistierendem oder rezidiviertem MMMT des Corpus uteri in 2 Arme randomisiert: im ersten Arm erhielten die Patientinnen Ifosfamid und Paclitaxel, im zweiten Arm erhielten sie Carboplatin und Paclitaxel. Die Resultate zeigten eine bessere Verträglichkeit in der Kombination von Carboplatin und Paclitaxel bei identischem Outcome, was das Gesamtüberleben und die Rezidivrate betrifft. Diese Studie führt zu einer Änderung unseres Standards bei Patientinnen mit persistierendem oder rezidiviertem MMMT des Corpus uteri. Was die Studie vermissen lässt, ist ein experimenteller Arm, der die Rolle der Anthracyline prospektiv untersucht.
Literatur zur Systemtherapie (Tabelle 1)
Tabelle 1 gibt einen Überblick über die Studien mit Systemtherapie beim MMMT. Insgesamt wurden 1214 Patientinnen in verschiedene Studien eingeschlossen, davon waren aber nur 21.5% MMMT des Ovars. Cisplatin-basierte Chemotherapie wurde in den meisten adjuvanten Studien untersucht (67%).
Zielgerichtete Therapie und personalisierte Therapien
Da MMMT insgesamt sehr selten sind, gibt es noch wenige Daten zur «targeted Therapy». Eine Studie mit VEGF-gerichteter Therapie, eine zu Pazopanib (nur in MMMT des Corpus uteri) und einer mit Aflibercept (in allen MMMT) zeigte leider nur einen minimalen Effekt in der Gruppe der MMMT. (22, 23).
Auch neuere Ansätze aus der Immuntherapie werden zur Zeit geprüft. Aus dem TGCA-Atlas geht hervor, dass rund 3.5% der uterinen Karzinosarkome eine hohe Mikrosatelliteninstabilität haben und damit eine Immuntherapie mit einem Checkpointinhibtor vielversprechend ist (40). Behandlungsstrategien für MMMT unabhängig vom Organ sollten zukünftig auf die Driver-Mutationen p53 oder KRAS/PI3KCA ausgerichtet werden und so Studienmedikationen zielgerichtet auf den genetischen Ursprung ausgerichtet verabreicht werden. Hierfür benötigt es jedoch grosse kollaborative Studien mit vorgeschalteter molekularer Untersuchung.
Leiterin Frauenklinik & Gynäkologisches Tumorzentrum
Chefärztin Gynäkologie/Gyn. Onkologie
Frauenklinik
Universitätsspital Basel
Spitalstrasse 21
4031 Basel
viola.heinzelmann@usb.ch
Zentrum Onkologie und Hämatologie
Tumorzentrum Baselland
Kantonsspital Baselland
Rheinstrasse 26
4410 Liestal
Schweiz
marcus.vetter@ksbl.ch
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Beitrag deklariert.
- Die Behandlung des MMMT bleibt eine Herausfordernung.
- Wie beim Ovarialkarzinom braucht es ein optimales zytoreduktives Vorgehen bzw. Staging.
- Bezüglich der Systemtherapie sind die Bücher noch nicht geschlossen, eigene Daten weisen einen Vorteil einer platin-/anthracylin-haltigen Chemotherapie auf.
- Personalisierte Ansätze sind in der Erprobung. Bei der geringen Zahl an Patientinnen werden diese Tumore meist in Basket-Studien oder Endometriumkarzinom/Ovarilakarzinom-Studien behandelt.
Messages à retenir
- Le traitement des carcinosarcomes / MMMT demeure un défi.
- Comme pour le cancer de l’ovaire, une procédure cytoreductrice optimale resp. un Staging est nécessaire.
- En ce qui concerne la thérapie systémique, les livres ne sont pas encore fermés, nos propres données montrent un avantage de la chimiothérapie contenant du platine et de l’anthracyline.
- Des approches personnalisées sont en cours d’expérimentation. Etant donné le petit nombre de patientes, ces tumeurs sont généralement traitées dans le cadre d’études de panier ou d’études de carcinome endométrial / ovarien.
1. Kernochan LE, Garcia RL. Carcinosarcomas (malignant mixed Müllerian tumor) of the uterus: advances in elucidation of biologic and clinical characteristics. J. Natl. Compr. Canc. Netw. 2009; 7(5):550–6; quiz 557.
2. Silverberg SG, Major FJ, Blessing JA et al. Carcinosarcoma (malignant mixed mesodermal tumor) of the uterus. A Gynecologic Oncology Group pathologic study of 203 cases. Int. J. Gynecol. Pathol. 1990; 9(1):1–19.
3. McCluggage WG. Uterine carcinosarcomas (malignant mixed Mullerian tumors) are metaplastic carcinomas. Int. J. Gynecol. Cancer ; 12(6):687–90.
4. Gorai I, Yanagibashi T, Taki A et al. Uterine carcinosarcoma is derived from a single stem cell: an in vitro study. Int. J. cancer 1997; 72(5):821–7.
5. Gadducci A, Sartori E, Landoni F et al. The prognostic relevance of histological type in uterine sarcomas: a Cooperation Task Force (CTF) multivariate analysis of 249 cases. Eur. J. Gynaecol. Oncol. 2002; 23(4):295–9.
6. Livi L, Andreopoulou E, Shah N et al. Treatment of uterine sarcoma at the Royal Marsden Hospital from 1974 to 1998. Clin. Oncol. (R. Coll. Radiol). 2004; 16(4):261–8.
7. Gonzalez Bosquet J, Terstriep SA, Cliby WA et al. The impact of multi-modal therapy on survival for uterine carcinosarcomas. Gynecol. Oncol. 2010; 116(3):419–23.
8. Yamada SD, Burger RA, Brewster WR et al. Pathologic variables and adjuvant therapy as predictors of recurrence and survival for patients with surgically evaluated carcinosarcoma of the uterus. Cancer 2000; 88(12):2782–6.
9. Manolitsas TP, Wain G V, Williams KE et al. Multimodality therapy for patients with clinical Stage I and II malignant mixed Müllerian tumors of the uterus. Cancer 2001; 91(8):1437–43.
10. Vorgias G, Fotiou S. The role of lymphadenectomy in uterine carcinosarcomas (malignant mixed mullerian tumours): a critical literature review. Arch. Gynecol. Obstet. 2010; 282(6):659–64.
11. NCCN. Uterine Neoplasms. Pract. Guidel. Oncol. 2001:1–48.
12. Tanner EJ, Leitao MM, Garg K et al. The role of cytoreductive surgery for newly diagnosed advanced-stage uterine carcinosarcoma. Gynecol. Oncol. 2011; 123(3):548–52.
13. Sutton G, Brunetto VL, Kilgore L et al. A phase III trial of ifosfamide with or without cisplatin in carcinosarcoma of the uterus: A Gynecologic Oncology Group Study. Gynecol. Oncol. 2000; 79(2):147–53.
14. Sutton G, Kauderer J, Carson LF et al. Adjuvant ifosfamide and cisplatin in patients with completely resected stage I or II carcinosarcomas (mixed mesodermal tumors) of the uterus: a Gynecologic Oncology Group study. Gynecol. Oncol. 2005; 96(3):630–4.
15. Berton-Rigaud D, Devouassoux-Shisheboran M, Ledermann JA et al. Gynecologic Cancer InterGroup (GCIG) consensus review for uterine and ovarian carcinosarcoma. Int. J. Gynecol. Cancer 2014; 24(9 Suppl 3):S55-60.
16. Wolfson AH, Brady MF, Rocereto T et al. A gynecologic oncology group randomized phase III trial of whole abdominal irradiation (WAI) vs. cisplatin-ifosfamide and mesna (CIM) as post-surgical therapy in stage I-IV carcinosarcoma (CS) of the uterus. Gynecol. Oncol. 2007; 107(2):177–85.
17. Homesley HD, Filiaci V, Gibbons SK et al. A randomized phase III trial in advanced endometrial carcinoma of surgery and volume directed radiation followed by cisplatin and doxorubicin with or without paclitaxel: A Gynecologic Oncology Group study. Gynecol. Oncol. 2009; 112(3):543–552.
18. Galaal K, van der Heijden E, Godfrey K et al. Adjuvant radiotherapy and/or chemotherapy after surgery for uterine carcinosarcoma. Cochrane database Syst. Rev. 2013; (2):CD006812.
19. Schott AF, Perou CM, Hayes DF. Genome Medicine in Cancer: What’s in a Name? Cancer Res. 2015; 75(10):1930–5.
20. Mahdi H, Xiu J, Reddy SK DR. Ovarian carcinosarcoma share similar molecular profile as ovarian serous carcinoma but not endometrial carcinosarcoma. J Clin Oncol 33 2015 2015.
21. Cantrell LA, Blank S V, Duska LR. Uterine carcinosarcoma: A review of the literature. Gynecol. Oncol. 2015; 137(3):581–8.
22. Campos SM, Brady WE, Moxley KM et al. A phase II evaluation of pazopanib in the treatment of recurrent or persistent carcinosarcoma of the uterus: a gynecologic oncology group study. Gynecol. Oncol. 2014; 133(3):537–41.
23. Mackay HJ, Buckanovich RJ, Hirte H et al. A phase II study single agent of aflibercept (VEGF Trap) in patients with recurrent or metastatic gynecologic carcinosarcomas and uterine leiomyosarcoma. A trial of the Princess Margaret Hospital, Chicago and California Cancer Phase II Consortia. Gynecol. Oncol. 2012; 125(1):136–40.
24. Fowler JM, Blessing JA, Burger RA, Malfetano JH. Phase II evaluation of oral trimetrexate in mixed mesodermal tumors of the uterus: a gynecologic oncology group study. Gynecol. Oncol. 2002; 85(2):311–4.
25. Duska LR, Garrett A, Eltabbakh GH et al. Paclitaxel and platinum chemotherapy for malignant mixed müllerian tumors of the ovary. Gynecol. Oncol. 2002; 85(3):459–63.
26. Tate Thigpen J, Blessing JA, DeGeest K et al. Cisplatin as initial chemotherapy in ovarian carcinosarcomas: a Gynecologic Oncology Group study. Gynecol. Oncol. 2004; 93(2):336–9.
27. Miller DS, Blessing JA, Schilder J et al. Phase II evaluation of topotecan in carcinosarcoma of the uterus: a Gynecologic Oncology Group study. Gynecol. Oncol. 2005; 98(2):217–21.
28. Homesley HD, Filiaci V, Markman M et al. Phase III trial of ifosfamide with or without paclitaxel in advanced uterine carcinosarcoma: a Gynecologic Oncology Group Study. J. Clin. Oncol. 2007; 25(5):526–31.
29. Leiser AL, Chi DS, Ishill NM, Tew WP. Carcinosarcoma of the ovary treated with platinum and taxane: the memorial Sloan-Kettering Cancer Center experience. Gynecol. Oncol. 2007; 105(3):657–61.
30. Makker V, Abu-Rustum NR, Alektiar KM et al. A retrospective assessment of outcomes of chemotherapy-based versus radiation-only adjuvant treatment for completely resected stage I-IV uterine carcinosarcoma. Gynecol. Oncol. 2008; 111(2):249–54.
31. Signorelli M, Chiappa V, Minig L et al. Platinum, anthracycline, and alkylating agent-based chemotherapy for ovarian carcinosarcoma. Int. J. Gynecol. Cancer 2009; 19(6):1142–6.
32. Hoskins PJ, Le N, Ellard S et al. Carboplatin plus paclitaxel for advanced or recurrent uterine malignant mixed mullerian tumors. The British Columbia Cancer Agency experience. Gynecol. Oncol. 2008; 108(1):58–62.
33. Miller BE, Blessing JA, Stehman FB et al. A phase II evaluation of weekly gemcitabine and docetaxel for second-line treatment of recurrent carcinosarcoma of the uterus: a gynecologic oncology group study. Gynecol. Oncol. 2010; 118(2):139–44.
34. Lacour RA, Euscher E, Atkinson EN et al. A phase II trial of paclitaxel and carboplatin in women with advanced or recurrent uterine carcinosarcoma. Int. J. Gynecol. Cancer 2011; 21(3):517–22.
35. Einstein MH, Klobocista M, Hou JY et al. Phase II trial of adjuvant pelvic radiation “sandwiched” between ifosfamide or ifosfamide plus cisplatin in women with uterine carcinosarcoma. Gynecol. Oncol. 2012; 124(1):26–30.
36. Aghajanian C, Sill MW, Secord AA et al. Iniparib plus paclitaxel and carboplatin as initial treatment of advanced or recurrent uterine carcinosarcoma: a Gynecologic Oncology Group Study. Gynecol. Oncol. 2012; 126(3):424–7.
37. Lorusso D, Martinelli F, Mancini M et al. Carboplatin-Paclitaxel versus Cisplatin-Ifosfamide in the treatment of uterine carcinosarcoma: a retrospective cohort study. Int. J. Gynecol. Cancer 2014; 24(7):1256–61.
38. Otsuki A, Watanabe Y, Nomura H et al. Paclitaxel and carboplatin in patients with completely or optimally resected carcinosarcoma of the uterus: a phase II trial by the Japanese Uterine Sarcoma Group and the Tohoku Gynecologic Cancer Unit. Int. J. Gynecol. Cancer 2015; 25(1):92–7.
39. Vandenput I, Trovik J, Vergote I et al. The role of adjuvant chemotherapy in surgical stages I-II serous and clear cell carcinomas and carcinosarcoma of the endometrium: a collaborative study. Int. J. Gynecol. Cancer 2011; 21(2):332–6.
40. Bonneville R, Krook MA, Kautto EA, Miya J, Wing MR, Chen HZ, Reeser JW, Yu L, Roychowdhury S. Landscape of Microsatellite Instability Across 39 Cancer Types. JCO Precis Oncol. 2017;2017. doi: 10.1200/PO.17.00073. Epub 2017 Oct 3
41. Heinzelmann-Schwarz VA et. al. J Clin Oncol 37, 2017 (suppl; abstr 5563) and Heinzelmann-Schwarz VA, Kind A, Vetter Met al. Should MMMT still be treated with adjuvant taxane-based combination chemotherapy? JCRCO 2019 (accepted)
42. Powell MA et. al., J Clin Oncol 37, 2019 (suppl; abstr 5500)
info@onco-suisse
- Vol. 9
- Ausgabe 6
- Dezember 2019