- Krebstherapie und kardiologische Nachsorge
Kardiovaskuläre Komplikationen sind die häufigsten Ursachen für Morbidität und Mortalität nach Tumorbehandlungen bei Jugendlichen In diesem Artikel wird auf die kardiovaskuläre Nachsorge dieser Patienten eingegangen.
Les complications cardiovasculaires sont les causes les plus fréquentes de morbidité et de mortalité après un traitement tumoral chez les adolescents. Cet article traite du suivi cardio-vasculaire de ces patients.
Die 5-Jahres-Überlebensrate beträgt heutzutage bis zu 80% bei Patienten mit Tumorerkrankungen im jungen Lebensalter (10 bis < 35 Jahre) (1). Dieser herausragende therapeutische Erfolg ist jedoch begleitet von Spät-Komplikationen der Tumorbehandlung, welche bei bis zu 40% aller Patienten beobachtet werden, die mehr als 30 Jahre die Tumordiagnose überlebt haben (2). Typische Spät-Komplikationen sind maligne Zweit-Tumore, endokrine und kardiopulmonale Dysfunktion, kardiovaskuläre Komplikationen, Nierenerkrankungen und neuronale Sensibilitätsstörungen (2). Die häufigsten Ursachen für Morbidität und Mortalität sind kardiovaskuläre Komplikationen wie die koronare Herzerkrankung und insbesondere die Herzinsuffizienz (3).
Riskostratifizierung
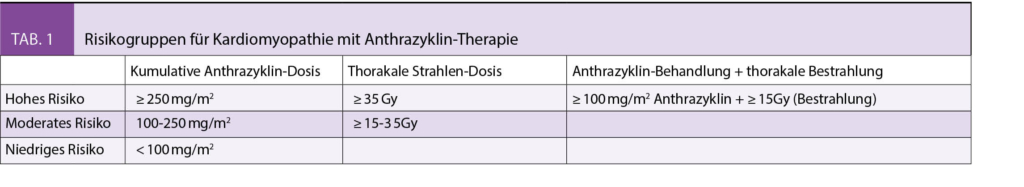
Verglichen mit der allgemeinen Bevölkerung ist bei Langzeit-Überlebenden nach Tumorerkrankung im jungen Lebensalter das Risiko für eine Herzinsuffizienz 15fach erhöht, und 7fach für einen plötzlichen Herztod (4). Insbesondere die kumulative Anthrazyklin-Dosis (gerechnet in Doxorubicin-Äquivalenzdosis) ist in diesem Zusammenhang wichtig, so beträgt die Inzidenz der Herzinsuffizienz bei < 250 mg/m2 < 5%, bei 250-600 mg/m2 < 10%, und bei > 600 mg/m2 > 30% (4). War das Herz im Feld einer thorakalen Strahlentherapie miteinbezogen, so ist die Inzidenz der Herzinsuffizienz ebenfalls deutlich erhöht bei Applikation von ≥ 35 Gy, erhöht bei 15 < 35 Gy, und nicht oder nur wenig erhöht bei < 15 Gy (5) (Tab. 1). Die Tatsache, dass ungefähr 60% aller Langzeit-Überlebenden entweder eine Anthrazyklin-basierte Chemotherapie, eine Radiotherapie, oder beides in Kombination erhalten haben, unterstreicht die Bedeutung einer kardiovaskulären Nachsorge. Tatsächlich wird geschätzt, dass 30 Jahre nach Tumorbehandlung mit Anthrazyklinen und thora-kaler Strahlentherapie ein akut lebensbedrohliches kardiovaskuläres Ereignis bei einem von acht Patienten auftritt (5).
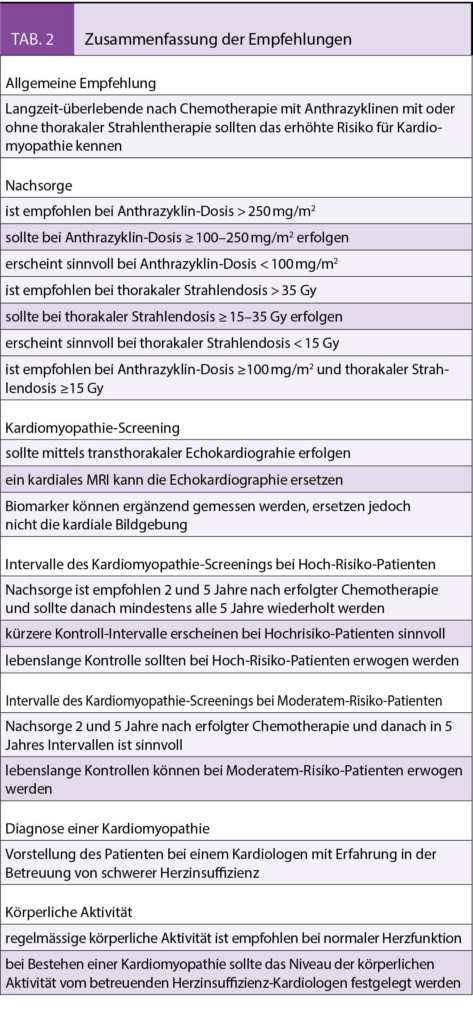
Jedoch können auch Patienten, welche nicht mit Anthrazyklinen oder Strahlentherapie behandelt wurden, ein erhöhtes Risiko für ein kardiovaskuläres Ereignis haben. In einer 2015 publizierten Studie wurde ein Risiko-Score vorgestellt, welcher das individuelle Risiko für eine Herzinsuffizienz berechnet bei Langzeit-Überlebenden nach Tumorbehandlung im jungen Lebensalter mit oder ohne Anthrazyklinen. Patienten mit einem hohen Risiko entwickelten eine Herzinsuffizienz mit einer Inzidenz von 11.7%, bei einem mittleren und niedrigem Risiko betrug die Inzidenz 2.4% respektive 0.5% gemessen über einen Zeitraum von 40 Jahre nach Tumorbehandlung (6). Die Anwendung dieses Scores ermöglicht eine individuelle Risiko-Stratifizierung und darauf aufbauend einen individuellen Plan für die Nachkontrollen. Zusammenfassend sollten alle Patienten mit Anthrazyklin-Behandlung mit oder ohne begleitende Strahlentherapie nachkontrolliert werden sowie Patienten, welche ein hohes oder mittleres Risiko haben, obwohl die Tumorbehandlung ohne Anthrazykline erfolgte.
Diese Empfehlungen gelten unabhängig vom Lebensalter zum Zeitpunkt der Chemotherapie und dem Anthrazyklin-Molekül, welches in der Chemotherapie eingesetzt wurde. Da Langzeit-Daten fehlen für die Patienten, welche eine Chemotherapie-begleitende Therapie mit dem kardioprotektiven Dexrazoxan erhalten haben, gelten die Nachsorge-Empfehlungen gleichermassen für diese Patienten.
Kardiomyopathie-Screening
Empfehlungen für das Kardiomyopathie-Screening von Tumorpatienten im jungen Lebensalter variieren zwischen den Fachgesellschaften. Während die UK Children’ s Cancer and Leukemia Group die erste Kontrolle in kurzem Abstand zur Tumorbehandlung von 1-3 Monaten empfiehlt, wird ein Intervall von 2-5 Jahren durch die North American Children’ s Oncology Group, die Dutch Childhood Oncology Group, und die Scottish Intercollegiate Guidelines Network als ausreichend erachtet. Einigkeit besteht dahingehend, dass Kontrollen lebenslang im Intervall von 2-5 Jahren durchgeführt werden sollten bei Patienten mit hohem und mittlerem Risiko für eine Herzinsuffizienz (7). Allerdings wird empfohlen, auch Patienten mit einem niedrigen Risiko in der Nachkontrolle zu behalten. Grund ist die ausserordentlich hohe inter-individuelle Variabilität, welche möglicherweise mit Genvarianten verschiedener Enzyme und Proteine zusammenhängt, die bei Transport und Metabolisierung des Anthrazyklins eine Rolle spielen, oder für das myokardiale Remodeling relevant sind. Unabhängig vom individuellen Risiko gilt jedoch, dass das Risiko für eine Herzinsuffizienz mit zunehmendem Abstand zur Behandlung des Tumors ansteigt (8).
Kontrollen sollten immer eine 2-dimensionale transthorakale Echokardiographie beinhalten, wobei häufig die longitudinale Strain-Messung pathologisch verändert ist und dies auch bei Patienten mit erhaltener linksventrikulärer Pumpfunktion (9). Die prognostische Bedeutung dieser diastolischen Funktionsstörung ist aktuell noch unklar, sie wird jedoch in Langzeit-Studien aktuell weiter evaluiert. Das kardiale MRI sollte immer dann zum Einsatz kommen, wenn die Bildqualität der Echokardiographie unzureichend ist. Ergänzend kann Messung des kardialen Troponins oder des NT-proBNPs durchgeführt werden, jedoch können Normalwerte eine asymptomatische Kardiomyopathie nicht ausschliessen. Grundsätzlich gilt, dass eine Koronarographie immer indiziert werden sollte, wenn klinische Symptome mit einer koronaren Herzerkrankung vereinbar sind. Dies gilt insbesondere bei Patienten mit Applikation von Hochdosis-Strahlentherapie im Bereich der Herzkranzgefässe.
Weitere relevante Informationen zur Nachsorge bei diesen Patienten bauen auf Analysen des British Childhood Cancer Survivor Study auf (8), welche eine überdurchschnittliche Erhöhung der kardialen Mortalität bei über 50 jährigen aufzeigen, insbesondere bei Patienten mit Tumorbehandlung in den Jahren 1980-1989. Dies sollte zum Anlass genommen werden, diese Patientengruppe engmaschiger zu kontrollieren.
Darüberhinaus haben Untersuchungen bei Langzeit-Überlebenden nach Tumorbehandlung im jungen Lebensalter nachgewiesen, dass die klinische Manifestation typischer kardiovaskulärer Risikofaktoren früher auftritt als bei nicht behandelten Geschwistern oder der allgemeinen Bevölkerung. Ist bereits eine arterielle Hypertension respektive ein Diabetes manifest, so wird das Risiko für ein gravierendes kardiovaskuläres Ereignis erhöht (10). Daher sollte bei jeder Nachkontrolle ein besonderes Augenmerk auf die kardiovaskulären Risikofaktoren gelegt und frühzeitig gezielt behandelt werden.
Behandlung einer Kardiomyopathie
Leider gibt es keine Studien mit relevanten Patientenzahlen, in denen die therapeutische Strategie zur Behandlung von asymptomatischer Kardiomyopathie nach vorausgegangener Tumorbehandlung im jungen Lebensalter untersucht wurde. In Analogie zum SOLVD-Prevention Trial, welche den Effekt von Enalapril bei Patienten mit asymptomatischer Kardiomyopathie anderweitiger Genese untersucht hatte, kann eine Behandlung mit ACE-Hemmern empfohlen werden (11). Eine Studie zur Untersuchung des Betablockers Carvedilol ist aktuell im Gange. Patienten mit Kardiomyopathie ohne oder mit klinischen Begleitsymptomen nach Chemotherapie im jungen Lebensalter sollten in jedem Fall von einem Herzinsuffizienzspezialisten mitbetreut werden, da ein Leitlinien-gerechter Ausbau der Herzinsuffizienz-Therapie eine Verbesserung der Pumpfunktion ermöglichen kann. Andererseits kann der Herzinsuffizienzspezialist rechtzeitig die Weiche stellen in Richtung auf eine linksventrikuläre mechanische Unterstützung bzw. eine Herztransplantation, wenn die kardiale Pumpfunktion nicht bessert oder sogar verschlechtert.
Körperliche Aktivität
Normale körperliche Aktivität ist empfohlen bei Patienten mit normaler linksventrikulärer Pumpfunktion nach Tumorbehandlung im jungen Lebensalter. Hingegen gibt es wenig Hinweise, dass high-intensity Training von Vorteil ist (12). Bei asymptomatischer oder symptomatischer Kardiomyopathie sollte die körperliche Belastung in Abstimmung mit dem Herzinsuffizienzspezialisten erfolgen.
Dr. med. Nicolas Barras
Dr. med. Patrick Yerly
Dr. med. Julien Regamey
Extraordinarius für Schwere Herzinsuffizienz und Herztransplantation
Service de Cardiologie, Département Coeur-Vaisseaux
Centre Hospitalier Universitaire Vaudois
Rue du Bugnon 44
1011 Lausanne
Roger.Hullin@chuv.ch
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Beitrag deklariert.
- Lang-Zeit-Überlebende nach Tumorbehandlungen im jungen Lebensalter bedürfen einer langfristigen Nachkontrolle
- Wenn eine asymptomatische Kardiomyopathie diagnostiziert wird sollte ein Herzinsuffizienzspezialist in die Nachsorge eingebunden werden
- Evidenz zum therapeutischen Vorgehen bei asymptomatischer Kardiomyopathie fehlt aktuell weitgehend, jedoch kann in Analogie zu Empfehlungen für die Behandlung von asymptomatischer Kardiomyopathie anderer Genese vorgegangen werden
- Ergebnisse von Studien, welche den Einfluss von Lifestyle-Interventionen zur besseren Kontrolle der kardiovaskulären Risikofaktoren untersuchen, liegen aktuell nicht vor, eine diesbezügliche Prävention erscheint jedoch aus pathophysiologischen Überlegungen und publizierten Beobachtungen bereits jetzt sinnvoll.
Message à retenir
- Les survivants à long terme après un traitement tumoral à un jeune âge ont besoin d’un suivi à long terme.
- Si une cardiomyopathie asymptomatique est diagnostiquée, un spécialiste de l’insuffisance cardiaque devrait participer aux soins de suivi.
- Les données probantes sur l’approche thérapeutique de la cardiomyopathie asymptomatique font largement défaut, mais on peut faire des analogies avec les recommandations pour le traitement de la cardiomyopathie asymptomatique d’autres origines.
- Les résultats d’études portant sur l’influence des interventions liées au mode de vie sur une meilleure maîtrise des facteurs de risque cardiovasculaire ne sont actuellement pas disponibles, mais la prévention à cet égard semble déjà utile pour des considérations pathophysiologiques et des observations publiées.
1. Ries L, Eisner M, Kosary C, et al. Cancer Statistics Review, 1975–2005, National Cancer Institute. Bethesda, MD, 2008. http:// seer.cancer.gov/csr/1975_2005/ (accessed Dec 15, 2013).
2. Armstrong GT, Kawashima T, Leisenring W, et al. Aging and risk of severe, disabling, life-threatening, and fatal events in the childhood cancer survivor study. J Clin Oncol 2014; 32: 1218–27.
3. Lipshultz SE, Adams MJ, Colan SD, et al, and the American Heart Association Congenital Heart Defects Committee of the Council on Cardiovascular Disease in the Young, Council on Basic Cardiovascular Sciences, Council on Cardiovascular and Stroke Nursing, Council on Cardiovascular Radiology. Long-term cardiovascular toxicity in children, adolescents, and young adults who receive cancer therapy: pathophysiology, course, monitoring, management, prevention, and research directions: a scientific statement from the American Heart Association. Circulation 2013; 128: 1927–95.
4. Armstrong GT, Liu Q, Yasui Y, et al. Late mortality among 5-year survivors of childhood cancer: a summary from the Childhood Cancer Survivor Study. J Clin Oncol 2009; 27: 2328–38.
5. van der Pal HJ, van Dalen EC, van Delden E, et al: High risk of symptomatic cardiac events in childhood cancer survivors. J Clin Oncol 2012;30: 1429-1437.
6. Chow EJ, Chen Y, Kremer LC, et al: Individual prediction of heart failure among childhood cancer survivors. J Clin Oncol 2015; 33:394-402,
7. Armenien SH, Hudson MM, Mulder RL, Chen MH, Constine LS, Dwyer M, et al. Recommendations for cardiomyopathy surveillance for survivors of childhood cancer: a report from the International Late Effects of Childhood Cancer Guideline Harmonization Group. Lancet 2015 ; 16 :2123-136.
8. Fidler MM, Reulen RC, Henson K, Kelly J, Cutter D, Levitt GA, et al. Population-based long-term cardiac-specific mortality among 34489 5-year-survivors of childhood cancer in Great Britain. Circulation 2017; 135 :951-963.
9. Armstrong GT, Joshi VM, Ness KK, et al: Comprehensive echocardiographic detection of treatment-related cardiac dysfunction in adult survi- vors of childhood cancer: Results from the St Jude Lifetime Cohort Study. J Am Coll Cardiol 2015; 65: 2511-2522.
10. Armstrong GT, Oeffinger KC, Chen Y, et al: Modifiable risk factors and major cardiac events among adult survivors of childhood cancer. J Clin Oncol 2013;31:3673-3680.
11. Goldberg LR, Jessup M. Stage B heart failure: management of asymptomatic left ventricular systolic dysfunction. Circulation
2006; 113: 2851–60.
12. Huang TT, Ness KK. Exercise interventions in children with cancer: a review. Int J Pediatr 2011; 2011: 461512. doi: 10.1155/2011/461512.
info@onco-suisse
- Vol. 8
- Ausgabe 6
- Dezember 2018