- Leptomeningealer Befall durch solide Tumore
In einem früheren Artikel (info@onkologie 03.20) haben wir die Gründe für das zunehmende Interesse an Hirnmetastasen diskutiert, jetzt geht es um den leptomeningealen Befall von soliden Tumoren, ein verwandtes, jedoch nicht identisches Thema. Wiederum fallen drei Tumorentitäten besonders auf: 1. Mammakarzinome, hier vor allem triple negative (TN) mit schlechten prognostischen Eigenschaften und HER-2 positive Subtypen sowie solche mit einer lobulären Histologie 2. NSCLC, SCLC und 3. Melanome. Insgesamt diagnostiziert man einen leptomeningealen Befall bei ca. 5 -15% von soliden Tumoren, Tendenz steigend, bedingt durch längeres Überleben von Patienten der besonders betroffenen Tumorentitäten.
Dans un article précédent (info@onkologie 03.20), nous avons discuté des raisons de l’intérêt croissant pour les métastases cérébrales. Nous traitons maintenant de l’ implication leptoméningée des tumeurs solides, un sujet connexe mais non identique. Là encore, trois entités tumorales sont particulièrement frappantes : 1 . les carcinomes du sein, en particulier ceux à triple négatif avec de mauvaises propriétés pronostiques et les sous-types HER-2 positifs, ainsi que ceux avec une histologie lobulaire. 2. le NSCLC, le SCLC et 3. les mélanomes. Globalement, l’ atteinte leptoméningée est diagnostiquée dans environ 5 à 15 % des tumeurs solides, avec une tendance croissante, en raison de la plus longue survie des patients des entités tumorales particulièrement touchées.
Sucht man in der englischsprachigen Literatur nach dieser speziellen Tumormanifestation, so findet man Hinweise unter den Begriffen «Meningeosis carcinomatosa», «carcinomatous meningitis» «neoplastic meningitis», «leptomeningeal carcinomatosis» oder «leptomeningeal metastases».
Anatomisch handelt es sich um eine Infiltration von Tumorzellen in die Arachnoidea, den liquorhaltigen, subarachnoidalen Raum und die Pia mater. Diese Strukturen werden hämatogen durch die Blut-leptomeningeale-Barriere erreicht, eine vaskuläre Struktur, bei der keine Bluthirnschranke ausgebildet ist. Des Weiteren können Tumorzellen vom Blut über den Plexus choroideus in die Ventrikel und den leptomeningealen Raum eindringen. Ausserdem ist eine direkte Tumorzell-Kontamination des Liquors und der Leptomeningen durch infiltrativ wachsende Hirnmetastasen möglich. Schlussendlich können Tumorzellen via Gefässe der Schädelkalotte, von Wirbelkörpern, über perineurale und perivaskuläre Routen einwandern. Eher selten werden die Leptomeningen iatrogen besiedelt, z.B. bei Resektionen im Kleinhirn. Verschiedene Barrieren im Bereich des ZNS behindern – zumindest teilweise – das Erreichen therapeutischer Konzentrationen vieler systemisch verabreichter Medikamente.
Diagnostik
Symptome können anfänglich diskret und zeitweise wechselnd ausgeprägt sein sowie mehrere Lokalisationen betreffen. Kopfschmerzen, Schwindel, Benommenheit, Sehstörungen, Gangunsicherheit, Hirnnervenbefall, sensorische und motorische Defizite sind häufig, gelegentlich manifestiert sich eine Cauda equina Symptomatik. Klinische Symptome und ein entsprechender MR-Befund (Ganzachse) sind wegweisend, der Nachweis maligner Zellen im Liquor ist der diagnostische Goldstandard. Dabei ist zu beachten, dass die erste gewonnene Liquorprobe nur in ca. 50% diagnostisch ist und allenfalls wiederholt werden soll. Auf eine genügende Liquormenge (10ml) und eine rasche Verarbeitung des Materials (innerhalb einer Stunde) ist aus Qualitätsgründen zu achten. Tumormarker, falls beim Primärtumor bekannt, können im Liquor zu diagnostischen Zwecken und zur Verlaufskontrolle bestimmt werden. Liquor-Tumormarker reflektieren die intrathekale Produktion, die Konzentration ist dabei höher als die zeitgleich im Serum bestimmte. Hirnmetastasen und leptomeningealer Tumorbefall kommen in einem hohen Prozentsatz (um 50%) kombiniert vor. Sehr selten sind die Leptomeningen eine erste Tumormanifestation.
Leptomeningeales Wachstumsmuster und therapeutische Konsequenzen
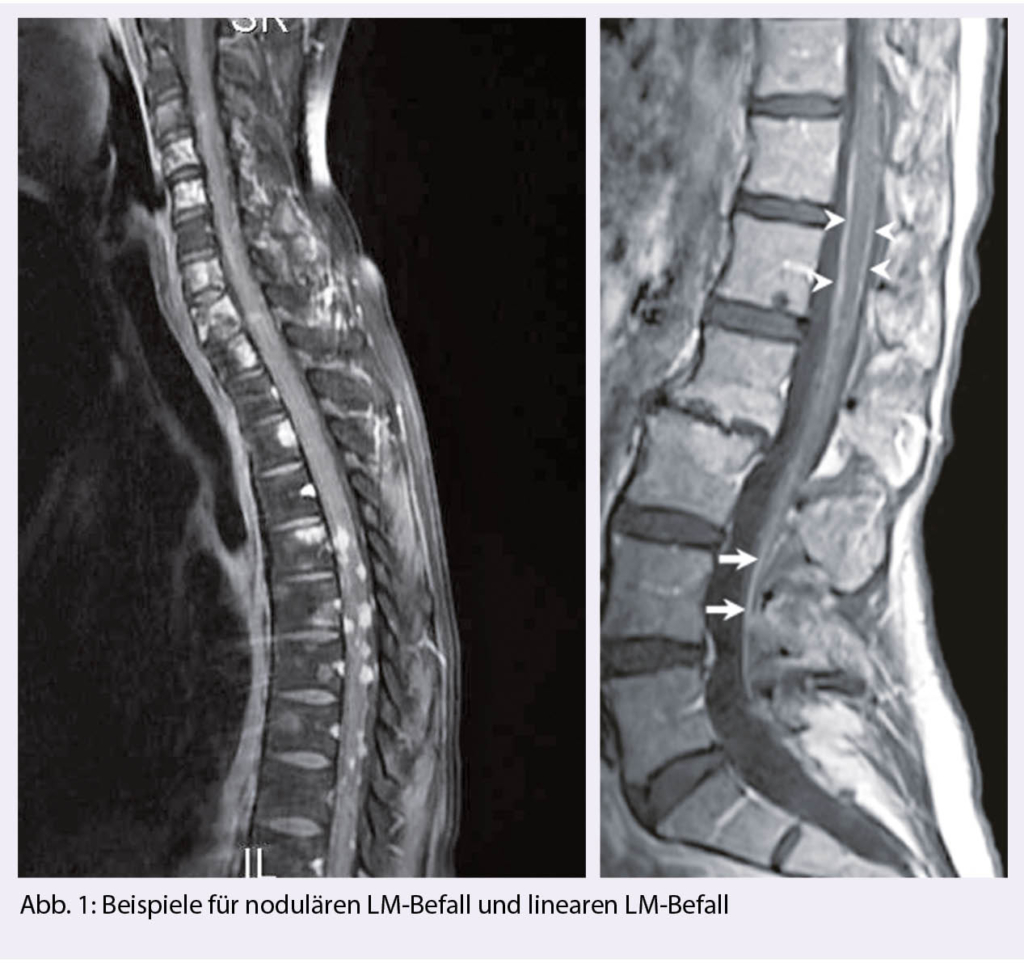
Man unterscheidet einen nodulären Tumorbefall, an den Meningen adhärent, eine tapetenartige Auskleidung der Meningen und frei flottierende Tumorzellen oder eine Kombination dieser Manifestationen (Abb. 1). Es ist nachvollziehbar, dass bei der nodulären, adhärenten Form, keine Tumorzellen im Liquor fassbar sein können.
Aus den verschiedenen Befallsarten ergeben sich therapeutische Konsequenzen. Bei ausgedehntem nodulären Befall bietet sich eine lokale Radiotherapie an, besonders, wenn die Liquorzirkulation gefährdet ist, Symptome vorliegen oder ein Hydrocephalus droht, wohingegen 1-2 mm schmale «Tapeten» oder frei zirkulierende Tumorzellen einer intrathekalen Therapie besser zugänglich sind. Ohne Therapie verläuft das leptomeningeale Wachstum innert weniger Wochen tödlich. Mit konventioneller Systemtherapie liegt das mediane Überleben bei etwa 3-6 Monaten. Zielgerichtete Therapien können langanhaltende Tumorkontrollen erreichen, besonders bei HER-2-positiven, EGFRmut und ALK- alterierten Tumorentitäten (1).
Lokale Therapieoptionen
Eine chirurgische Intervention bei leptomeningealem Befall besteht selten, es sei denn, für die Einlage eines Reservoirs zur Therapieapplikation oder für die notfallmässige Anlage eines ventrikulo-peritonealen Shunts im Falle eines Hydrocephalus. Eine Verstopfung des Shunts ist dabei eine gefürchtete Komplikation.
Radiotherapie ist fokal indiziert bei raumforderndem, nodulärem Befall, zur Behebung von Liquorzirkulationsstörungen, zur raschen Behandlung von symptomatischen Läsionen, tumorösen Hirnnervenaffektionen, Cauda equina Symptomatik oder zur gleichzeitigen Behandlung von Hirnmetastasen. Eine Bestrahlung der Spinalachse wird nicht empfohlen, da zu toxisch in der palliativen Situation. Eine Ganzhirnbestrahlung deckt einen grossen Teil des Liquorraums ab und kann bei fehlenden medikamentösen Optionen indiziert sein. Sie bringt aber keinen Überlebensvorteil, mit neurokognitiven Störungen ist zu rechnen.
Intrathekale Therapien
Der konstant zirkulierende Liquor ist prinzipiell ein geeignetes Reservoir für Tumorzellen, aber auch für Medikamente und dient zudem der immunologischen Kommunikation. Die intrathekale (i.th.) Gabe eines passenden Medikamentes bietet sich an unter Beachtung einiger Konditionen: Vorliegen flottierender Tumorzellen, lineare Tumorausbreitung von bis 1-2mm Dicke, ependymaler Befall und wenig oder lokal kontrollierter Tumorbefall im Hirnparenchym. Vorteilhaft für einen Therapieerfolg ist die Tumorkontrolle ausserhalb des ZNS sowie ein guter Allgemeinzustand. Eine günstigere Medikamentenverteilung wird durch ein Reservoir mit direktem Zugang zum Ventrikel (z.B. Ommaya-Reservoir) erreicht im Vergleich zu repetitiven lumbalen Punktionen. Die Revisionsrate eines Reservoirs liegt in geübten Händen bei 7-8%, die Infektionsrate bei 5-10% (2).
Bei raumfordernden Läsionen lohnt es sich, vorgängig zur i.th. Medikamentengabe eine Liquor- Flow-Studie mittels MR oder nuklearmedizinischer Methode.
Es gibt keine randomisierten Studien (RCT), welche eine intrathekale Therapie versus «best supportive care» bei soliden Tumoren verglichen haben. Hingegen gibt es randomisierte Daten zur Systemtherapie mit oder ohne zusätzliche intrathekale Therapie beim Mammakarzinom. Dabei hat die aktuellste Studie mit i.th. liposomalem Cytarabin (zurzeit nicht erhältlich) ein verlängertes PFS für den leptomeningealen Befall und einen Trend für ein verbessertes Überleben gezeigt (3). Eine ältere RCT, mit einigen methodologischen Schwächen, konnte keinen solchen Vorteil für eine Systemtherapie mit oder ohne i.th. Methotrexat (MTX) nachweisen, hingegen vermehrte Toxizität mit i.th. MTX (4). Die alten Medikamente, welche wir schon seit über 40 Jahren intrathekal verwenden, sind allerdings wenig geeignet, eine gute Tumorkontrolle bei den meisten soliden Karzinomen zu erreichen. MTX, Thiotepa, Cytarabin, Gemcitabin, Toptecan und Etoposid sind keine Wahlmedikamente für die häufigsten Tumoren, die leptomeningeal metastasieren und allen ist gemeinsam, dass sie eine sehr kurze Halbwertszeit (4-8h) haben, weshalb sie zwei- bis dreimal pro Woche i.th. verabreicht werden müssen. Nachteilig sind zudem lokale, zum Teil irreversible Toxizitäten (Arachnoiditis, Myelopathie, progressive Leukencephalopathie).
In den letzten Jahren wurden einige monoklonale Antikörper mit Erfolg intrathekal verabreicht und bisher in Phase I Studien, kleinen Fallserien oder Einzelbeobachtungen publiziert. Die Verteilung eines intrathekal verabreichten monoklonalen Antikörpers (AK) in die drei Kompartimente «Liquor», «Hirnparenchym» und «Blut» ist höchst interessant, teilweise unerwartet und noch nicht vollständig verstanden. Für intraventrikulär verabreichtes Rituximab zum Beispiel, konnte ein Pharmakokinetik-Model entwickelt werden, welches eine gewisse Penetration des AK ins Hirnparenchym suggeriert, zudem konnte die Elimination des AK vom Liquor ins Blut pharmakokinetisch nachgewiesen werden (5). Auch für intrathekales Trastuzumab sind therapeutisch hohe Serumspiegel gemessen worden (6, 7, 8), Eine aktuelle Metaanalyse zu i.th. Trastuzumab bei insgesamt 58 Patienten mit HER-2 positivem Mammakarzinom konnte die Sicherheit und Wirksamkeit dieser Therapieoption bestätigen (9). Eine erste Phase I – Dosiseskalationsstudie mit 16 Patienten empfiehlt wöchentlich 150mg Trastuzumab intrathekal (10). Eigene Beobachtungen mit CSF- und Serum- Talspiegeln zeigen, dass auch 150mg alle 3 Wochen den erwünschten Effekt, d.h. Kontrolle der leptomeningealen Erkrankung erlauben, bei einer Patientin sogar anhaltend über mehr als 4 Jahre (11). Die Zeit von der ersten i.th. Trastuzumab-Gabe bis zur Besserung neurologischer Symptome, fehlendem Nachweis von Tumorzellen im Liquor betrug bei drei folgenden Patienten 3, 2, respektive 1 Monat. Eine nicht mehr nachweisbare Kontrastmittel-Aufnahme im MR war nach 4, respektive 3 Monaten zu beobachten. Zu erwähnen ist, dass diese drei Patienten vorgängig eine Ganzhirnbestrahlung erhalten haben. Trastuzumab CSF-Konzentrationen (Talspiegel) > 0.1mg/L erlaubten in unserer kleinen Serie eine leptomeningeale Tumorkontrolle über die Zeit. Bemerkenswert, Trastuzumab Serum-Talspiegel nach alleiniger 3-wöchentlicher intrathekaler Gabe erreichten Werte um 30mg/L, entsprechend therapeutischen Serum-Konzentrationen (präklinischer Grenzwert > 10mg/L für optimale Hemmung der Zellproliferation) (11). Der genaue, möglicherweise rasche Eliminationsprozess von Trastuzumab und anderen Antikörpern aus dem Liquor in das Blut bleibt zu erforschen.
Offen bleibt weiterhin die Frage der Dauer einer i.th. AK- Gabe über eine Verbesserung von Klinik, MR und Abnahme der Zellzahl hinaus. Akute Neurotoxizitäten für i.th. verabreichte monoklonale AK wurden bisher weder für Rituximab, Trastuzumab, Bevacizumab, Nivolumab noch Panitumumab beschrieben, langfristige Toxizitäten bei mehrjähriger Gabe können aber nicht sicher ausgeschlossen werden. Vorausgesetzt, intrathekal verabreichte Immuncheckpoint-Inhibitoren erweisen sich in Zukunft als wirksam in der Kontrolle eines leptomeningealen Befalls von immun-responsiven Tumoren wie Melanome, NSCLC, SCLC, RCC, TN-Mammakarzinomen, könnte das Medikamenten-Reservoir «Liquor» ein interessanter Therapieansatz werden. Ob eine alleinige i.th. Antikörpertherapie eine entsprechende zusätzliche Systemtherapie erübrigen kann, werden Pharmakokinetik-Studien zeigen müssen.
System-Therapien
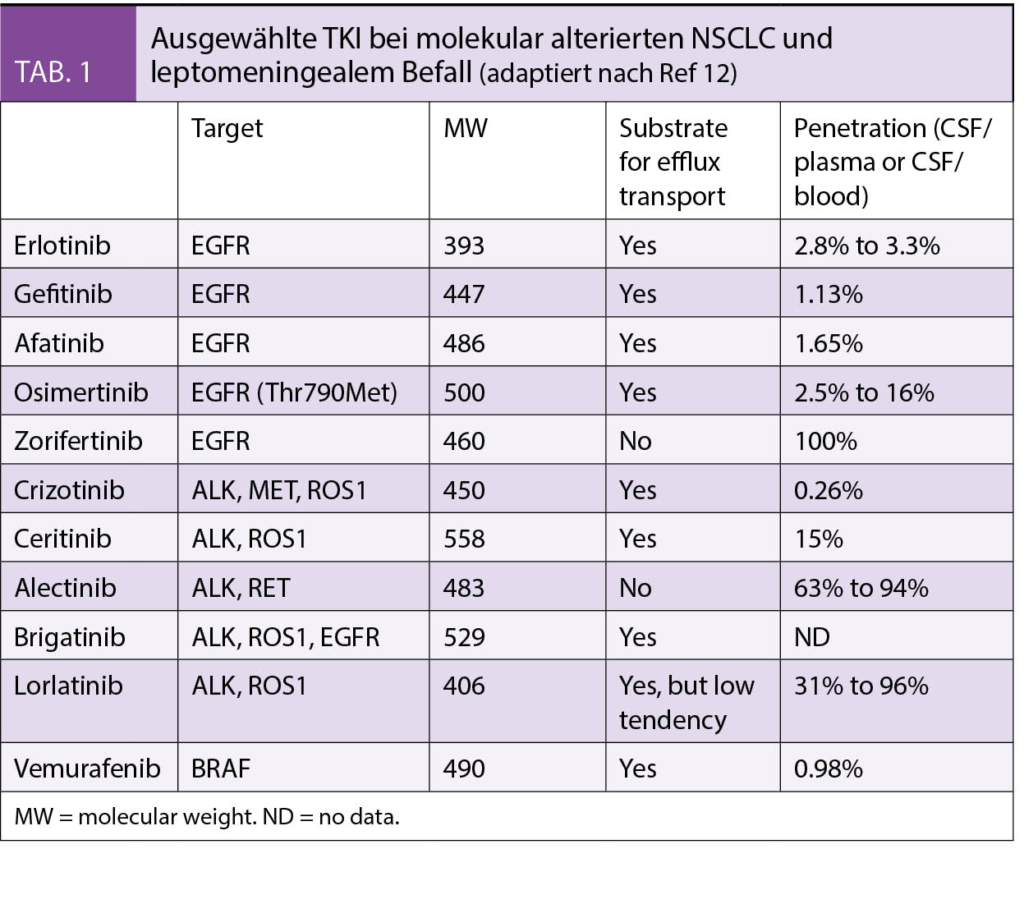
ZNS wirksam sind zielgerichtete TKI mit einem kleinen Molekulargewicht (400-500 D) und fehlender Abhängigkeit vom Efflux-Transporter P-Glykoprotein (Pgp). (Tab. 1) (12)
Beispiele sind Osimertinib beim EGFRmut und Alectinib für ALK- und RET-alterierte NSCLC, aber auch Vemurafenib bei BRAFmut Tumoren. Weniger gut wirkt Lapatinib bei HER-2-positiven Tumoren u.a. wegen seiner Abhängigkeit vom Pgp. Das kürzlich von der Swissmedic zugelassene und selektiv gegen HER-2 gerichtete Tucatinib hat eine bessere ZNS-Wirksamkeit und Verträglichkeit.
Auch systemisch verabreichte Chemotherapeutika werden bei leptomeningealem Befall eingesetzt, so unter anderem, 5-Fluorouracil, Capecitabin, Pemetrexed Cisplatin, Carboplatin, Vinorelbin, Gemcitabin, hochdosiert Methotrexat (≥ 3g/m2), Thiotepa, hochdosiert Cytarabin, Etoposid, Eribulin, TDM-1. Auch lipophile Hormonpräparate sind zentral wirksam, beispielsweise Tamoxifen (13). Eine Phase II Studie für Hirn- und leptomeningeale Metastasen mit Abemaciclib, einem ZNS gängigen CDK 4/6- Inhibitor, hat seinen primären Endpunkt (intrakranielle Response-Rate) zwar nicht erreicht, ein intrakranieller klinischer Benefit wurde jedoch für die stark vorbehandelte Kohorte von Hormonrezeptor-positiven, HER-2 negativen Mammakarzinmen beschrieben (14).
Systemisch verabreichte Immun-Checkpointinhibitoren scheinen sowohl bei Hirnmetastasen, als auch bei leptomeningealem Tumorbefall wirksam zu sein (15, 16).
Allen systemisch verabreichten Medikamenten ist gemeinsam, dass mit einer heterogenen Aufnahme in die Leptomeningen gerechnet werden muss, was eine eingeschränkte Wirksamkeit erklären kann.
Copyright bei Aerzteverlag medinfo AG
Universitätsspital Zürich
Institut für Pathologie und Molekularpathologie
Schmelzbergstrasse 12
8091 Zürich
silvia.hofer@usz.ch
Klinik für Neurologie
Universitätsspital Zürich
Frauenklinikstrasse 28
8091 Zürich
Die Autorinnen haben im Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Ein leptomeningealer Tumorbefall durch solide Tumoren ist nach wie vor mit einer schlechten Prognose verbunden.
- Eine befriedigende Symptomkontrolle kann mit lokaler Radiotherapie erreicht werden.
- Ein längeres Überleben wird beschrieben mit zielgerichteten TKI oder monoklonalen Antikörpern, hier vor allem intraventrikulär oder im Falle von Immun-Checkpoint-Inhibitoren auch systemisch.
- EANO-ESMO Guidelines informieren über Diagnose, Therapie und Follow-up bei Patienten mit leptomeningealem Befall bei soliden Tumoren (17).
Messages à retenir
- Une infestation leptomengales de tumeurs par des tumeurs solides est toujours associée à un mauvais pronostic.
- Une radiothérapie locale permet de contrôler les symptômes de manière satisfaisante.
- Une survie plus longue est décrite avec des TKI ciblés ou des anticorps monoclonaux, ici principalement par voie intraventriculaire ou dans le cas d’inhibiteurs des points de contrôle immunitaires également par voie systémique.
- Les lignes directrices de l’ EANO-ESMO fournissent des informations sur le diagnostic, la thérapie et le suivi des patients atteints de tumeurs solides leptoméningés (17).
1. Le Rhun E, Preusser M, van den Bent M, et al. How we treat patients with leptomeningeal metastases. ESMO Open 2019
2. Zairi F, Le Rhun E, Bertrand N, et al. Complications related to the use of an intraventricular access device for the treatment of leptomeningeal metastases from solid tumor: a single centre experience in 112 patients. Neurooncol. 2015
3. Le Rhun E, Wallet J, Mailliez A, et al. Intrathecal liposomal cytarabine plus systemic therapy versus systemic chemotherapy alone for newly diagnosed leptomeningeal metastasis from breast cancer. Neuro-Oncology 2020
4. Boogerd, van den Bent M, Koehler PJ, et al. The relevance of intraventricular chemotherapy for leptomeningeal metastasis in breast cancer; a randomized study. Eur J Cancer 2004
5. Kadoch C, Li J, Wong V.S, et al Complement Activation and Intraventricular Rituximab Distribution in Recurrent Central Nervous System Lymphoma. Clin Cancer Res 2014
6. Bousquet G, Darrouzain F, de Bazelaire C, et al. Intrathecal Trastuzumab Halts Progression of CNS Metastases in Breast Cancer. J Clin Oncol 2018
7. Hofer S, Mengele K, Stemmler H, et al. Intrathecal trastuzumab: dose matters. Acta Oncol 2012
8. Hofer S, Mengele K, Schmitt M et al. Complement Activation and Rituximab Distribution in CNS NHL—Letter. Clin Cancer Res 2015
9. Zagouri F, Zoumpourlis P, Le Rhun E, et al. Intrathecal administration of anti-HER2 treatment for the treatment of meningeal carcinomatosis in breast cancer: A metanalysis with meta-regression. Cancer Treat Rev 2020
10. Bonneau C, Paintaud G, Trédan O, et al. Phase I feasibility study for intrathecal administration of trastuzumab in patients with HER2 positive breast carcinomatous meningitis. EJC 2018
11. Hofer S, Aebi S. Letter comments on EJC published article: Phase I feasibility study for intrathecal administration of trastuzumab in patients with HER2-positive breast carcinomatous meningitis. EJC 2018
12. Cheng H, Perez-Soler R. Leptomeningeal metastases in NSCLC. Lancet Oncology 2018
13. Zoghi B, Elledge R. Endocrine Therapy for Leptomeningeal Metastases from ER –positive Breast Cancer. Case report and a Review of the Literature. The Breast Journal 2016
14. Tolaney SM, Sahebjam S, Le Rhun E, et al. A Phase 2 Study of Abemaciclib in Patients with Brain Metastases Secondary to Hormone Receptor Positive Breast Cancer. Clin Cancer Res 2020
15. Long GV, Atkinson V, Lo S, et al. Combination nivolumab & ipilimumab or nivolumab alone in melanoma brain metastases: a multicentre randomised phase 2 study. Lancet Oncol 2018
16. Brastianos P, Quant Lee E, Cohen JV, et al. Single-arm, open-label phase 2 trial of pembrolizumab in patients with leptomeningeal carcinomatosis. Nature Medicine 2020
17. Le Rhun E, Weller M, Brandsma D, et al. EANO-ESMO clinical practice guidelines for diagnosis, treatment and follow-up of patients with leptomeningeal metastasis from solid tumours. Ann Oncol 2017
info@onco-suisse
- Vol. 10
- Ausgabe 5
- September 2020