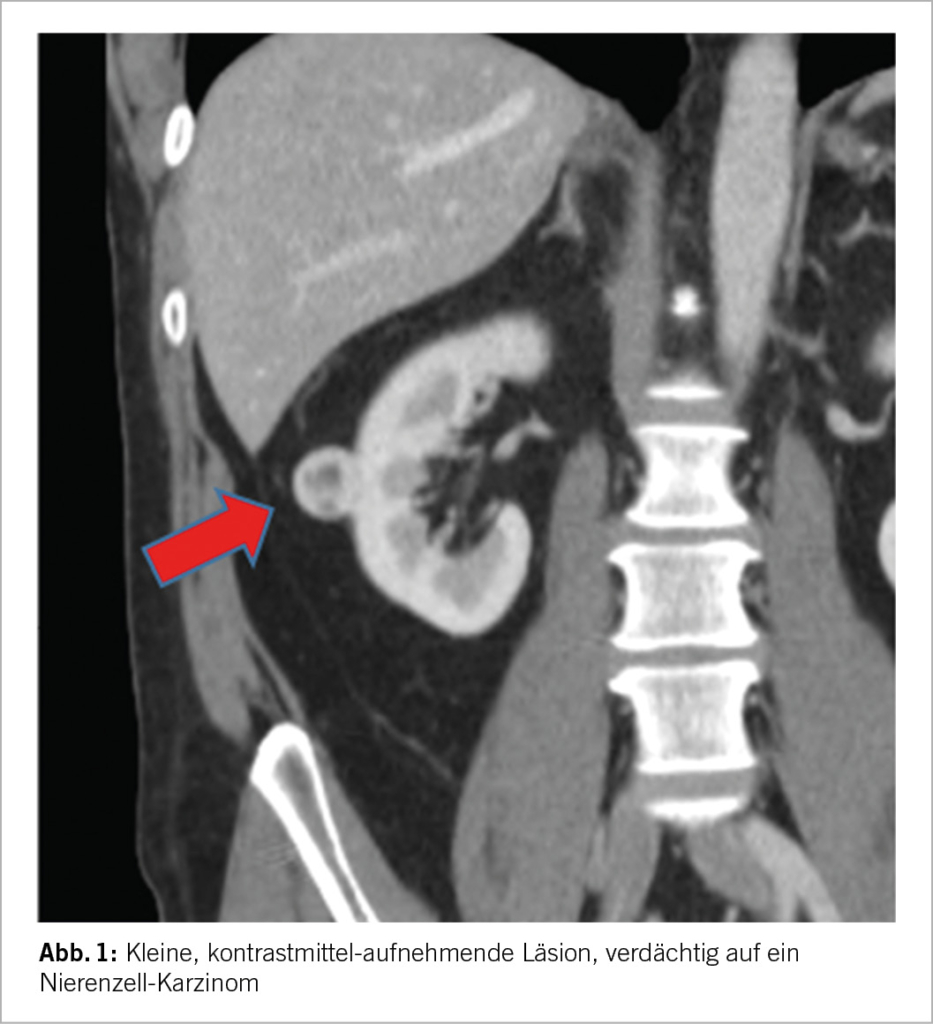
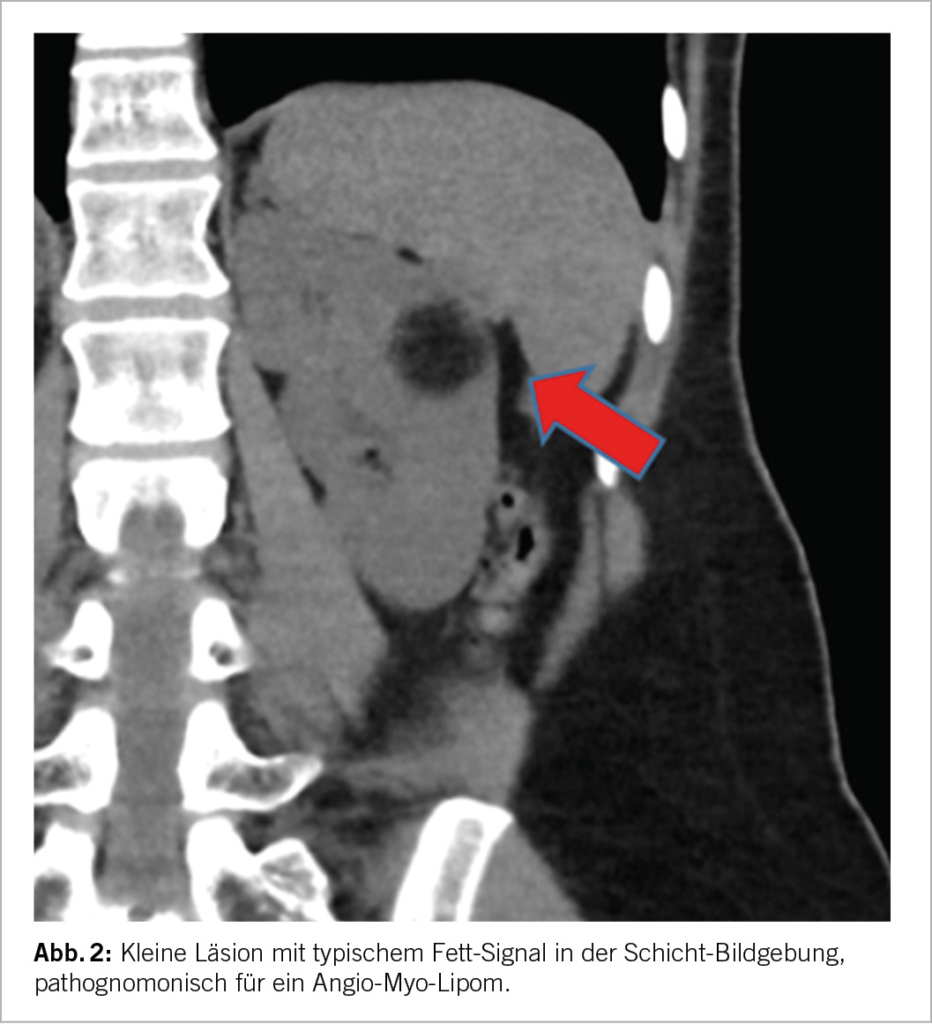
- Management kleiner Nierentumore
Mit der zunehmenden Anwendung von Schichtbildverfahren stieg die Inzidenz von kleinen Nierentumoren in den letzten Dekaden deutlich an. Was ist zu tun, wenn ein solcher Befund erhoben wird? In keinem Fall ist eine überstürzte Handlung notwendig und die Beurteilung an einem erfahrenen Zentrum ist der erste sinnvolle Schritt, denn nicht alle diese Befunde sind wirklich maligne und ein relevanter Anteil der tatsächlich malignen Befunde bedarf keiner unmittelbaren Therapie. Die Minderheit der wirklich signifikanten Karzinome muss aber identifiziert und therapiert werden. Dementsprechend bestehen mehrere Therapie-Strategien, welche von Beobachtung bis hin zu verschiedenen aktiven Behandlungen reichen. Die Entscheidung muss im Rahmen der Gesamtkonstellation, welche Patienten- und Tumor-Faktoren berücksichtigt, getroffen werden. Dieser Artikel gibt eine kurze Übersicht zum Thema.
Due to the increased use of CT / MRI imaging, the incidence of small renal masses (SRM) during the last decades increased substantially. How to go on in such situations? Usually, there is no rush and an assessment in an experience center is an appropriate first step. Not all SRM are malignant and a relevant proportion of the malignant lesions do not require immediate treatment. However, the minority of significant carcinomas must be identified and treated. Based on that, there exist various management strategies reaching from surveillance to different active treatment modalities. The decision must be based on the overall situation taking into account patient- as well as lesion-factors. This article gives a short overview over this topic.
Keywords: small renal masses, selection, active surveillance, ablative techniques, partial nephrectomy
Einleitung
Durch den vermehrten Einsatz von Schicht-Bildgebungen wie CT oder MRI kam es in den letzten Dekaden zu einem deutlichen Anstieg der Inzidenz von kleinen Nierenläsionen unklarer Dignität, im angelsächsischen SRM (small renal mass) genannt (1). Solche sind meist zufällig detektierte, kontrastmittelaufnehmende Läsionen ≤4cm, solide oder komplex-zystisch und somit bildmorphologisch verdächtig auf ein klinisches T1a Nierenzellkarzinom (2). Bei diesen Läsionen handelt es sich um eine heterogene Gruppe von Tumoren, wobei 20-30% benigne und 70-80% maligne sind (3, 4). Von den bösartigen Tumoren stellt die Mehrzahl (80%) Niedrig-Risiko Karzinome dar (5) mit entsprechend tiefem Metastasierungs-Risiko (6), etwa 20% sind aber high grade Karzinome mit Invasions- und Metastasierungs-Potenzial (4). Mit anderen Worten, von zehn dieser inzidentell diagnostizieren kleinen Nierentumoren sind im Durchschnitt bis zu drei gutartig, von den sieben Bösartigen haben aber nur ein bis zwei ein höheres aggressives Potenzial. Das Gesamtrisiko einer Metastasierung in dieser Gesamt-Tumorgruppe liegt <2% bei reiner Beobachtung (7). Somit ist die richtige Selektion an zu treffenden Massnahmen von grösster Wichtigkeit, um sowohl Über- als auch Unter-Behandlung zu vermeiden; das Management einer SRM ist abhängig von mehreren Faktoren, die wesentlichsten sind i) die bildmorphologischen Charakteristika der SRM, ii) Patientenfaktoren wie Alter, respektive Lebenserwartung aber auch Patientenpräferenz, iii) Co-Morbiditäten wie vorausgehende oder bestehende Malignome oder Niereninsuffizienz, iv) Vor-Operationen im Abdomen sowie v) allfällige Resultate einer bioptischen Abklärung der SRM. Diese Arbeit soll diese Aspekte im Management einer SRM beleuchten und die aktuellen Behandlungsstrategien kurz darstellen.
Bildmorphologie der SRM
Die bildgebende Grundlage für die Beurteilung einer SRM ist entweder eine qualitativ hochwertige CT oder MRI-Untersuchung nativ sowie mit Kontrastmittel. Beide Verfahren haben gewisse Vor- und Nachteile, eine eindeutige Überlegenheit der einen gegenüber der anderen gibt es nicht (9). Die wichtigen Aspekte hier sind i) der allfällige Nachweis von Fettgewebe, welcher richtungsweisend für ein Angio-Myolipom und somit eine gutartige Läsion wäre, ii) das Kontrastmittelverhalten, wobei eine deutliche Anreicherung eine Malignität wahrscheinlicher macht, iii) die Charakterisierung allfälliger zystischer Läsionen basierend auf der Bosniak-Klassifikation (10) sowie iv) die Beschreibung der Tumor-Komplexität, z.B. unter Verwendung der RENAL Scores. Aus letzterer Information lässt sich insbesondere auch eine Einschätzung der Komplexität einer allfälligen chirurgischen Intervention abschätzen. Tumoren <3cm zeigen verglichen mit SRM von 3-4cm ein noch geringeres Risiko für Malignität oder aggressives biologisches Verhalten (6, 11). Liegen bereits mehrere Bilder vor und erlauben somit eine Aussage über die Dynamik, so ist ein rasches Wachstum (>5mm pro Jahr) ebenfalls ein Zeichen für Malignität und aggressives Verhalten. Als letzter Aspekt und somit v) sollte die Klinik berücksichtigt werden, bei Fieber und Infekt-Zeichen kommt differentialdiagnostisch eine entzündliche Genese (Abszess/Pyelonephritis) in Betracht. Ansonsten gibt es aber keine weiteren bildmorphologischen Aspekte, welche eine verlässliche Aussage in Hinblick auf die reale biologische Aggressivität der SRM ableiten liessen.
Biopsie der Nierentumoren
Die Empfehlungen der führenden Guidelines der ASCO, der AUA, der NCCN und der EAU für oder gegen eine Biopsie einer SRM sind nicht einheitlich. Generell wird die Biopsie der SRM immer dann empfohlen, wenn die Resultate das weitere Management beeinflussen würden oder abgeraten, wenn die Resultate keinen Einfluss darauf hätten. Somit wird übereinstimmend die Biopsie empfohlen i) bei vorausgegangenen oder gegenwärtig bestehenden Zweitmalignomen, um eine entsprechende Metastase auszuschliessen oder zu beweisen sowie ii) vor Anwendung eines ablativen Verfahrens (Details hierzu unten). Übereinstimmend abgeraten wird von einer Biopsie bei i) co-morbiden und gebrechlichen Patienten, welche ohnehin nur für ein konservatives Management qualifizieren, ii) bei Tumoren, welche vom Urothel ausgehen (und somit der Verdacht auf ein Urothelkarzinom besteht), iii) bei mehrheitlich zystischen Tumoren und iv), wenn ein chirurgisches Verfahren angewendet werden wird, unabhängig vom Resultat. Das Risiko einer Zellverschleppung durch die Biopsie (sogenanntes «Seeding») wurde lange kontrovers diskutiert, mit moderner Technik (sogenannte «co-axial sheath method») ist dieses Risiko aber verschwindend klein und entsprechend vernachlässigbar (12). Der positive prädiktive Wert der Biopsie ist ausgezeichnet mit 99.8%, eine wichtige Limitation ist allerdings der deutlich schlechtere negative prädiktive Wert, wobei bei einem Drittel der tumornegativen Biopsien in der definitiven Pathologie trotzdem Malignität nachgewiesen werden kann (13); man spricht hier auch von sogenannt nicht diagnostischen Biopsien. Diese Aspekte müssten bei der Entscheidung für oder gegen eine Biopsie klar berücksichtigt werden.
Die Behandlungs-Strategien der SRM
Die Management-Optionen einer SRM beinhalten prinzipiell Beobachtungstrategien und aktive Behandlungen. Bei der Beobachtung wiederum kann eine palliative Ausrichtung im Sinne eines Watchful Waitings und eine kurative Ausrichtung im Sinne einer Active Surveillance unterschieden werden – analog dem Vorgehen beim Prostatakarzinom. Bei den aktiven Therapien kommen die Nierenteilresektion oder ein thermo-ablatives Verfahren in Betracht, bei ansonsten inoperablen Patienten zunehmend auch die stereotaktische ablative Radiotherapie. Die verschiedenen Vor- und Nachteile dieser Strategien müssen im individuellen Einzelfall gut abgewogen werden und insbesondere der Gesamtsituation angepasst sein.
Nierenteilresektion
Die Nierenteilresektion mit Entfernung des Tumors unter Schonung des gesunden Nierengewebes ist die gegenwärtige Goldstandard-Strategie für malignom-verdächtige SRM und Wunsch nach definitiver Therapie (14). Der onkologische Outcome ist sehr gut, das Risiko für Niereninsuffizienz klein sowie auch die Komplikationsraten, sofern der Eingriff an einem Zentrum mit entsprechender Erfahrung durchgeführt wird. Eine vollständige Nephrektomie sollte nur dann durchgeführt werden, wenn eine Teilresektion aus technischen Gründen mit unvernünftigem Risiko verbunden wäre und präoperativ eine normale Gesamt-Nierenfunktion besteht.
Ablations-Techniken
Thermische Ablations-Techniken (Kryotherapie (Kälte) oder Radio-Frequenzablation (Hitze)) sind valide und wertvolle Alternativen zur Nierenteilresektion, optimalerweise für SRM <3cm und in all jenen Fällen, in welchen Patienten nicht für eine Nierenteilresektion qualifizieren oder diese nicht wünschen. Vor einer Thermo-Ablation muss eine Biopsie der SRM durchgeführt werden. Falls diese nicht im Vorfeld stattgefunden hat, muss diese spätestens im Rahmen, respektive unmittelbar vor der Ablation durchgeführt werden. Der onkologische Outcome ist der Nierenteilresektion insgesamt unterlegen, hauptsächlich bei Tumoren >3cm; bei Tumoren <2cm ist die Tumorkontrolle vergleichbar. Eine engmaschige Active Surveillance nach Ablation ist deshalb zwingend notwendig. Die Ablation kann aber mehrfach wiederholt werden, was neben der minimalen Invasivität dieser Methode ein weiterer Vorteil ist.
Stereotaktische ablative Radiotherapie
Dieses Verfahren kann bei ansonsten inoperablen Patienten angewendet werden und erste Studiendaten zeigen eine gute lokale Kontrolle mit über 97% (15). Obwohl diese Resultate vielversprechend sind, werden Daten aus randomisierten Studien benötigt, um die Evidenz zu erhärten.
Aktive Überwachung (Active Surveillance)
Diese Strategie ist eine Alternative für eine unmittelbare aktive Behandlung, insbesondere für SRM <2cm und immer dann, wenn die Risiken einer Intervention oder die Gesamtsituation mit relevanten Co-Morbiditäten den onkologischen Benefit einer aktiven Therapie in Frage stellen. Die Ausrichtung dieser Beobachtungsstrategie ist aber prinzipiell kurativ. Basierend auf der häufig indolenten Natur der SRM und der generell langsamen Wachstumsrate (16) kann diese Strategie eigentlich auch bei allen therapie-willigen und -fähigen Patientinnen und Patienten mit SRM <2cm und bei ausgewählten Fällen auch bei SRM bis 4cm (14) in Betracht gezogen werden.
Watchful Waiting
Diese Beobachtungsstrategie ist prinzipiell palliativ ausgerichtet und kommt bei Patienten mit limitierter Lebensdauer in Frage, respektive immer dann, wenn die therapeutische Intervention und damit die Optimierung der onkologischen Situation im Gesamtkontext keinen Benefit mit sich bringt.
Copyright bei Aerzteverlag medinfo AG
Abkürzungen:
ASCO: American Society of Clinical Oncology; AUA: American Urological Association; NCCN: National Comprehensive Cancer Network; EAU: European Association of Urology, SRM: small renal mass; CT: Computer-Tomographie; MRI: Magnet-Resonanz-Bildgebung
Klinik für Urologie
Stadtspital Zürich
Birmensdorferstrasse 497
8063 Zürich
Klinik für Urologie
Stadtspital Zürich
Birmensdorferstrasse 497
8063 Zürich
Die Autoren haben keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Aufgrund der häufig angewendeten Schichtbildverfahren hat die Inzidenz von kleinen Nierentumoren (SRM; ≤4cm) in den letzten Dekaden massiv zugenommen.
◆ Die SRM stellen eine heterogene Gruppe von Tumoren dar, wobei 20-30% benigne und 70-80% maligne sind.
◆ Von den tatsächlich bösartigen Tumoren zeigen nur ca. 20-30% ein höher aggressives Verhalten, während die verbliebenen 70-80% nicht immer einer unmittelbaren Therapie bedürften.
◆ Basierend hierauf ist die richtige Selektion an Patienten, welche eine aktive Behandlung brauchen wichtig, genauso wichtig ist aber auch die Selektion von Patienten, welche dies nicht brauchen und mit einer aktiven Beobachtung sicher kontrolliert werden können; die richtige Selektion ist der Schlüssel zur Vermeidung von Unter- wie auch Übertherapie.
1. Nguyen MM. The evolving presentation of renal carcinoma in the United States: trends from the Surveillance, Epidemiology, and End Results program. J Urol 2006; 176:2397-2400.
2. Finelli A. Management of small renal masses: American Society of Clinical Oncology clinical practice guidline. J Clin Oncol 35: 668-680.2017.
3. Kutikov A. Incidence of benign pathologic findings at partial nephrectomy for solitary renal mass presumed to be renal cell carcinoma on preoperative imaging. Urology. 2006; 68:737-740
4. Bhindi B. Are we using the best tumor size cut-points for renal cell carcinoma staging? Urology 109:121-126, 2017.
5. Rothman J. Histopathological characteristic s of localized renal cell carcinoma correlate with tumor size: a SEER analysis. J Urol. 2009; 181:29-33.
6. Thompson RH. Metastatic renal cell carcinoma risk according tumor size. J Urol. 2009; 182:41-45.
7. Smaldone MC. Small renal masses progressing to metastases under active surveillance. A systematic review and pooled analysis. Cancer. 2012; 118:997-1006
8. Pierorazio PM. Management of Ronal Masses and Localized Renal Cancer, Agency for Healthcare Research and Quality, Rockwill 2016
9. Beer AJ. Comparison of 16-MDCT and MRI for characterization of kidney lesions. AJR Am J Roentgenol 2006; 186:1639
10. Israel GM. An update of the Bosniak renal cyst classification system. Urology 2005; 66:484
11. Thompson RH. Tumor size is associated with malignant potential in renal cell carcinoma cases. J Urol 2009; 181:2033
12. Mullins JK. Renal cell carcinoma seeding of a percutaneous biopsy tract. Can Urol Assoc J 7: E176-E179, 2013.
13. Sanchez A. Current Management of Small Renal Masses Including Patient Selection, Renal Tumor Biopsy, Active Surveillance, and Thermal Ablation. J Clin Oncol 36:3591-3600. 2018.
14. Campell S. Renal Mass and Localized Renal Cancer: AUA Guideline. J Urol 2017; 198:520.
15. Correa, R.J.M., et al. The Emerging Role of Stereotactic Ablative Radiotherapy for Primary Renal Cell Carcinoma: A Systematic Review and Meta-Analysis. Eur Urol Focus, 2019. 5: 958.
16. Pierorazio PM. Rive-year analysis of a multi-institutional prospective clinicl trial of delayed intervention and surveillance for small renal masses: the DISSRM registry. Eur Urol 2015; 68:408.
info@onco-suisse
- Vol. 13
- Ausgabe 7
- November 2023