- Melanom, Urogenital-Tumoren, Mammakarzinom, GIST im 2019
Melanom
Die Entwicklung zur Behandlung des Melanoms war dieses Jahr eher evolutiv als revolutionär. Neue Kombinationen wie z.B. die Kombination von Cobimetinib mit Atezolizumab gegenüber Pembrolizumab (IMSpire170) alleine vermochte in einer randomisierten Phase III Studie keinen Benefit zu verzeichnen (1). Dies obwohl das Rationale (Erhöhung der Lymphozyten Infiltration des Tumors durch den MEK Inhibitor) eigentlich überzeugend war.
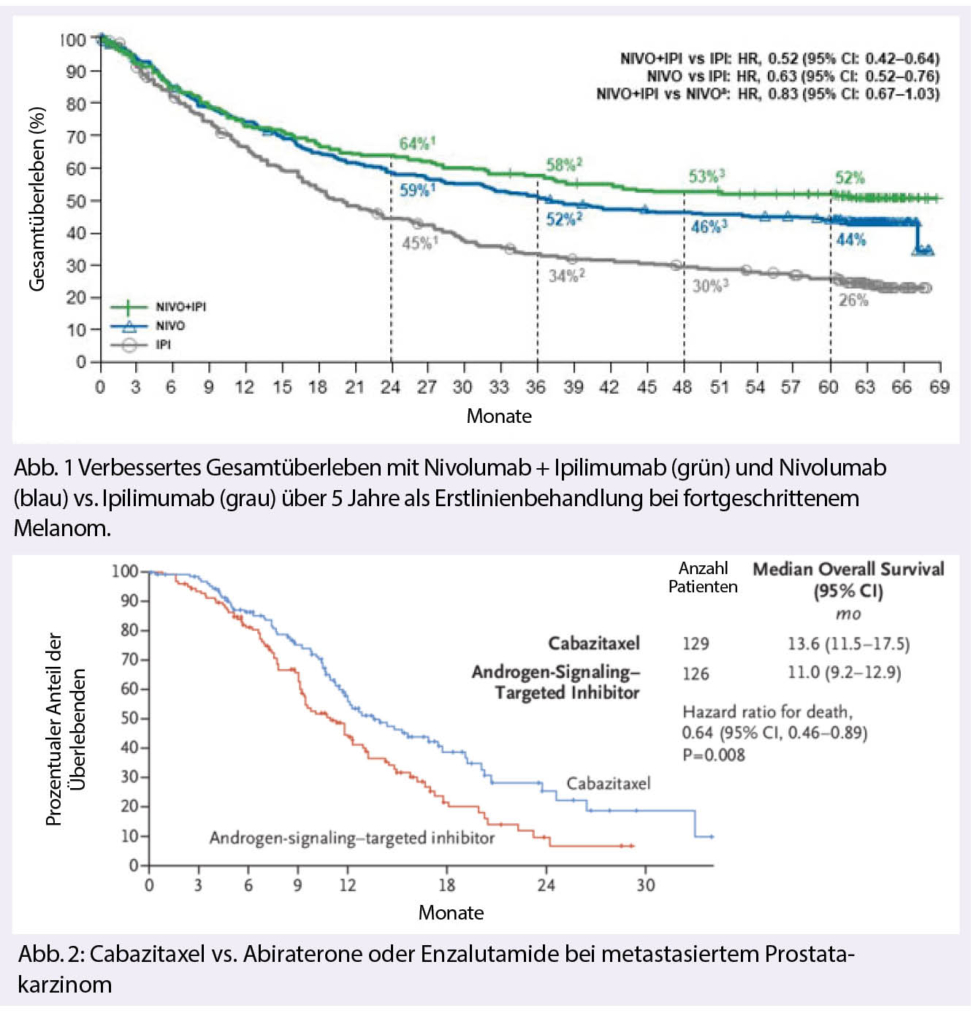
Dem gegenüber standen Langzeit-Daten zur Immuntherapie und TKI Therapie beim Melanom. Bei der Immuntherapie (Checkmate 067) wurden die 5 Jahres Überlebensdaten gezeigt (2)
Dabei wurden Zahlen erreicht, von denen wir früher nicht mal geträumt haben. Patienten mit Nivolumab erreichten ein Gesamtüberleben nach 5 Jahren von 46%, bei der Kombination mit Nivolumab plus Ipililumab waren es 60%. Leider gibt uns diese Studie keine klare Antwort, inwiefern die Kombination der PD1 Monotherapie überlegen ist und welche Subgruppen möglicherweise am meisten profitieren. Wäre diese Studie von einer kooperativen Gruppe designt worden, wäre dies vermutlich nicht «passiert».
Daneben wurden auch die Daten zum 5 Jahres progressionsfreien Überleben für Dabrafenib plus Tramentinib gezeigt (3).
Interessant hierbei ist vor allem, dass Patienten mit Low Risk Erkrankung (LDH normal und <3 Befallstationen) ein 5 Jahres PFS von 31% erreichen, derweil Patienten mit LDH hoch ein 2 Jahres PFS von 14% und ein 5 Jahres PFS von 8% erreichen. Leider wissen wir, dass Patienten mit hoher LDH leider auch auf Immuntherapien deutlich schlechter ansprechen als mit LDH normal. Für diese Patienten Population, die etwa 50% aller Patienten mit metastasiertem Melanom ausmachen, ist bis heute leider nur sehr wenig bis nichts erreicht worden.
Zuletzt finde ich auch noch die Studie der australischen Gruppe um Owen et al. bemerkenswert (4). Diese Gruppe hat eine retrospektive Outcome Analyse ihrer Patienten, die mit PD1 AK adjuvant behandelt wurden publiziert. Dabei legte sie den Fokus auf die Patienten mit Rezidiv und analysierte deren Outcome. Es wurde festgestellt, dass 71% der Patienten während der Immuntherapie rezidivierten, 29% nach Ende der adjuvanten Therapie. Von den Patienten, die nach Therapie-Ende rezidivierten, hatten 18% der Patienten die Therapie aufgrund von Toxizität frühzeitig abgebrochen.
43% der Patienten hatten ihr Rezidiv lokoregionär und 57% der Patienten hatten Fernmetastasen. Patienten mit lokoregionärem Rezidiv wurden meist erneut in kurativer Absicht reseziert. In 40% der Fälle erhielten diese Patienten zusätzlich eine andere Therapie wie Radiotherapie, erneut PD1 AK oder BRAF plus MEK Inhibtion. Insgesamt haben von den so behandelten Patienten 56% ein erneutes Rezidiv gemacht.
Patienten mit initialem Fernrezidiv oder sekundärem Fernrezidiv nach initialem lokoregionären Rezidiv wurden bezgl. ihrer Therapie und Outcome untersucht. Dabei konnte beobachtet werden, dass Patienten, die unter PD1 AK Therapie rezidiviert waren, meist die Immunkombination IPI plus NIVO (24% Response Rate) resp. die TKI Kombination MEK plus BRAF (78% Response Rate) erhielten. Der erneute Einsatz von PD1 AK alleine ergab keinen Nutzen (0% RR). Trotz zweiter Resektion kommt es häufig zu einem weiteren meist auch Fernrezidiv. Ob dabei eine sekundär adjuvante Therapie irgendeinen Stellenwert hat, ist bis dato völlig unklar.
Urogenital-Tumoren
Prostatakarzinom
Trotz grossen Fortschritten bei der Behandlung des Prostatakarzinoms sind viele Fragen zur Sequenz der verschiedenen Medikamente und der «best use of» nach wie vor unklar. Einen Puzzle-Stein zum verbesserten Verständnis einer solchen Frage wurde noch im Dezember im New England Journal of Medicine (5) publiziert. Hierbei ging es darum herauszufinden, ob nach einer Vorbehandlung mit Docetaxel und einem Rezidiv innert 12 Monaten unter Abiraterone oder Enzalutamid erneut eine Chemotherapie, diesmal mit Cabazitaxel oder dem alternativen Androgen-Blocker, durchgeführt werden soll. Dabei stellte sich klar heraus, dass die Behandlung mit Cabazitaxel überlegen ist bezgl. progressionsfreiem Überleben (4.4 versus 2.7 Monate; HR 0.52), dem Gesamtüberleben (13.6 versus 11.0 Monate; HR 0.64) sowie diversen anderen Endpunkten (Abb. 2). Cabazitaxel darf somit als Standardtherapie in dieser Situation gelten.
Darüber hinaus hat die Biomarker gesteuerte Therapie beim Prostatakarzinom nun erstmals erfolgreich Einzug gehalten (6). Im Rahmen einer randomisierten Placebo kontrollierten Phase II Studie wurden Patienten in der Kohorte A mit einer HRR Genmutation (ATM, BRCA1 und 2) auf Olaparib versus einem Androgen Rezeptor Inhibitor allein (Abiraterone bzw. Enzalutatmide) randomisiert. Dabei betrug das PFS für den Olaparib 7.39 Monate versus 3.55 Monate im Placebo-Arm. Die PFS Rate nach 12 Monaten war 28% versus 9%. Die Interim OS Daten zeigten 18.5 Monate für den Olaparib-Arm versus 15.1 Monate bei ARI allein. In der Kohorte B ohne Mutationen waren die Zahlen wenig beeindruckend.
Diese Therapie stellt somit bei Patienten mit Mutationen ein vielversprechendes Therapiekonzept dar und ist hoffentlich nur der Anfang der zielgerichteten Therapie beim Prostatakarzinom.
Blasenkarzinom
Auch beim Blasenkarzinom sind im Jahr 2019 relevante Daten publiziert worden. Im Rahmen der IMvigor-130 Studie (7) wurden Patienten mit fortgeschrittenem muskelinvasiven und metastasiertem Blasenkarzinom randomisiert auf Chemotherapie allein (Platin/Gemc) versus Chemo plus Atezolizumab versus Atezolizumab allein in der First line. Dabei zeigte sich der primäre Endpunkt PFS positiv (Chemo 6.3 Monate, Chemo/Immuno 8.2 Monate), aber noch kein statistisch signifikanter OS Benefit. Hier muss noch etwas abgewartet werden, bevor die Praxis bei Patienten mit Mutationen geändert werden kann.
Nierenzellkarzinom
In einer Phase III Studie wurden 861 nicht vorbehandelte Patienten mit metastasiertem nicht vorbehandelten klarzelligen Nierenzellkarzinom auf eine Behandlung mit Axatinib plus Pembrolizumab gegenüber Sunitinib randomisiert (8). Nach 12 Monaten waren im Axatinib/Pembro Arm 89.9% der Patienten am Leben, mit Sunitinib waren es 78.3%. Das PFS wurde ebenfalls verbessert (15.1 versus 11.1 Monate).
Ebenfalls verbessert wurde die Response Rate, so dass die Kombinationstherapie aus Axatinib und Pembrolizumab als neuer Standard in dieser Indikation gelten darf. Da die CR Rate numerisch mit Ipililumab und Nivolumab eher noch höher ist und auch das Toxizitätsprofil vorteilhaft ist, würde ich bei intermediate und high Risk die Immunkombination und bei Niedrig Risiko eher die TKI/Immunkombination einsetzen. Selbstverständlich ist bei der Wahl der Behandlung die individuelle Situation des Patienten zu berücksichtigen.
Mammakarzinom
KEYNOTE-522
Die Studie Keynote-522 (9) ist eine Phase III Studie, welche beim neoadjuvant behandelten TNBC die zusätzliche Gabe von Pembrolizumab prüft. Die pCR-Raten von fast 65% (gegenüber 51%) sind eindrücklich. Interessanterweise konnte der Benefit unabhängig des PD-L1 Status in den Subgruppen gezeigt werden. Auch die frühen EFS-Daten sind vielversprechend. Ein längeres Follow-up ist sicher noch notwendig, doch hat die zusätzliche Gabe von Pembrolizumab in dieser Indikation das Potential zu einem neuen Therapiestandard.
MONALEESA-7
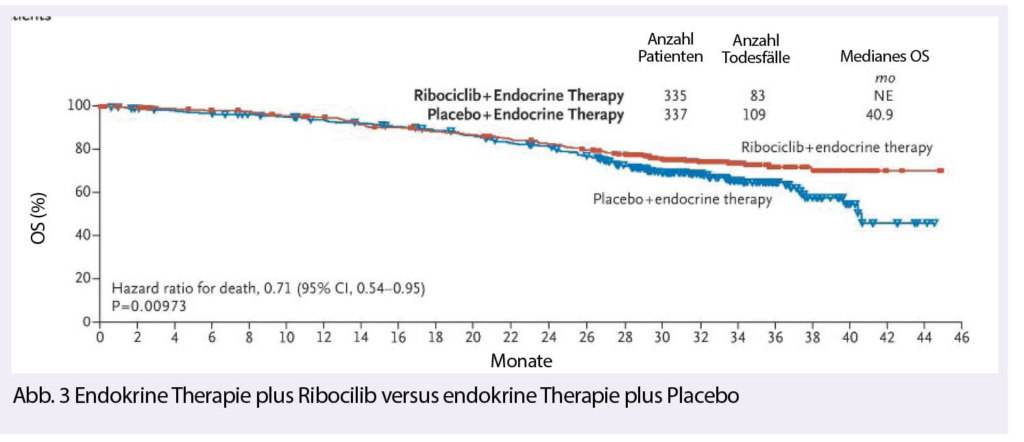
Die CDK4/6-Inhibitoren haben in der Behandlung des hormonrezeptorpositiven metastasierten Mammakarzinoms eine eindrückliche Verbesserung des PFS gezeigt (10). Dies wurde auch in der Monaleesa-7 Studie bestätigt, welche den Effekt nun auch bei prämenopausalen Patientinnen zeigte (Abb. 3). Die endokrine Therapie in Kombination mit Ribociclib verbesserte das PFS von 13 auf 23.8 Monate (HR 0.55). Am ASCO in diesem Jahr wurden nun auch die OS-Daten präsentiert, welche ebenfalls positiv sind mit einer Verbesserung des OS nach 42 Monaten von 46% auf 70.2% (HR 0.71).
DESTINY-Breast01
Trastuzumab Deruxtecan ist ein sogenanntes «Antibody-drug conjugate». Die Behandlung des metastasierten, HER2 positiven Mammakarzinoms nach Versagen von Trastuzumab, Pertuzumab und T-DM1 gestaltet sich schwierig. In San Antonio wurde eine Phase II-Studie präsentiert, welche Trastuzumab Deruxtecan prüfte (11). Mit einer ORR von 60.9% und einer DCR von 97.3% waren die Resultate eindrücklich. Das mediane PFS in dieser Phase II-Studie mit vorbehandelten Patientinnen betrug 16.4 Monate. Zu erwähnen ist das Auftreten einer interstitiellen Pneumopathie in 13% der Fälle mit vier Todesfällen (2.2%). Die FDA-Zulassung ist bereits erfolgt. Mit Spannung erwarten wir die Phase III-Daten dieser neuen Substanz.
Gastrointestinale Tumoren
Kolorektale Tumoren
Im Bereich Kolorektalkarzinome wurden dieses Jahr wenig «practice changing» Ergebnisse publiziert. Erwähnenswert ist die Beacon Studie bei Patienten mit BRAF V600E Mutationen, welche nach 1 oder 2 Chemotherapie Linien in drei Arme randomsiert wurden: 1. Encorafenib, Binimetinib und Cetuximab, versus Encorafenib plus Cetuximab versus FOLFIRI und Cetuximab resp.
Irinotecan und Cetuximab. Dabei war das OS für die Triplet Therapie 9,0 Monate, für den Chemoarm 5.4 Monate. Der Doublet Arm erreichte ein OS von 8.4 Monaten. Somit kann die Triplet Kombination nach Chemo Vorbehandlung nun als Standard gelten (12). Nachdem bei Patienten mit MSI kolorektalem Karzinom überzeugende Daten schon länger vorliegen, ist nun auch die Kassenpflichtigkeit für Nivolumab gegeben. Für die Kombination Nivolumab und Ipilimumab liegt die Swissmedic-Zulassung ebenfalls vor, die Kassenpflicht ist noch ausstehend. Somit wird der klinische Alltag betreffend Kostenübernahme für MSI high CRC-Patienten deutlich vereinfacht.
Nicht-kolorektale Tumoren
Im Bereich non CRC gibt es nach langer Durststrecke einige Lichtblicke.
- Hepatozelluläres Karzinom
Beim HCC konnte nach über 10 Jahren erstmals eine Therapie in der 1. Linie einen Überlebensvorteil gegenüber der Standardtherapie mit Sorafenib zeigen. Am ESMO ASIA wurden die Daten der IMbrave150 (13) gezeigt, bei der die Kombination von Atezolizumab mit Bevacizumab überzeugen mit Überlebensvorteil, besserem progressionsfreien Überleben und besserer Lebensqualität und wird sich wohl als neuer Standard in der 1. Linie durchsetzen. - Cholangiokarzinom (CCC)
Auch hier gibt es neue Hoffnungsträger. Hier sticht die ClarIDHy Studie (14) heraus. Trotz tiefer Inzidenz ist dank internationaler Zusammenarbeit gelungen, eine randomisierte Phase III Studie durchzuführen und den Investigatoren gebührt hierfür grosser Respekt. Es wurden Patienten mit IDH1 positiven (somit fast ausschliesslich intrahepatischen) CCC nach Vorbehandlung mit einem IDH 1 Inhibitor Ivosidenib behandelt mit eindrücklicher Verbesserung des PFS (HR 0.37) und des adjustierten OS (HR 0.46).
Ebenfalls profunde Arbeit hat die Studiengruppe der FIGHT 202 Studie (15) geleistet. In akribischer Kleinarbeit wurden beim CCC die verschiedenen FGFR Alterationen analysiert und deren Korrelation zu Klinik und Ansprechen auf eine zielgerichtete Therapie beschrieben. In dieser nicht randomisierten Phase II Studie konnten eindrückliche Ansprechraten, PFS und OS Daten für FGFR2 Fusion/Rearrangement unter Behandlung mit dem FGFR Inhibitor Pemigatinib gezeigt werden. - Magen/GEJ Karzinom
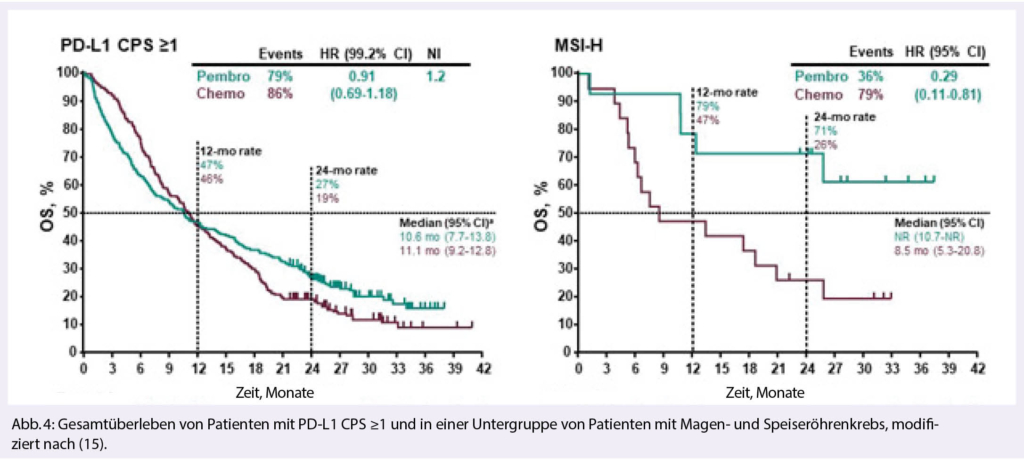
Beim metastasierten Magen/GEJ Karzinom wurden zunächst enttäuschende Daten der KEYNOTE 062 Studie (16) präsentiert. Der Vergleich des Chemoarms mit dem Kombinationsarm Chemo plus Pembrolizumab führte zu keiner Verbesserung des OS. Die später gezeigten Subgruppenanalysen relativieren jedoch deutlich. Insbesondere die MSI high Patienten profitieren deutlich von der Zugabe des PDL-1 Inhibitors. Klarer ist das Bild beim Vergleich Immuntherapie versus Chemo, nebst den MSH-high Tumoren konnten auch die CPS>10 mit verbesserten OS profitieren (Abb. 4). - Pankreaskarzinom
Auch beim metastasierten Pankreaskarzinom ergab sich mit der POLO Studie (17) für die gBRCA1+2 mutierten Patienten eine vorsichtige Euphorie. Nach platinhaltiger Chemotherapie konnte mit einer Olaparib Erhaltungstherapie das PFS deutlich verlängert werden. Leider zeigte sich bei der ersten gezeigten Analyse keinerlei OS Benefit.
Meiner Meinung nach ist die Chance äusserst gering, dass hier noch eine Differenz zustande kommt. Angesichts der Situation, dass 2. und 3. Linientherapien nur einen sehr geringen Einfluss auf den Krankheitsverlauf haben, scheint mir die Interpretation, dass der Effekt von Olaparib durch weitere Therapielinien ausgeschaltet wird, abwegig. Sollte es also nicht gelingen, noch eine Subruppe zu zeigen mit OS Benefit, ist die weitere Verwendung dieses Moleküls in diesem Setting nur in Ausnahmefällen gerechtfertigt. - Plattenepithelkarzinom
Nicht zuletzt gibt es gute Neuigkeiten für Patienten mit metastasiertem Plattenepithelkarzinom des Ösophagus: Die ATTRACTION-03 Studie (18) konnte im second line setting einen numerisch moderaten aber statistisch signifikanten Überlebensvorteil von Nivolumab versus Chemotherapie zeigen bei deutlich geringerer Toxizität.
Insgesamt konnten also in verschiedenen Bereichen der GI-Tumoren Fortschritte erreicht werden und auch hier werden molekulare Marker zunehmend wichtiger. Häufig ungelöst ist nach wie vor die Frage bzgl. Selektion bei Immuntherapien. Hier erhoffe ich mir in der Zukunft mit einem Immuno Score ein besseres Instrument zur Selektion von Patienten in die Hände zu bekommen. Das Ziel sollte es sein, Patienten, die keinen Benefit einer solchen Therapie haben, identifizieren zu können und damit auch die Verabreichung dieser meist kostspieligen Therapien zu vermeiden.
Direktor Tumor- und Forschungszentrum
Kantonsspital Graubünden
7000 Chur
tumorzentrum@ksgr.ch
1. A.M. Arance et al. Combination treatment with cobimetinib (C) and atezolizumab (A) vs pembrolizumab (P) in previously untreated patients (pts) with BRAFV600 wild type (wt) advanced melanoma: Primary analysis from the phase III IMspire170 trial. ESMO Annual Congress 2019, LBA69.
2. Larkin et al. Five-Year Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. NEJM 2019 Oct 17;381(16):1535-1546. doi: 10.1056/NEJMoa1910836. Epub 2019 Sep 28.
3. Robert C et al. Five-Year Outcomes with Dabrafenib plus Trametinib in Metastatic Melanoma. NEJM 2019 Aug 15;381(7):626-636. doi: 10.1056/NEJMoa1904059. Epub 2019 Jun 4.
4. Owen CN et al. A multicenter analysis of melanoma recurrence following adjuvant anti-PD1 therapy. J Clin Oncol ASCO Abstract 9502.
5. de Wit R et al. Cabazitaxel versus Abiraterone or Enzalutamide in Metastatic Prostate Cancer. NEJM 2019;381:2506-2518. doi: 10.1056/NEJMoa1911206. Epub 2019 Sep 30.
6. Hussain M et al. Phase III study of olaparib vs enzalutamide or abiraterone for metastastic castration resistant prostate cancer with homologous recombination repair gene alterations. ESMO Annual Congress, 2019, LBA12_PR.
7. Grande E et al. Imvigor 130: a phase III study of atezolizumab with or without platinum-based chemotherapy in previously untreated metastatic urothelial carcinoma. ESMO 2019 Annual Congress LBA14_PR
8. Rini B et al. Pembrolizumab plus Axitinib versus Sunitinib for Advanced Renal-Cell Carcinoma. NEJM 2019;380:1116-1127
9. Schmid P, Cortes J, Dent R, et al. KEYNOTE-522: Phase 3 study of pembrolizumab + chemotherapy vs placebo + chemotherapy as neoadjuvant treatment, followed by pembrolizumab vs placebo as adjuvant treatment for early-stage high-risk triple-negative breast cancer. ESMO Annual Congress 2019, LBA8_PR
10. Im SA, Lu YS, Bardia A, et al: Overall survival with ribociclib plus endocrine therapy in breast cancer. NEJM 2019 ;381:307-316. doi: 10.1056/NEJMoa1903765. Epub 2019 Jun 4.
11. Modi S, Saura C, Yamashita T, et al. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Breast Cancer. NEJM; Published online 11 December 2019. DOI: 10.1056/NEJMoa1914510
12. Kopetz S. Encorafenib, Binimetinib, and Cetuximab in BRAF V600E-Mutated Colorectal Cancer. NEJM 2019 Oct 24;381(17):1632-1643.
doi: 10.1056/NEJMoa1908075. Epub 2019 Sep 30.
13. Cheng AL et al. – IMbrave150: Efficacy and safety results from a ph III study evaluating atezolizumab (atezo) + bevacizumab (bev) vs sorafenib (Sor) as first treatment (tx) for patients (pts) with unresectable hepatocellular carcinoma (HCC)ESMO Annual Conference 2019, LBA3
14. Abou-Alfa G.K. et al. ClarIDHy: A global, phase 3, randomized, double-blind study of ivosidenib (IVO) vs placebo in patients with advanced cholangiocarcinoma (CC) with an isocitrate dehydrogenase 1 (IDH1) mutation Annals of Oncol. 2019;30 (suppl_5:v851-v934
15. Shitara K, Van Cutsem E, Bang Y-J, et al. Pembrolizumab With or Without Chemotherapy vs Chemotherapy in Patients With Advanced G/GEJ Cancer (GC) Including Outcomes According to Microsatellite Instability-High (MSI-H) Status in KEYNOTE-062.ESMO Annual Conference 2019, LBA44
16. Van Cutsem E et al. Health-Related Quality of Life (HRQoL) Impact of Pembrolizumab (P) Versus Chemotherapy (C) as First-Line (1L) Treatment in PD-L1–Positive Advanced Gastric or Gastroesophageal Junction (G/GEJ) Adenocarcinoma.ESMO Annual Conference 2019, LBA45
17. Golan T et al: Maintenance olaparib for germline BRCA-mutated metastatic pancreatic cancer. NEJM 381:317-327, 2019.
18. Kato K, et al. Nivolumab versus chemotherapy in patients with advanced oesophageal squamous cell carcinoma refractory or intolerant to previous chemotherapy (ATTRACTION-3): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2019; DOI: 10.1016/S1470-2045(19)30626-6.
info@onco-suisse
- Vol. 10
- Ausgabe 1
- Februar 2020