- Neoadjuvant – Ready for prime time? Oder bleibt es bei der etablierten adjuvanten Therapie?
In den letzten zehn Jahren hat sich auf dem Gebiet des Melanoms eine bemerkenswerte Revolution vollzogen, die mit den Immun-Checkpoint-Inhibitoren und den BRAF-gerichteten Therapien im fortgeschrittenen Stadium begann. Diese Therapien werden erfolgreich in der adjuvanten Behandlung des metastasierten Melanoms eingesetzt. Die Fähigkeit der Immun-Checkpoint-Inhibitoren, eine Immunantwort hervorzurufen, wird optimiert, wenn diese Wirkstoffe vor der Tumorresektion (neoadjuvant) verabreicht werden. Akademische Studien haben bereits beeindruckende pathologische Reaktionen auf eine neoadjuvante Immuntherapie gezeigt, die zu rezidivfreien Überlebensraten von über 90% bei den ansprechenden Patienten führten. Obwohl die adjuvante Therapie den derzeitigen Therapiestandard darstellt, deuten alle aktuellen Daten darauf hin, dass die Zukunft der neoadjuvanten Strategie gehört. Das optimale Behandlungsschema und die Frage, ob eine Deeskalation der Behandlung bei Patienten mit starkem pathologischem Ansprechen möglich ist, werden derzeit untersucht.
The field of melanoma has undergone a remarkable revolution over the past decade, beginning with immune-checkpoint inhibitors and BRAF-targeted therapies in the advanced setting that were successfully adopted in the adjuvant setting for high-risk resectable metastatic melanoma. The ability of immune-checkpoint inhibitors to elicit an immune response is optimized when these agents are administered neoadjuvant, meaning prior tumor resection. Early academic studies have shown impressive pathological responses to neoadjuvant immunotherapy translated to recurrence-free survival rates of over 90% for responders. Although adjuvant treatment is the current state of the art, all current data indicate that the future belongs to the neoadjuvant strategy. The optimal regimen – SWOG or OPACIN NEO protocol – and the question of whether de-escalation of treatment is possible in patients with major pathological response is currently being investigated.
Key Words: Melanom, adjuvante Therapie, neoadjuvante Therapie, pathologisches Ansprechen, Immuntherapie
Hintergrund
Das kutane Melanom gehört zu den aggressivsten aller Hautkrebsarten und geht von transformierten Melanozyten aus. Als Ursache für die onkogene Transformation werden bei den meisten kutanen Melanomen UV-induzierte DNA-Alterationen angesehen. Während die Häufigkeit des Melanoms weiter zunimmt, ist die Sterblichkeit bei fortgeschrittener Erkrankung in den letzten 10 Jahren deutlich zurückgegangen. Die gewonnenen Erkenntnisse aus zahlreichen Studien haben zu einem besseren Verständnis der Tumorimmunologie beigetragen und die Immuntherapie als wichtigen Ansatz in der Krebsbehandlung etabliert, sowohl im adjuvanten als auch im Erstlinientherapie Setting (1).
Adjuvante Therapie: bisherige Standardbehandlung
Die Behandlung mit dem Anti-CTLA-4-Antikörper Ipilimumab war die erste Checkpoint-Immuntherapie, die einen bedeutsamen Vorteil für sowohl das rezidivfreie als auch Gesamtüberleben beim resezierten Melanom im Stadium III im Vergleich zu Placebo zeigte. Ipilimumab wies allerdings ein schlechtes Sicherheitsprofil auf und hat sich nicht als therapeutischer Standard etabliert. Die adjuvante Anti-PD-1-Therapie mit Nivolumab oder Pembrolizumab zeigte einen signifikanten und langanhaltenden Vorteil beim rezidivfreien Überleben im Vergleich zu Ipilimumab beim resezierten Melanom Stadium III und IV (Hazard Ratio [HR] 0.65; p<0.001) oder Placebo (HR 0.57; p<0.001) (2,3). Seit kurzem werden die anti-PD-1-Antikörper in der adjuvanten Behandlung des vollständig resezierten Stadium-IIB- und IIC-Melanoms eingesetzt (4). Somit gilt die Anti-PD-1-Therapie heute als Standardtherapie zur adjuvanten Behandlung von Patienten mit vollständig reseziertem Melanom ab Stadium IIB unabhängig vom Mutationsstatus.
Neben den Anti-PD-1-Inhibitoren stehen BRAF- und MEK-gerichtete Therapien ebenfalls für die adjuvante Anwendung bei den 40% der Patienten mit BRAFV600-mutiertem Melanom zur Verfügung. Im Vergleich zu Placebo zeigte die COMBI-AD-Studie mit Dabrafenib plus Trametinib eine signifikante Verbesserung des rezidivfreien Überlebens (HR 0.47, p<0.001), des fernmetastasenfreien Überlebens (HR 0.51, 95% CI 0,40–0.65; p<0.001) und des Gesamtüberlebens bei Patienten mit BRAF-mutiertem Stadium-III-Melanom (5).
Laufend werden neue wirksame Therapien entwickelt. So zeigte sich im letzten Jahr in einer randomisierten Phase-2-Studie von Pembrolizumab plus einem personalisierten mRNA-basierten Melanom-Impfstoff eine 44%ige Reduktion des Rückfallrisikos (HR 0.56, 95% CI 0.31–1.02; p=0.0266) im Vergleich zu Pembrolizumab allein bei Patienten mit reseziertem Stadium-IIIB–IV-Melanom (6).
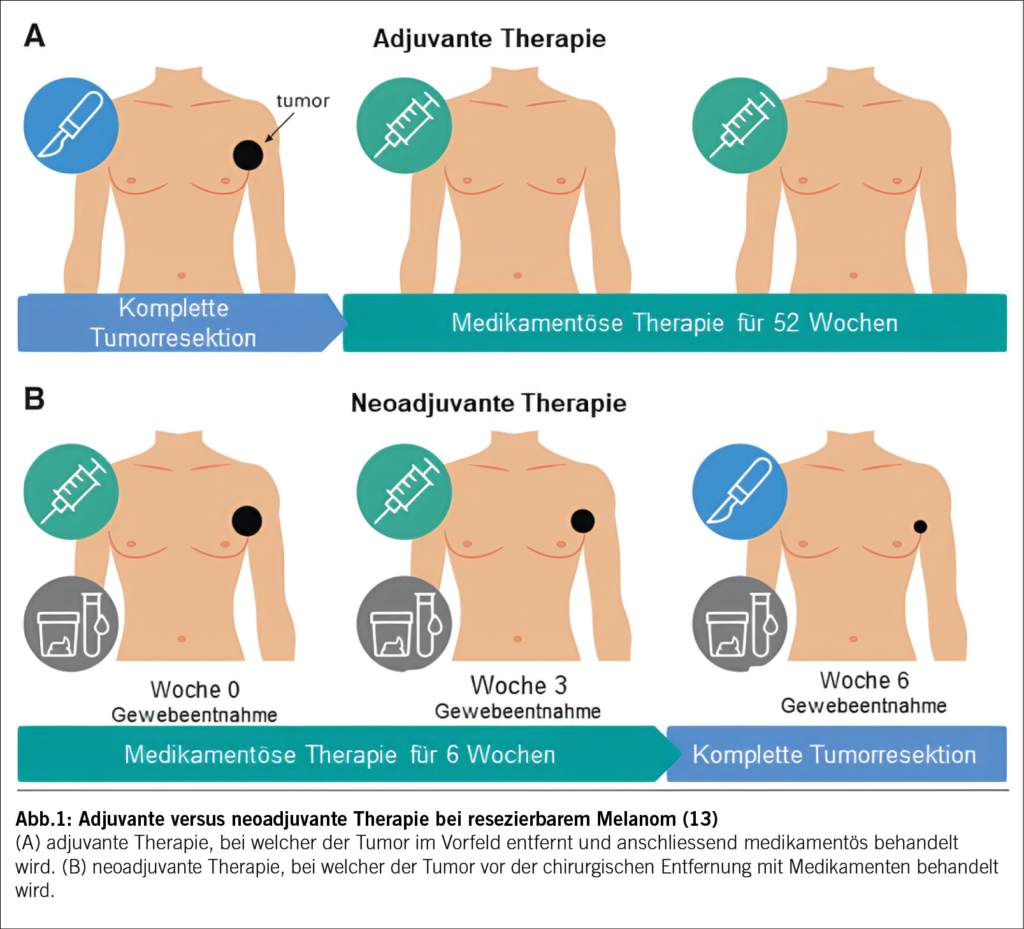
Neoadjuvante Therapie: Revolution
Trotz der signifikanten Verbesserungen im rezidivfreien Überleben unter adjuvanter Therapie erleiden etwa 30% der Patienten im Stadium III innerhalb von zwei Jahren nach Beendigung der Behandlung ein Rezidiv, während bei 15-20% ein schneller postoperativer Rückfall auftritt.
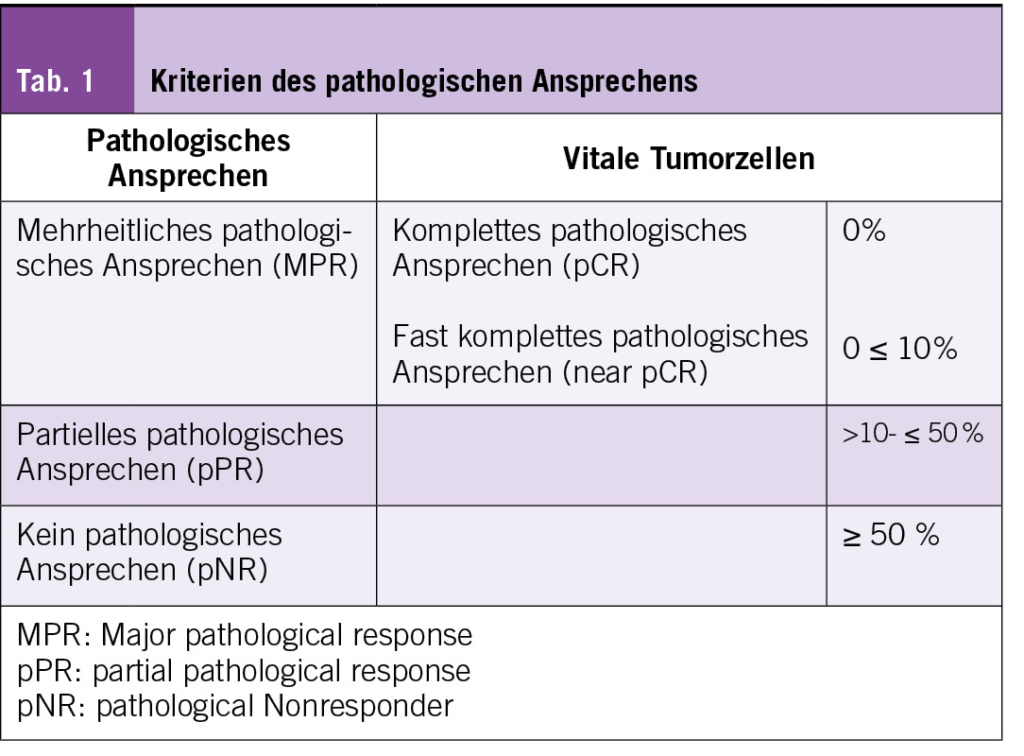
Vielversprechende Resultate zur weiteren Verbesserung des klinischen Outcomes zeigen sich zurzeit im Bereich der neoadjuvanten Therapie, welche bereits fester Bestandteil der Behandlung vieler Krebsarten ist. Klassischerweise wird dabei eine Reduktion der Tumormasse angestrebt, um die operative Morbidität zu senken und die postoperative Funktionalität bei anatomisch heiklen Strukturen zu erhöhen (Abb. 1). Mit den neuen Therapieansätzen der Checkpoint-Inhibitoren ergeben sich nun noch weitere Vorteile als nur die Verkleinerung der Tumormasse. Es wird angenommen, dass Checkpoint-Inhibitoren am besten funktionieren, wenn eine grosse und heterogene Tumormasse vorliegt. Je mehr Tumorantigene beim Start der Therapie vorhanden sind, desto höher ist die Angriffsfläche der T-Zellen und somit die Immunantwort. So konnte bei neoadjuvant behandelten Patienten im Blut eine höhere Diversität als auch absolute Anzahl von Tumor spezifischen T-Zellen nachgewiesen werden. Weiter ergibt sich neu die Möglichkeit, in dem entfernten Gewebe das histologische Ansprechen zu überprüfen (Tab. 1). Diese prognostisch wichtige Information könnte helfen, um individuelle Therapieentscheidungen in der weiteren Behandlung zu treffen. So könnte dies beispielsweise dazu führen, dass man bei fehlendem Ansprechen auf eine Therapie schon früh in der Behandlung auf eine weniger toxische und potenziell effektivere Alternative wechselt. Weiter wird überlegt, dass der sofortige Beginn mit einer Immuntherapie, ohne die wochenlange Verzögerung durch das Abwarten der Operation, einen positiven Einfluss durch die frühzeitige Mitbehandlung von nicht entdeckten Mikrometastasen haben könnte (7).
Bisherige Daten zeigen vielversprechende Ergebnisse, wobei die zielgerichtete Behandlung (BRAF/MEK) der Immuntherapie unterlegen scheint und deshalb eine untergeordnete Rolle spielt. Eine der ersten Untersuchungen dazu war die OpACIN-Studie. Sie umfasste 20 Stadium-IIIB/IIIC-Melanom-Patienten, die randomisiert Ipilimumab 3 mg/kg plus Nivolumab 1 mg/kg entweder adjuvant in 4 Zyklen oder aufgeteilt in 2 Zyklen neoadjuvant und 2 adjuvant erhielten. Dabei konnte eine Ansprechrate von 78% und ein ereignisfreies Überleben von 80% über zwei Jahre für den neoadjuvanten Arm gezeigt werden (8). In der SWOG S1801 randomisierte Studie wurde die etablierte adjuvante Therapie mit Pembrolizumab mit 18 postoperativen Zyklen mit einem neoadjuvanten Schema mit 3 prä- und 15 postoperativen Zyklen verglichen. Dabei konnte eine Reduktion von 41% für das ereignisfreie Überleben (Zeitraum von der Randomisierung bis zu einem Rezidiv, Krankheitsprogression oder Tod) im neoadjuvanten Arm gegenüber der adjuvanten Therapie gezeigt werden (9).
Des Weiteren hat die OpACIN-neo die verschiedenen Dosierungsschemata untersucht. Ziel war, bei möglichst geringer Toxizität eine ebenso wirksame Dosierung zu identifizieren. Die Patienten wurden in drei Gruppen randomisiert und erhielten verschiedene Dosierungen von Ipilimumab und Nivolumab. Das primäre Ziel war das Auftreten von Grad-3- bis Grad-4-immunbedingter Toxizität innerhalb der ersten 12 Wochen. Das Dosierungsschema mit zwei Zyklen von Ipilimumab 1 mg/kg plus Nivolumab 3 mg/kg hat sich als das geeignete Schema mit guter Verträglichkeit und hoher pathologischer Ansprechrate etabliert. Die 3-Jahres-Rezidivfreies-Überleben-Rate lag bei 95% für Patienten mit pathologischem Ansprechen gegenüber 37% für Patienten ohne pathologisches Ansprechen (P < 0,001); das pathologische Ansprechen war der stärkste Prädiktor für ein Rezidiv.
In einer prospektiv randomisierten Phase-II-Studie wurde auch TVEC untersucht. Im Vergleich zur konventionell gehaltenen Gruppe zeigte sich sogar auch nach 5 Jahren Nachbeobachtungszeit noch ein eindrucksvoller Vorteil bezüglich Rezidiv-freiem Intervall und Gesamtüberleben (10).
Benötigen alle Patienten nach einer neoadjuvanten Behandlung eine adjuvante Nachbehandlung? Die PRADO-Studie befasste sich mit der Frage der Deeskalation der Behandlung bei Patienten mit pathologischem Ansprechen, während die Behandlung bei Patienten mit fehlendem pathologischem Ansprechen eskaliert wurde. Das Ergebnis war eine 2-Jahres-Fernmetastasen freie Überlebensrate von 98% bei MPR-Patienten, die nur eine neoadjuvante Therapie erhielten, aber auch ein verbesserter Outcome von pNR-Patienten durch die Hinzunahme einer adjuvanten Therapie (11).
Die Wirksamkeit der neoadjuvanten Checkpoint-Inhibition im Vergleich zur aktuellen adjuvanten Standardtherapie wurde nun unter anderem in der seit 2021 laufenden Phase 3 randomisierten NADINA Studie untersucht. Patienten in Arm A erhielten basierend auf dem Wissen der OpACIN-neo Studie 2 Zyklen von Ipilimumab 80 mg und Nivolumab 240 mg und unterzogen sich in der 6. Woche einer therapeutischen Lymphknotenresektion. Bei einem pathologischen partiellen Ansprechen oder Nichtansprechen erfolgte nach der Operation eine adjuvante Behandlung mit Nivolumab (11 Zyklen) oder Dabrafenib + Trametinib (46 Wochen), wenn eine BRAFV600-Mutation vorlag. Die Patienten mit einem pathologischen kompletten Ansprechen erhielten keine weitere adjuvante Therapie. Patienten in Arm B haben sich zunächst einer therapeutischen Lymphknotenresektion unterzogen, gefolgt von 12 Zyklen Nivolumab 480 mg. Der primäre Endpunkt war das ereignisfreie Überleben (12). Der Unterschied in der mittleren Überlebenszeit betrug 8,0 Monate (99.9% CI, 4.94 bis 11.05; P<0.001) mit einer hochsignifikanten Hazard Ratio für Progression, Rezidiv oder Tod bei 0.32 für die neoadjuvante Gruppe.
Herausforderungen und Ausblick
Im Vergleich zu den grossangelegten, von der pharmazeutischen Industrie gesponserten adjuvanten Studien, handelt es sich bei den aktuellen Veröffentlichungen zu neoadjuvanter Therapie um akademische Studien. Es ist unwahrscheinlich, dass pharmazeutische Unternehmen solche grossen Studien durchführen, welche unabdingbar für die Zulassung sind.
Der nachgewiesene Nutzen hinsichtlich rezidivfreiem Überleben in der Swog S1801, der Nadina und der PRADO-Studie sowie der nachgewiesene Profit einer neoadjuvanten Behandlung im Vergleich zur adjuvanten Behandlung sollte bei ausgewählten Patienten in der klinischen Praxis integriert werden. Verschiedene Organisationen wie EADO, EORTC, INMC (International Neoadjuvant Melanoma Consortium) und die Melanoma World Society plädieren für die sofortige Einführung der neoadjuvanten Immuntherapie in der Melanom Behandlung in die aktuellen Leitlinien. Die neoadjuvante Immuntherapie ist neu in Australien zugelassen.
Was sind die aktuellen Herausforderungen und offenen Fragen? Der ideale Behandlungsplan ist komplexer und die optimale Wahl sollte neben Toxizität und Wirksamkeit (pathologisches Ansprechen) auch auf der Grundlage von Biomarkern wie der INF-Signatur oder beispielsweise des Darmmikrobioms getroffen werden. Basierend auf den vorläufigen Ergebnissen einer Studie, in der 90% der Patienten mit einer hohen IFNg-Signatur positiv auf die Nivolumab-Monotherapie reagierten, könnte ein individualisierter Therapieansatz erwogen werden. Patienten mit einer hohen IFNg-Signatur könnten von einer Nivolumab-Monotherapie profitieren, während Patienten mit einer niedrigen IFNg-Signatur möglicherweise besser auf eine Kombinationstherapie ansprechen. MPR-Patienten scheinen im Anschluss keine adjuvante Behandlung zu benötigen. Basierend sich auf die aktuelle Ergebnisse der NADINA Studie, ist die Kombinationsbehandlung ipilimumab-nivolumab entsprechend dem Protokoll die führende Option. Darüber hinaus gibt es keine wissenschaftlichen Daten, welche belegen, dass Patienten im Falle eines erneuten Rezidivs weniger gut auf die nachfolgende Behandlung ansprechen.
Alle bisherigen neoadjuvanten Studien konzentrierten sich auf eine sorgfältig ausgewählte Population mit einzelnen makroskopischen Lymphknoten oder In-transit-Metastasen. Dies ist die Population, in der der neoadjuvante Ansatz in den multidisziplinären Tumorboards aktiv diskutiert werden sollte. Patienten mit voluminöser Lymphknotenerkrankung oder mehreren Lymphknoten- und Transitmetastasen sind keine guten Kandidaten für ein neoadjuvantes Setting. Für diese Patienten sollte eine Behandlung im Rahmen klinischer Protokolle dringend empfohlen werden. Schliesslich spielt die histopathologische Beurteilung eine grosse Rolle für die weitere Behandlung. Die histopathologische Beurteilung von neoadjuvanten Proben durch speziell geschulte Pathologen ist ebenfalls von entscheidender Bedeutung.
PD Dr. med. Joanna Mangana ¹ ²
Dr. med. Fabienne Huber ¹
Dr. med. Laura Pawlik ¹
Prof. Dr. med. Reinhard Dummer ¹ ²
¹ Universitätsspital Zürich, Dermatologische Klinik, Rämistrasse 100, 8091 Zürich
² Universität Zürich, Rämistrasse 71, 8006 Zürich
Copyright Aerzteverlag medinfo AG
Universitätsspital Zürich
Dermatologische Klinik
Rämistrasse 100
8091 Zürich
Universität Zürich
Rämistrasse 71
8006 Zürich
Universitätsspital Zürich
Dermatologische Klinik
Rämistrasse 100
8091 Zürich
Universitätsspital Zürich
Dermatologische Klinik
Rämistrasse 100
8091 Zürich
Die Autor/-innen haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Obwohl die adjuvante Therapie beim fortgeschrittenen Melanom heute Standard ist, weisen Daten aktuell darauf hin, dass die Zukunft der neoadjuvanten Strategie gehört. Das optimale Behandlungsschema sowie die Frage, ob alle Patienten nach einer neoadjuvanten Therapie eine anschliessende adjuvante Nachbehandlung bedürftigen, ist derzeit offen.
1. Garbe C et al.: European consensus-based interdisciplinary guideline for melanoma. Part 1: Diagnostics: Update 2022. European Journal of Cancer. 2022; 170:236-255.
2. Weber J, Mandala M, Del Vecchio M, et al. Adjuvant nivolumab versus ipilimumab in resected stage III or IV melanoma.N Engl J Med 2017; 377: 1824–35.
3. Eggermont AMM, Blank CU, Mandala M, et al. Adjuvant pembrolizumab versus placebo in resected stage III melanoma. N Engl J Med 2018; 378: 1789–801.
4. Long GV, Luke JJ, Khattak MA, et al. Pembrolizumab versus placebo as adjuvant therapy in resected stage IIB or IIC melanoma (KEYNOTE-716): distant metastasis-free survival results of a multicentre, double-blind, randomised, phase 3 trial. Lancet Oncol 2022; 23: 1378–88.
5. Long GV, Hauschild A, Santinami M, et al. Adjuvant dabrafenib plus trametinib in stage III BRAF-mutated melanoma. N Engl J Med 2017; 377: 1813–23.
6. Khattak MA, Carlino M, Meniawy T, et al. A personalized cancer vaccine, mRNA-4157 (V940), combined with pembrolizumab alone in patients with resected high-risk melanoma: efficacy and safety results from the randomized, open-label phase 2 mRNA-4157-P201/ KEYNOTE-942 trial. American Association for Cancer Research Annual Meeting 2023; Apr 14–19, 2023 (oral presentation CT001)
7. Long GV et al. Neoadjuvant Checkpoint Immunotherapy and Melanoma: The Time Is Now. Journal of clinical oncology: official journal of the American Society of Clinical Oncology vol. 41,17 (2023): 3236-3248. doi:10.1200/JCO.22.02575.
8. Versluis JM, Menzies AM, Sikorska K, et al. Survival update of neoadjuvant ipilimumab plus nivolumab in macroscopic stage III melanoma in the OpACIN and OpACIN-neo trials. Ann Oncol 34:420-430, 2023.
9. Patel SP, Othus M, Chen Y, et al. Neoadjuvant-Adjuvant or Adjuvant-Only Pembrolizumab in Advanced Melanoma. N Engl J Med. 2023 Mar 2;388(9):813-823. doi: 10.1056/NEJMoa2211437.
10. Dummer R, Gyorki DE, Hyngstrom J, et al. Neoadjuvant talimogene laherparepvec plus surgery versus surgery alone for resectable stage IIIB-IVM1a melanoma: a randomized, open-label, phase 2 trial. Nat Med. 2021;27(10):1789-1796. doi:10.1038/s41591-021-01510-7.
11. Reijers ILM, Menzies AM, van Akkooi ACJ, et al. Personalized response-directed surgery and adjuvant therapy after neoadjuvant ipilimumab and nivolumab in high-risk stage III melanoma: the PRADO trial. Nat Med. 2022;28(6):1178-1188. doi:10.1038/s41591-022-01851-x.
12. Lucas MW, Lijnsvelt J, Pulleman S, et al: The NADINA trial: A multicenter, randomised, phase 3 trial comparing the efficacy of neoadjuvant ipilimumab plus nivolumab with standard adjuvant nivolumab in macroscopic resectable stage III melanoma. J Clin Oncol 40, 2022.
13. Adaptiert nach: Georgina V. Long et al. Neoadjuvant Checkpoint Immunotherapy and Melanoma: The Time Is Now. JCO 41, 3236-3248(2023).
DOI:10.1200/JCO.22.02575
info@onco-suisse
- Vol. 14
- Ausgabe 3
- Juni 2024








