- Neue radioonkologische Konzepte bei Hirnmetastasen
Hirnmetastasen sind eine einschneidende Komplikation, die bei bis zu 20 % der Patienten mit fortgeschrittenen soliden Malignomen auftritt, und stellen eine Hauptursache für Morbidität und Mortalität in dieser Patientengruppe dar. Die moderne Bildgebung mit der Magnetresonanztomographie (MRT) sowie die längeren Krankheitsverläufe dank wirksamerer systemischer Therapien tragen zu einem stetigen Anstieg der Prävalenz von Hirnmetastasen bei. Obwohl neue Wirkstoffe, die im zentralen Nervensystem wirken, entwickelt werden, ist ihre Wirksamkeit im ZNS nach wie vor begrenzt. Die aktuellen Leitlinien empfehlen die primäre radiochirurgische Behandlung von bis zu drei Hirnmetastasen mit einem maximalen Durchmesser von 2,5 cm (1), wobei man auf die zusätzliche oder alleinige Ganzhirnbestrahlung verzichten soll. Die Empfehlung der Radiochirurgie stützt sich auf die Schonung des normalen Hirngewebes zur Erhaltung der neurokognitiven Funktionen (bei der stereotaktischen Bestrahlung werden nur die Metastasen im Zielvolumen bestrahlt) und auf die besseren lokalen Kontrollraten, die mit höheren Bestrahlungsdosen erreicht werden, was sich in einem verbesserten Gesamtüberleben niederschlagen kann. In Anbetracht dessen ist der Einsatz der therapeutischen Ganzhirnbestrahlung deutlich zurückgegangen. In verschiedenen Situationen bleibt der Wert der Radiochirurgie jedoch umstritten. Im Folgenden wird die Indikation für die definitive Radiochirurgie (die als fraktionierte stereotaktische Strahlentherapie bezeichnet wird, wenn sie in mehreren Sitzungen durchgeführt wird) in den klinischen Szenarien von Patienten mit mehr als vier Hirnmetastasen erörtert und auf der Grundlage der verfügbaren Daten der relative Nutzen der postoperativen versus präoperativen Radiochirurgie diskutiert, wenn eine Metastasektomie indiziert ist.
Brain metastases are a drastic complication occurring in up to 20 % of patients with advanced solid malignancies and represent a major cause of morbidity and mortality in this patient group. Modern imaging with magnetic resonance imaging (MRI), as well as longer disease courses due to more effective systemic therapies, are contributing to a steady increase in the prevalence of brain metastases. Although new agents that act in the central nervous system are being developed, their efficacy in the CNS remains limited. Current guidelines recommend primary radiosurgical treatment of up to three brain metastases with a maximum diameter of 2.5 cm (1) while avoiding additional or sole whole-brain irradiation. The recommendation of radiosurgery is based on the sparing of normal brain tissue to preserve neurocognitive function (in stereotactic irradiation, only the metastases in the target volume are irradiated) and the better local control rates achieved with higher irradiation doses, which may translate into improved overall survival. In view of this, the use of therapeutic whole-brain irradiation has declined significantly. However, in several situations, the value of radiosurgery remains controversial. In the following, we discuss the indication for definitive radiosurgery (termed fractionated stereotactic radiotherapy when delivered in multiple sessions) in the clinical scenarios of patients with more than four brain metastases and, based on available data, discuss the relative benefit of postoperative versus preoperative radiosurgery when metastasectomy is indicated.
Keywords: Brain metastases, primary radiosurgical treatment, metastasectomy
In den letzten Jahren hat sich die Indikation zur Radiochirurgie bei Patienten mit mehr als 4 Hirnmetastasen dynamisch entwickelt. Die Begrenzung auf 3 Hirnmetastasen war bisher zumindest teilweise auf den grösseren technischen, finanziellen und zeitlichen Aufwand zurückzuführen, der mit der Behandlung einer grösseren Anzahl von Hirnmetastasen verbunden ist. Bedenken bestanden auch im Hinblick auf eine möglicherweise höhere Toxizität durch ein grösseres kumulatives Bestrahlungsvolumen. Yamamoto et al. veröffentlichten 2014 eine grosse multizentrische Studie (2), die eine Nichtunterlegenheit in Bezug auf das Gesamtüberleben und die meisten sekundären Endpunkte nach radiochirurgischer Behandlung von 5-10 versus 2-4 Hirnmetastasen zeigte. Mit dieser Arbeit konnten einige der Bedenken ausgeräumt werden. Dieselbe Gruppe bestätigte in ihrer Publikation von 2019, dass ausgewählte Patienten mit 10 oder mehr Hirnmetastasen ebenfalls als Kandidaten für eine Radiochirurgie in Frage kommen (3). Gleichzeitig ist die Inzidenz von radiochirurgischen Komplikationen zwischen Gruppen mit 1, 2-4, 5-10 sowie > 10 Hirnmetastasen vergleichbar (3). Derzeit gibt es noch keinen Konsens welches kumulative Bestrahlungsvolumen bei der Radiochirurgie von Multimetastasen erlaubt ist (15 cm3 (2), 25 cm3 (4)).
Eine Ganzhirnbestrahlung kann die Häufigkeit neuer Läsionen verringern, allerdings um den Preis einer schlechteren neurokognitiven Funktion, weshalb eine Abschätzung der Lebenserwartung unter Berücksichtigung sowohl der extrakraniellen als auch der intrakraniellen Tumorsituation für die Optimierung der individuellen Therapie wichtig ist. Eine Ganzhirnbestrahlung unter Vermeidung der Hippocampus-Gehirnstruktur in Kombination mit dem Medikament Memantin bietet einer randomisierten Studie zufolge bei ausgewählten Patienten einen gewissen neuroprotektiven Effekt; eine maximale Schonung des normalen Gehirns kann jedoch nur durch eine Radiochirurgie erreicht werden (1). Die bisher verwendeten Prognoseinstrumente wie ds-GPA (disease-specific graded prognostic assessment) oder BMV (brain metastases velocity) (5), d.h. die Anzahl der neuen Hirnmetastasen pro Jahr, sind mit Vorsicht zu geniessen. Derzeit wird argumentiert, dass auch das Bestrahlungsvolumen und systemische Therapieoptionen (Immuntherapie und zielgerichtete Therapien) zusätzlich berücksichtigt werden sollten (6).
Postoperative fraktionierte stereotaktische Radiotherapie versus präoperative Radiochirurgie
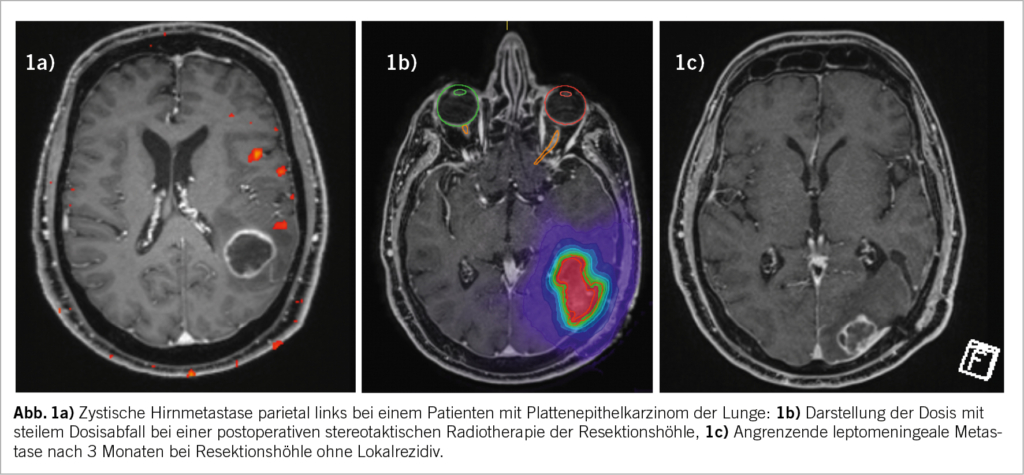
Die fraktionierte stereotaktische Strahlentherapie wird bei Hirnmetastasen von mehr als 2 cm bzw. 3 cm empfohlen. In einer Meta-Analyse wurde gezeigt, dass diese Strategie im Vergleich zur einfraktionierten Radiochirurgie mit einer signifikant niedrigeren Strahlennekroserate (23 % gegenüber 7 %) (7) und einer besseren lokalen Kontrollrate (91 % gegenüber 77 %) verbunden ist (8). Im Analogieschluss zur postoperativen Situation, in der die Resektionshöhle oft relativ gross ist, gilt deshalb in den meisten Zentren als Standardpraxis, eine Resektionshöhle nach einer metastatischen Resektion mit einer stereotaktischen Technik mit 3 bis 6 Fraktionen zu bestrahlen. Interessanterweise bietet diese Strategie in der postoperativen Situation möglicherweise eine höhere lokale Kontrollrate gegenüber der Radiochirurgie (87,3 % gegenüber 80 %) (9). Die Inzidenz von Radionekrosen in der postoperativen Situation beträgt in veröffentlichten Serien durchschnittlich 10,3 % (0-19 %) (10), wobei ein höheres Toxizitätsrisiko bei 3 Fraktionen beobachtet wurde (11). Es gibt auch eine Debatte über die angewandten «Sicherheits»-Säume (PTV Margin). Der Kompromiss zwischen besserer lokaler Kontrolle und häufigeren Strahlennekrosen dürfte bei 2 mm liegen (10).
Die noduläre leptomeningeale Metastasierung ist ein bekanntes Versagensmuster nach einer Hirnmetastasektomie mit einer Inzidenz von bis zu 18 % (9). Eine grössere Operationszugang und die Resektion mehrerer Metastasen, ein Zeitintervall zwischen Operation und fraktionierter stereotaktischer Bestrahlung von mehr als 50 Tagen, die Histologie Mammakarzinom und die infratentorielle Lage wurden als potenzielle Risikofaktoren für leptomeningeale Rezidive ermittelt (10). Eine diffuse leptomeningeale Erkrankung ist in der Regel eine Indikation für eine Ganzhirnbestrahlung, die mit den bekannten Toxizitäten wie neurokognitiven Beeinträchtigungen und Alopezie einhergeht. Das Bestreben, die leptomeningeale Rezidivrate zu reduzieren und gleichzeitig die lokalen Kontrollraten in der Kavität ohne zusätzliche Toxizität aufrechtzuerhalten, bildet die Grundlage für das Konzept die Radiochirurgie präoperativ anstelle von postoperativ durchzuführen. Es gibt zahlreiche Argumente für die präoperative Radiochirurgie von resektablen Hirnmetastasen. Wie bereits erwähnt, führt die Aussaat von Tumorzellen in die Zerebrospinalflüssigkeit während des neurochirurgischen Eingriffs zu einem häufigeren Vorkommen der nodulären leptomeningealen Metastasierung. Deshalb ist die Idee der Sterilisierung der Tumorzellen durch die präoperative Radiochirurgie besonders attraktiv. Die bereits publizierten retrospektiven Serien der präoperativen Radiochirurgie weisen eine Inzidenz der leptomeningealen Rezidive von nur 0-7 % (12,13) auf. Darüber hinaus stellt in der klinischen Praxis eine Konturierung der Operationshöhle nicht selten eine gewisse Herausforderung dar. Insbesondere sind die meningealen Resektionsränder nicht immer eindeutig zu definieren. Folglich resultieren diese und andere Faktoren in der Notwendigkeit der Anwendung von grösseren Margins und konsekutiv in einem grösseren Bestrahlungsvolumen des normalen Hirngewebes (insbesondere bei kleineren Hirnmetastasen) (14), (15). Im Gegensatz dazu ist die Volumendefinition bei der präoperativen Radiochirurgie wesentlich einfacher und der Sicherheitssaum kann auf 1 mm begrenzt werden. Des Weiteren ist die chirurgische Entfernung des bestrahlten Hirngewebes ebenfalls von Vorteil und senkt das Risiko für Radionekrose. Ein weiterer Vorteil bezieht sich auf die Möglichkeit der früheren Durchführung der Radiochirurgie von zusätzlichen und nicht operativ entfernten Hirnmetastasen sowie der Einleitung einer postoperativen systemischen Therapie. Wie die Machbarkeitsstudie PREOP–1 erwiesen hat (Manuskript in Vorbereitung) ist die neoadjuvante radiochirurgische Behandlung bezüglich zeitlichen Ablaufs und ohne relevant erhöhten Ressourcenaufwand gut möglich. Gleichzeitig hat die Machbarkeitsstudie keine relevanten Sicherheitsbedenken aufgeworfen. Die Gefahr einer falsch positiven Diagnose der Hirnmetastase durch die präoperative MRT ist zwar nicht vollkommen vernachlässigbar, aber dank der modernen multiparametrischen Bildgebung ist die Inzidenz deutlich reduziert. Der Nutzen der präoperativen Radiochirurgie wird aktuell im Rahmen der internationalen randomisierten Phase III Studie (PREOP-2), die eine Fraktion präoperativ mit fünf Fraktionen postoperativ mit dem primären Endpunkt «Inzidenz leptomeningealer Rezidive» vergleicht, weiter untersucht.
Copyright bei Aerzteverlag medinfo AG
Radio-Onkologie-Zentrum KSA-KSB
Kantonsspital Aarau
Tellstrasse 25
5001 Aarau
Der Autor hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Die bessere Prognose bei Patienten mit einer metastasierten Krebserkrankung begünstigt die aktuell dynamische Entwicklung der Radiochirurgie der Hirnmetastasen, die für sich ebenfalls zu einem längeren Gesamtüberleben beiträgt.
◆ Ein proaktiver Entscheidungsprozess soll bei Patienten mit multiplen Hirnmetastasen vor allem auf kumulativem Zielvolumen und nicht lediglich auf der Anzahl der Läsionen basieren.
◆ Die aktuell untersuchte präoperative Radiochirurgie berechtigt zur
Hoffnung, dass die operierten Patienten in der nahen Zukunft von verbesserter lokaler Kontrolle und niedrigerer Inzidenz der leptomeningealen Erkrankung profitieren.
◆ Die Indikationsstellung für die Ganzhirnbestrahlung wurde deutlich reduziert und ist heutzutage hauptsächlich für Patienten mit diffuser leptomeningealer Erkrankung oder stark ausgeprägter Symptomatik reserviert.
1. Kocher, M., et al. (2014). “Stereotactic radiosurgery for treatment of brain metastases. A report of the DEGRO Working Group on Stereotactic Radiotherapy.” Strahlenther Onkol 190(6): 521-532.
2. Yamamoto, M., et al. (2014). “Stereotactic radiosurgery for patients with multiple brain metastases: a case-matched study comparing treatment results for patients with 2-9 versus 10 or more tumors.” J Neurosurg 121 Suppl: 16-25.
3. Yamamoto, M., et al. (2019). “Stereotactic Radiosurgery for Patients with 10 or More Brain Metastases.” Prog Neurol Surg 34: 110-124.
4. Niranjan, A., et al. (2019). “Guidelines for Multiple Brain Metastases Radiosurgery.” Prog Neurol Surg 34: 100-109.
5. Farris, M., et al. (2017). “Brain Metastasis Velocity: A Novel Prognostic Metric Predictive of Overall Survival and Freedom From Whole-Brain Radiation Therapy After Distant Brain Failure Following Upfront Radiosurgery Alone.” Int J Radiat Oncol Biol Phys 98(1): 131-141.
6. Rogers, S. J., et al. (2022). “Radiosurgery for Five to Fifteen Brain Metastases: A Single Centre Experience and a Review of the Literature.” Front Oncol 12: 866542.
7. Lehrer, E. J., et al. (2019). “Single versus Multifraction Stereotactic Radiosurgery for Large Brain Metastases: An International Meta-analysis of 24 Trials.” Int J Radiat Oncol Biol Phys 103(3): 618-630.
8. Minniti, G., et al. (2016). “Single-Fraction Versus Multifraction (3 x 9 Gy) Stereotactic Radiosurgery for Large (>2 cm) Brain Metastases: A Comparative Analysis of Local Control and Risk of Radiation-Induced Brain Necrosis.” Int J Radiat Oncol Biol Phys 95(4): 1142-1148.
9. Akanda, Z. Z., et al. (2020). “Post-operative stereotactic radiosurgery following excision of brain metastases: A systematic review and meta-analysis.” Radiother Oncol 142: 27-35.
10. Rogers, S., et al. (2021). “Five fraction stereotactic radiotherapy after brain metastasectomy: a single-institution experience and literature review.” J Neurooncol 155(1): 35-43.
11. Garimall, S., et al. (2020). “Evidence of dose-response following hypofractionated stereotactic radiotherapy to the cavity after surgery for brain metastases.” J Neurooncol 146(2): 357-362.
12. Patel, K. R., et al. (2017). “Comparing pre-operative stereotactic radiosurgery (SRS) to post-operative whole brain radiation therapy (WBRT) for resectable brain metastases: a multi-institutional analysis.” J Neurooncol 131(3): 611-618.
13. Prabhu, R. S., et al. (2017). “Single-Fraction Stereotactic Radiosurgery (SRS) Alone Versus Surgical Resection and SRS for Large Brain Metastases: A Multi-institutional Analysis.” Int J Radiat Oncol Biol Phys 99(2): 459-467.
14. Bugarini, A., et al (2022). “Pre-operative stereotactic radiosurgery for cerebral metastatic disease: A retrospective dose-volume study”. Radiother Oncol
15. Acker, G., et al. (2023). “What if: A retrospective reconstruction of resection cavity stereotactic radiosurgery to mimic neoadjuvant stereotactic radiosurgery.” Front Oncol 13: 1056330.
info@onco-suisse
- Vol. 13
- Ausgabe 5
- August 2023