- Neue WHO Klassifikation für Hirntumoren 2021 – Einfluss auf den klinischen Alltag
Aufgrund der raschen Entwicklung im molekular-genetischen Verständnis primärer Hirntumoren wird 2021 eine Revision der WHO Klassifikation publiziert. Dort finden sich wesentliche Neuerungen zum diagnostischen Algorithmus und zur Nomenklatur primärer Hirntumoren. Diese werden unter anderem den Empfehlungen des interdisziplinären Konsortiums «cIMPACT-NOW» (Consortium to Inform Molecular and Practical Approaches to CNS Tumour Taxonomy – Not Officially WHO) entnommen.
En raison de l’ évolution rapide de la compréhension moléculaire et génétique des tumeurs cérébrales primaires, une révision de la classification de l’ OMS sera publiée en 2021. Cela comprendra des modifications importantes de l’ algorithme du diagnostic et de la nomenclature des tumeurs cérébrales primaires. Celles-ci sont tirées des recommandations du consortium interdisciplinaire «cIMPACT-NOW» (Consortium to Inform Molecular and Practical Approaches to CNS Tumour Taxonomy – Pas officiellementde l’ OMS).
Die letzte und vierte Auflage der WHO-Klassifikation von Hirntumoren, die 2016 veröffentlicht wurde, führte zu einer wesentlichen Umstrukturierung des diagnostischen Ansatzes für Hirntumoren. Obwohl streng histologische Kriterien für bestimmte Tumoren informativ sind, wurden zunehmend Bedenken hinsichtlich des subjektiven Einflusses der Neuropathologen auf die histo-pathologische Beurteilung laut. Ein klassisches Beispiel war die geringe Interobserver-Konkordanz bei der Diagnose von diffusen Gliomen mit überlappenden astrozytären und oligodendroglialen Merkmalen. Nach dem Aufkommen der standardmässigen Suche nach IDH 1/2 Mutationen und einer Ko-Deletion von 1p19q im Falle einer IDH Mutation, fielen jedoch die meisten diffusen Gliome in die Kategorien Astrozytom oder Oligodendrogliom, wodurch die mehrdeutige Bezeichnung Oligoastrozytom weitgehend obsolet wurde. Im letzten Jahrzehnt hat die umfassende molekulare Hochdurchsatz-Profilierung in Verbindung mit Fortschritten beim maschinellen Lernen die Diagnose von Hirntumoren weiter verändert, indem sie eine genauere Orientierung der Ursprungszellen eines Tumors erlauben und Hinweise auf das Therapieansprechen liefern. Zum ersten Mal wurden molekulare Parameter mit histologischen Merkmalen in einem komplementären, integrativen Format zusammengeführt, wodurch die WHO-Klassifikation einer zunehmenden Anzahl von primären Hirntumoren verfeinert wurde (1).
Angesichts des rasanten Fortschritts im molekular-genetischen Verständnis, ist es nicht verwunderlich, dass die WHO Klassifikation 2016 zum Zeitpunkt der Veröffentlichung bereits veraltet war. Die fortlaufende Entdeckung von Biomarkern und neuer medikamentöser Targets verstärkte die Notwendigkeit, den Revisionsprozess zu beschleunigen. Deshalb wurde cIMPACT-NOW gegründet, um eine zeitnahe Aktualisierungen zu vermitteln und Empfehlungen für zukünftige WHO-Publikationen zu geben (2).
Bis heute hat das Konsortium 7 Positionspapiere veröffentlicht.
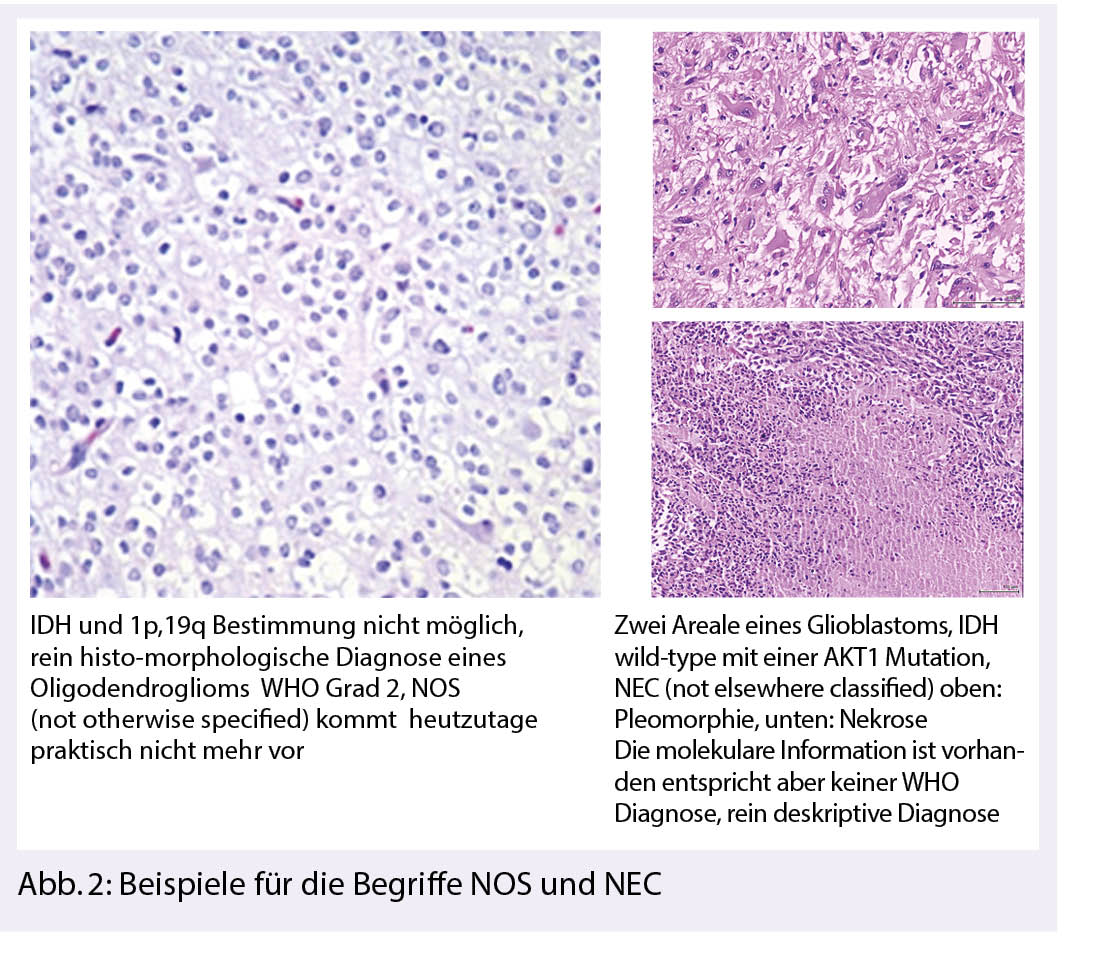
Das erste Update widmet sich der Klärung der Verwendung der Begriffe NOS (Not Otherwise Specified) und NEC (Not Elsewhere Classified). Die NOS-Bezeichnung sollte angewendet werden, wenn für die Diagnose dafür notwendige diagnostische (z. B. molekulare) Informationen für eine spezifischere Klassifizierung fehlen. Der NEC-Qualifikator kann angewendet werden, wenn eine Nichtübereinstimmung zwischen histologischen Merkmalen und molekularen Ergebnissen besteht. Alternativ kann NEC verwendet werden, wenn diagnostische Tests nicht-kanonische Ergebnisse zeigen, die eine Zuordnung zu einer bekannten WHO-Entität ausschliessen und daher auf einen neuen/entstehenden Tumortyp hindeuten (3) (Abb. 2).
Nach mehreren Fallberichten über H3K27-Mutationen bei so unterschiedlichen Tumoren wie Ependymomen der hinteren Schädelgrube (4), pilozytischen Astrozytomen und glioneuronalen Tumoren (5), entschied cIMPACT-NOW, dass hier eine Klärung angebracht ist. Daher wurde in einem zweiten Update empfohlen, den Begriff «diffuses Mittelliniengliom, H3K27m» und die dazugehörige WHO-Grad 4-Bezeichnung auf diffuse Mittelliniengliome zu beschränken und nicht auf andere Tumoren anzuwenden, die lediglich diese Mutation aufweisen. Die prognostische Bedeutung einer H3K27-Mutation in einer nicht-kanonischen Lokalisation oder Tumorentität ist noch unklar. In der gleichen Aktualisierung wurde die Diagnose des diffusen Astrozytoms, IDH-mutiert, durch die Einführung von Diagnosekriterien vereinfacht, welche eine molekulare LOH (loss of heterzygosity)-1p19q-Bestimmung nicht zwingend notwendig machen. Basierend auf immunhistochemischen Ergebnissen allein, können IDH-mutierte Gliome mit Nachweis eines Verlustes der nukleären ATRX-Expression und gleichzeitiger p53-Überexpression sicher den Astrozytomen zugeordnet und von Oligodendrogliomen abgegrenzt werden (6).
Nach dem dritten Update cIMPACT-NOW 3 können IDH-wild type Astrozytome der WHO-Grade 2 und 3 de facto als Glioblastome angesehen werden, wenn sie die folgenden molekularen Kriterien erfüllen: EGFR-Amplifikation und/oder Gewinn des gesamten Chromosoms 7 und Verlust des gesamten Chromosoms 10 (+7/-10) und/oder TERT (Telomerase reverse Transkriptase)-Promotor-Mutation.
Mit anderen Worten, zuverlässige molekulare Marker ermöglichen es, am Beispiel einer Biopsie die Diagnose eines Glioblastoms zu stellen, ohne dass die sonst notwendigen histologischen Kriterien, wie Nekrosen oder mikrovaskuläre Proliferation, vorhanden sein müssen (7).
Das vierte Update konzentriert sich auf Durchbrüche bei der Klassifizierung von IDH-, H3-Wildtyp, meist hemisphärische, pädiatrische diffuse Gliome. Es wurden sechs neue Gliom-Subtypen eingeführt, darunter diffuses Gliom, MYB-verändert, diffuses Gliom, MYBL1-verändert, diffuses Gliom, FGFR1 TKD-dupliziert, diffuses Gliom, FGFR1-mutiert, und diffuses Gliom, BRAFV600E-mutiert (ohne CDKN2A/2B-Deletion) sowie diffuses Gliom mit anderen MAPK-Signalweg-Veränderungen. Das Fazit dieses Updates war, dass diffuse Gliome im Kindesalter trotz histologischer Ähnlichkeiten zu Gliomen Erwachsener eindeutige molekulare Veränderungen aufweisen. Molekulare Tests sind für eine genaue Klassifizierung und die Identifizierung potenzieller therapeutischer Ziele unerlässlich (8).
In der fünften cIMPACT-NOW Publikation werden IDH-mutierte Astrozytome in einer eigenen Kategorie in WHO Grad 2-4 unterteilt. Sie haben generell einen weniger aggressiven klinischen Verlauf im Vergleich zu ihren Wildtyp-Pendants, mit Ausnahme der IDH-mutierten Astrozytome mit einer homogzygoten CDKN2A/B Deletion WHO Grad 4.
Anstelle von römischen Ziffern wurden arabische Ziffern für die Grade 2-4 vergeben, wobei Tumore des Grades 3 eine «signifikante» mitotische Aktivität aufweisen. Aufgrund der prognostischen Auswirkungen wird empfohlen, Astrozytome WHO Grad 2 und 3 auf homozygote CDKN2A/B-Deletionen zu testen. Tumoren mit homozygoten CDKN2A/B-Deletionen oder mikrovaskulärer Proliferation und/oder Nekrose sollen fortan als IDH-mutierte Astrozytome WHO Grad 4 und nicht mehr als Glioblastome bezeichnet werden (9).
Im sechsten Update werden allgemeine Prinzipien für die künftige Einteilung und Klassifizierung der hirneigenen Tumoren skizziert. So wird z. B. die Ersetzung von «Entität» und «Variante» durch «Typ» und «Subtyp» empfohlen. Vier weitere wichtige Empfehlungen werden in der WHO Klassifikation erscheinen: die erste Kategorie umfasst neu anerkannte Typen, Subtypen, Diagnosekriterien oder Tumorfamilien. Ein Beispiel ist das neu anerkannte diffuse Gliom, H3.3 G34-mutant mit einem insgesamt längeren Überleben im Vergleich zum klassischen IDH-Wildtyp-Glioblastom. Ein weiteres Beispiel ist das Astroblastom, MN1-alteriert (10). Zu den Nomenklaturänderungen (Kategorie 2), gehört der Wegfall der Lokalisation für das chordoide Gliom (ehemals «of the third ventricle»). Darüber hinaus sollen Ependymome kombinierte histologisch-molekulare Bezeichnungen tragen, die auf den einzigartigen epigenetischen und genetischen Signaturen an verschiedenen anatomischen Stellen beruhen. Die Kategorie der supratentoriellen Ependymome umfasst die klinisch aggressiven RELA-Fusion (C11orf95)-positiven und YAP1-Fusion-positiven Tumoren, die mit einer günstigeren Prognose assoziiert sind. Ependymome, die in der hinteren Schädelgrube entstehen, werden in den pädiatrischen Typ/PFA und den Erwachsenentyp/PFB unterteilt, wobei letzterer mit einer besseren Prognose assoziiert ist (10).
Einige bestehende Typen wie das extraventrikuläre Neurozytom und das pilozytische Astrozytom (Kategorie 3) werden keine Änderungen erfahren. Die vierte Kategorie umfasst Entitäten mit unzureichender Literatur, um eine Empfehlung auszusprechen. Beispiele sind pilozytäre Astrozytome mit anaplastischen Merkmalen, die durch ihr Methylierungsprofil definiert sind, und verschiedene infantile hemisphärische Gliome, die durch eine spezifische molekulare Signatur charakterisiert sind, z. B. Tyrosinrezeptor-Kinase-Fusionen wie NTRK, MET, ALK oder ROS1 (8).
cIMPACT-NOW 7 konzentriert sich erneut auf Fortschritte in der Klassifikation von Ependymomen, wobei die meisten Änderungen bereits im sechsten Update angedeutet wurden. Angesichts der häufigen Rezidive wurde das myxopapilläre Ependymom auf WHO-Grad 2 hochgestuft. Darüber hinaus wurde eine neue, klinisch aggressive, molekulare Untergruppe des spinalen Ependymoms, das MYCN-amplifizierte Ependymom, anerkannt (10, 11).
Jüngste Publikationen, die seit dem letzten cIMPACT-NOW Update erschienen sind, unterstreichen die unterschiedliche molekulare Landschaft von Hirntumoren bei Kindern. Bis heute wurden vier molekulare Subtypen des diffusen Mittellinienglioms mit H3.1/3.2 K27-, H3.3 K27-Mutationen, EZHIP-Überexpression und EGFR-Mutationen berichtet (13). Die meisten EGFR-mutierten Tumoren sind bithalamisch, während H3.1 K27-Mutationen die Pons bevorzugen (14). Der polymorphe niedriggradige neuroepitheliale Tumor (PLNTY) der Jugend ist ein neu anerkannter, Epilepsie-assoziierter Tumortyp mit MAPK-Veränderungen, der bei Kindern und jungen Erwachsenen gefunden wurde (15). Zwei weitere Entitäten, der diffuse glioneuronale Tumor mit oligodendroglialen Merkmalen und nukleären Clustern (DGONC) und der myxoide glioneuronale Tumor, haben sich der wachsenden Liste glioneuronaler und neuronaler Tumoren angeschlossen (16).
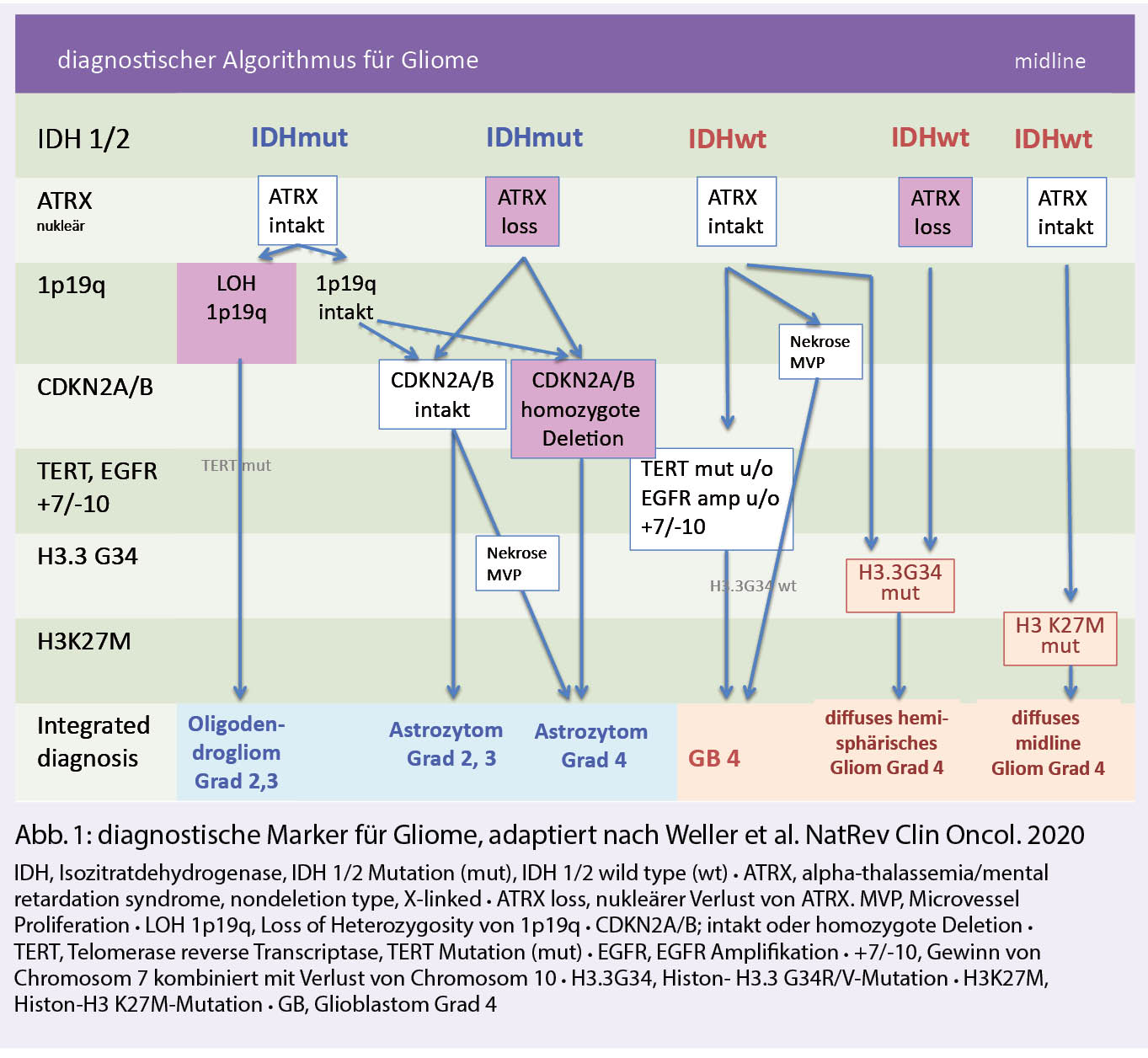
Zusätzlich zu den pädiatrischen Tumoren unterstreicht die Entdeckung aktionsfähiger Zielmoleküle in etwa einem Drittel der Gliome die Bedeutung eines optimalen Gewebemanagements, um der Herausforderungen der personalisierten Medizin zu begegnen. Vor dem Hintergrund begrenzter Gewebeverfügbarkeit besteht der Bedarf an einem optimalen Diagnosealgorithmus (Abb. 1), einschliesslich der Wahl der Analysemethoden sowie der Gewebeanalyse im Rahmen von Studien.
Patientenalter, histologische Diagnose und Tumorlokalisation sind wichtige Faktoren für die Auswahl geeigneter Nukleinsäuretests wie FISH, PCR, DNA- und RNA-Sequenzierung.
Next Generation Sequencing, (NGS) setzt sich als kosteneffiziente Methode zur gleichzeitigen Untersuchung mehrerer Gene durch.
Bei histologisch unklaren Tumoren ist das DNA-Methylom-Profiling ein weiteres Analyseverfahren, das den diagnostischen Prozess ergänzen kann. So lassen sich z. B. infantile hemisphärische Gliome, die histologisch vielfältig sind und eine Vielzahl von Genfusionen beherbergen, tendenziell einer eigenen Methylierungsklasse zuordnen (18). Noch sind nicht alle regulatorischen und methodologischen Fragen geklärt. Im Falle von NTRK-Fusionen z.B. hat sich das Methylierungsprofiling als nicht informativ erwiesen (19).
Zusammenfassend:
Nach den neuen Empfehlungen der cIMPACT-NOW kann bei einem Gliom der histologischen WHO-Grade 2 oder 3, das keine IDH-Mutation aufweist, ein Glioblastom diagnostiziert werden, wenn entweder eine EGFR-Amplifikation oder ein chromosomaler Gewinn auf Chromosom 7 bei komplettem Verlust von einem Chromosom 10 oder aber eine TERT (Telomerase reverse Transkriptase)-Promotor-Mutation vorliegt.
Astrozytäre Tumoren mit IDH-Mutation werden als Astrozytom, IDH-mutiert, WHO-Grad 2, 3 oder 4 klassifiziert. Der Verlust von CDKN2A wird als schlechter prognostischer Marker erkannt, der die Zuordnung zu einem WHO Grad 4 erlaubt.
Frühere IDH-mutierte Glioblastome gelten jetzt als Astrozytome, IDH-mutiert, WHO-Grad 4. Zu den IDH-mutierten Astrozytomen mit einer schlechteren Prognose gehören infratentorielle IDHmut Astrozytme, welche zudem non-IDH1-R132H Varianten aufweisen (21) und primär Mismatch-Repair defiziente IDHmut Astrozytome mit einem medianen Überleben von lediglich 15 Monaten (22).
Neue Kategorien sind auch die Histon-mutierten Gliome, hier speziell das Histon-3 K27M-mutierte diffuse Mittellinien-Gliom mit schlechter Prognose, und das Histon-3.3 G34-mutierte diffuse hemisphärische Gliom. Beide Gliome wurden früher überwiegend als Glioblastome diagnostiziert.
Ein ähnlicher Artikel zu diesem Thema wurde auf Anfrage an Prof. E. J. Rushing in der englischsprachigen Zeitschrift MEMO (Magazine of European Medical Oncology) eingereicht.
Copyright bei Aerzteverlag medinfo AG
Universitätsspital Zürich
Institut für Pathologie und Molekularpathologie
Schmelzbergstrasse 12
8091 Zürich
silvia.hofer@usz.ch
Institut für Neuropathologie
Universitätsspital Zürich
Frauenklinikstr. 38
8091 Zürich
Die Autorinnen haben im Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
◆ Die aktuelle Revision der WHO-Klassifikation von Tumoren des Zentralnervensystems 2021 führt entscheidende Veränderungen in der Diagnostik und Nomenklatur ein, mit Folgen auf die Art, wie wir Patienten mit Gliomen behandeln.
◆ Heute kann die Diagnose eines Glioblastoms nicht nur auf der Grundlage morphologischer Kriterien gestellt werden, sondern zweifelsfreier auf der Basis mehrerer molekularer Marker, was im Falle von kleinen Gewebeproben besonders hilfreich ist.
◆ Für viele der neu definierten Krankheitsentitäten in der neuesten WHO-Klassifikation sind noch keine Daten über spezifische Behandlungsergebnisse verfügbar; die Extrapolation aus Daten früherer klinischer Studien bleibt eine Herausforderung.
Messages à retenir
◆ La révision actuelle de la classification des tumeurs du système nerveux central 2021 de l’ OMS introduit des changements cruciaux dans le diagnostic et la nomenclature, avec des conséquences sur la façon dont nous traitons les patients atteints de gliomes.
◆ Aujourd’ hui, le diagnostic d’ un glioblastome peut être établi non seulement sur la base de critères morphologiques, mais aussi, de manière plus univoque, sur la base de multiples marqueurs moléculaires, ce qui est particulièrement utile dans le cas de petits échantillons de tissu.
◆ Pour de nombreuses entités pathologiques nouvellement définies dans la dernière classification de l’ OMS, les données sur les résultats de traitements spécifiques ne sont pas encore disponibles ; l’ extrapolation à partir de données provenant d’ essais cliniques antérieurs reste un défi.
1. Louis DN, Ohgaki H, Wiestler OD, Cavenee WK. International Agency for Research on Cancer, World Health Organization Histological Classification of Tumours of the Central Nervous System (Revised 4th edition). Lyon: 2016.
2. Louis DN, Aldape K, Brat DJ, et al. Announcing cIMPACT-NOW: the Consortium to Inform Molecular and Practical Approaches to CNS Tumor Taxonomy. Acta Neuropathol. 2017;133:1-3
3. Louis DN, Wesseling P, Paulus W, et al. cIMPACT-NOW update 1: Not Otherwise Specified (NOS) and Not Elsewhere Classified (NEC). Acta Neuropathol. 2018;135:481-484.
4. Gessi, Capper D, Sahm F, et al. Evidence of H3 K27M mutations in posterior fossa ependymomas. Acta Neuropathol .2016;132:635-7.
5. Orillac C, Thomas C, Dastagirzada, Y, el al. Pilocytic astrocytoma and glioneuronal tumor with histone H3 K27M mutation. Acta Neuropathol Commun. 2016;4:84
6. Louis DN, Giannini C, Capper D, et al. cIMPACT-NOW update 2: diagnostic clarifications for Diffuse Midline Glioma, H3 K27M–mutant and Diffuse Astrocytoma/Anaplastic Astrocytoma, IDH-mutant. Acta Neuropathol 135:639-642, 2018.
7. Brat DJ, Aldape K, Colman H, et al. cIMPACT-NOW update 3: recommended diagnostic criteria for “Diffuse astrocytic glioma, IDH-wildtype, with molecular features of glioblastoma, WHO grade IV”. Acta Neuropathol. 2018;136:805-810.
8. Ellison DW, Hawkins C, Jones DTW, et al. cIMPACT-NOW update 4: diffuse gliomas characterized by MYB, MYBL1, or FGFR1 alterations or BRAF V600E mutation. Acta Neuropathol. 2019;137:683-687.
9. Brat DJ, Aldape K, Colman H, et al. cIMPACT-NOW update 5: recommended grading criteria and terminologies for IDH-mutant astrocytomas Acta Neuropathol. 2020;139:603-608.
10. Louis DN, Wesseling P, Aldape K, et al. cIMPACT-NOW update 6: new entity and diagnostic principle recommendations of the cIMPACT-Utrecht meeting on future CNS tumor classification and grading. Brain Pathol. 2020;30:844-856.
11. Ghasemi DR, Sill M, Okonechnikov K, et al. MYCN amplification drives an aggressive form of spinal ependymoma. Acta Neuropathol. 2019;138:1075-1089.
12. Ellison DW, Aldape KD, Capper D, et al. cIMPACT-NOW update 7: advancing the molecular classification of ependymal tumors. Brain Pathol. 2020;30:863-866.
13. Cooney TM, Lubanszky E, Prasad R, et al. Diffuse midline glioma: review of epigenetics. J Neurooncol 2020. Online ahead of print.
14. Antony R, Solomon D, Lee-Way J, et al. HGG-12. Primary bithalamic glioma with EGFR mutation: A rare case report. Neuro Oncol. 2018; 20(Suppl 2): i91.
15. Huse JT, Snuderl M, Jones DTW, et al. Polymorphous low-grade neuroepithelial tumor of the young (PLNTY): an epileptogenic neoplasm with oligodendroglioma-like components, aberrant CD34 expression, and genetic alterations involving the MAP kinase pathway. Acta Neuropathol 2017;133:417-429.
16. Deng MY, Sill M, Sturm D, et al. Diffuse glioneuronal tumour with oligodendroglioma-like features and nuclear clusters (DGONC) – a molecularly defined glioneuronal CNS tumour class displaying recurrent monosomy 14. Neuropathol Appl Neurobiol. 2020;46:422-430.
17. Jonsson P, Lin AL, Young RJ, et al. Genomic Correlates of Disease Progression and Treatment Response in Prospectively Characterized Gliomas. Clin Cancer Res. 2019;25: 5537–5547
18. Capper D, Stichel D, Sahm F, et al. Practical implementation of DNA methylation and copy-number-based CNS tumor diagnostics: the Heidelberg experience. Acta Neuropathol. 2018;136:181-210.
19. Torre, M, Vasudevarja V, Serrano J, et al. Molecular and clinicopathologic features of gliomas harboring NTRK fusions. Acta Neuropathol Commun. 2020;8:107
20. Weller M, van den Bent M, Preusser M, et al. EANO guidelines on the diagnosis and treatment of diffuse gliomas of adulthood. Nat Rev Clin Oncol. doi: 10.1038/s41571-020-00447-z.
21. Banan R, Stichel D, Beck A, et al. Infratentorial IDH-mutant astrocytoma is a distinct subtype. Acta Neuropathol. 2020; 140: 569–581
22. Suwala A, Stichel D, Schrimpf D et al. Primary mismatch repair deficient IDH-mutant astrocytoma (PMMRDIA) is a distinct type with a poor prognosis. Acta Neuropathol 2021; 141:85-100
info@onco-suisse
- Vol. 11
- Ausgabe 3
- Juni 2021