- PARP-Inhibitoren auf dem Vormarsch
Die PARP-Inhibitoren sind auf einem raschen Vormarsch bei all den Malignomen, bei denen die DNA-Reparatur genetisch gestört ist. Das seröse, wenig differenzierte Ovarialkarzinom hat genau diese Voraussetzungen vorab bei den BRCA-mutierten Patientinnen, aber nicht nur. Die Erhaltungstherapie nach einer erfolgreichen platinhaltigen Ersttherapie ist nun für Lynparza® (Olaparib) mit einer sehr eindrücklichen Reduktion des Rezidivrisikos von 70% nach 41 Monaten Follow-up dokumentiert und weist den Weg zu einer wertvollen Prognoseverbesserung, wie wir sie bisher nicht kannten. Patientinnen mit einem FIGO III und IV serösen high grade-Karzinom des Ovars haben bis anhin eine sehr unbefriedigende Prognose und die 5-Jahres Überlebensrate ist nur ca. 20% für FIGO III bzw. 5% für FIGO IV.
Les inhibiteurs PARP progressent rapidement dans toutes les tumeurs malignes où la réparation de l’ADN est génétiquement perturbée. Le carcinome de l’ovaire grave et indifférencié montre exactement ces conditions préalables chez les patientes mutées par le gène BRCA, mais pas seulement. Le traitement d’entretien de Lynparza® (Olaparib) après une première thérapie à base de platine est maintenant documenté avec une réduction très impressionnante du risque de récidive de 70% après 41 mois de suivi et ouvre la voie à une amélioration précieuse du pronostic, que nous ne savions pas encore. Les patientes atteintes d’un carcinome séreux de haut grade de l’ovaire de FIGO III et IV ont un pronostic très insatisfaisant et le taux de survie à 5 ans est seulement d’environ 20% pour FIGO III et 5% pour FIGO IV.
Ein therapeutischer Vorteil von 2 Jahren oder mehr verlängertem, progressionsfreiem Überleben ist für jede fortgeschrittene Tumorerkrankung ein aussergewöhnlich bedeutsamer Erfolg von hohem potentiellem klinischem Nutzen. Dies insbesondere, wenn diese Therapie in diesem Ausmass alternativlos ist, eine akzeptable Verträglichkeit aufweist und somit auch eine hohe Akzeptanz bei den Patientinnen erwarten lässt. Dies trifft in hohem Mass für die Erhaltungstherapie mit den PARP-Inhibitoren zu bei Patientinnen mit fortgeschrittenem, platin-sensitivem, rezidiviertem, high-grade serösem Ovarialkarzinom im Anschluss an eine platinhaltige Chemotherapie bei Vorliegen einer kompletten oder partiellen Remission. Dabei zeigen neuere Daten, dass nicht nur BRCA-mutierte seröse high-grade Formen von Ovarial-, Tuben- und Endometriumkarzinom-Patientinnen davon profitieren. Die am ESMO präsentierte SOLO1-Studie mit der Erhaltungstherapie mit Lynparza® (Olaparib) bei BRCA-mutierten Patientinnen mit FIGO III und IV high grade serösen Ovarial-,Tuben und Endometriumkarzinomen zeigt hier den Weg. War bisher für Patientinnen mit einem fortgeschrittenen serösen high-grade Ovarial-Tuben- oder Endometriumkarzinom die Weiterbehandlung nach einer Primärtherapie mit Carboplatin und Paclitaxel ohne Avastin und in der Folge einer Monotherapie mit Avastin (15 mg / kg Körpergewicht einmal alle 3 Wochen) eine Option von eher bescheidenem therapeutischem Nutzen von wenigen Monaten, so zeigt die Studie SOLO1 (NCT01844986) mit einer oralen Erhaltungstherapie mit Lynparza® (Olaparib) hier einen wesentlich bedeutsameren PFS-Vorteil und dies wird künftig für viele Patientinnen mit fortgeschrittenem Ovarialkarzinom die Situation verbessern und zu einem neuen Standard werden (1).
PARP-Inhibitoren
Heute sind bereits drei PARP-Inhibitoren auf dem Markt in den USA (Olaparib, Niraparib and Rucaparib). Mindestens zwei weitere, Talazoparib und Veliparib, sind in der klinischen Pipeline mit bisher positiven Resultaten und dürften bald die verbleibenden Indikations-Lücken anpeilen (2).
Lynparza® (Olaparib), der erste zugelassenen PARP-Inhibitor, ist ein starker Inhibitor der humanen Poly-(ADP-Ribose)-Polymerasen (PARP-1, PARP-2 und PARP-3) und hemmt als Monotherapie oder in Kombination mit Chemotherapie das Wachstum diverser Tumorzelllinien in vitro und das Tumorwachstum in vivo. PARP-Enzyme werden für die effiziente Reparatur von Einzelstrangbrüchen in der DNA benötigt. In normalen Zellen werden diese DNA-Doppelstrangbrüche über homologe Rekombinationsreparatur repariert, für welche unter anderem funktionsfähige BRCA1- und BRCA2-Proteine erforderlich sind. Ist die HRR defekt, z.B. durch pathogene Mutationen in BRCA1/2 oder anderen Genen im HRR Signalweg, spricht man von einer HRD (Homologous recombination deficiency). So können DNA-Doppelstrangbrüche nicht mehr über HRR repariert werden und die Zellen sterben ab (3).
SOLO1-Studie mit Lynparza® (Olaparib) als Erstlinien-Erhaltungstherapie
Diese wegweisende, internationale, auf mehreren Kontinenten durchgeführte grosse Studie wurde erstmals am ESMO 2018 präsentiert und die Publikation erfolgte bereits Ende 2018 im NEJM, obwohl die mediane Beobachtungsdauer mit 41 Monaten noch zu kurz war, um definitive Überlebensdaten zu dokumentieren (1). Es wurden in dieser randomisierten, Placebo-kontrollierten, doppelblinden Phase 3 SOLO1-Studie total 1084 Patientinnen gescreent und schliesslich 391 BRCA-mutierte Frauen mit Stadium FIGO III und IV, Ovarial-, Tuben- oder Endometriumkarzinom mit einer partiellen oder kompletten Remission nach einer platinhaltigen Primärtherapie in einer 2:1 Randomisierung mit oral Lynparza® (n: 260) oder Placebo (n:131) während 2 Jahren behandelt. Lynparza® war nicht Teil der kombinierten Primärtherapie. Die Dosis betrug 300mg Lynparza® 2 x täglich für 2 Jahre. Zu beachten ist, das Lynparza mindestens eine Stunde nach einer Mahlzeit eingenommen werden muss und danach sollte die Patientin möglichst 2 Stunden lang nichts essen. Der Nachweis der BRCA-Mutation erfolgte entweder durch eine zentral oder lokal durchgeführte Keimbahnuntersuchung anhand einer Blutprobe oder mittels Untersuchung einer Tumorgewebeprobe in einem lokalen Test. Der BRCA-Status aller Patientinnen wurde soweit möglich mithilfe des Myriad Integrated BRACAnalysis® Tests, des Myriad BRACAnalysis CDx® oder des FoundationOne CDxTM Clinical Trial Assay der Foundation Medicine überprüft.
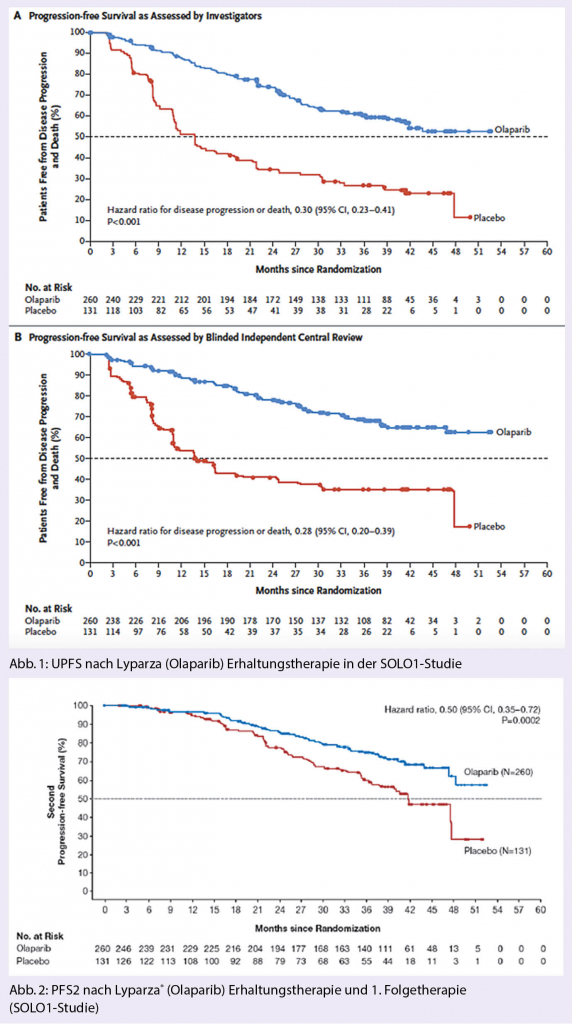
Der primäre Endpunkt war das vom Untersucher dokumentierte PFS gemessen ab Randomisierung. Die sekundären Endpunkte umfassten das PFS2 (Zeit ab Randomisierung bis zur 2. Progression), die Lebensqualität und das Gesamtüberleben. Die mediane Beobachtungszeit betrug 41 Monate. Beobachtet wurden die bereits bekannten bisher beobachteten Nebenwirkungen (≥ 10%) wie Übelkeit, Erbrechen, Diarrhö, Dyspepsie, Erschöpfung, Kopfschmerzen, Dysgeusie, verminderter Appetit, Schwindel. Die häufigsten Grade ≥ 3 Nebenwirkungen waren Anämie (22%) und Neutropenie (8%). Eine AML wurde bei 3 in der Verumgruppe und bei keiner Patientin der Placebogruppe dokumentiert. Langzeitresultate sind nun notwendig, um diese Beobachtung einordnen zu können. Die erhobenen Lebensqualitätsdaten zeigten keinen Unterschied in den beiden Behandlungsarmen.
In SOLO1 zeigte sich für Olaparib mit einer Hazard Ratio (HR) von 0,30 eine klinisch relevante und statistisch signifikante Verbesserung des vom Investigator beurteilten PFS gegenüber Placebo (95%-KI 0,23 – 0,41; p< 0,0001; median nicht erreicht für Olaparib versus 13,8 Monate für Placebo). Basierend auf der Kaplan-Meier-Berechnung betrug der Anteil der Patientinnen, die nach 12, 24 und 36 Monaten progressionsfrei waren, 88%, 74% bzw. 60% für Olaparib versus 51%, 35% bzw. 27% für Placebo.
Auch wurde eine klinisch bedeutende und statistisch signifikante Verbesserung des PFS2 mit einer HR von 0,50 (95%-KI 0,35–0,72; p = 0,0002; Median nicht erreicht für Lynparza® versus 41,9 Monate für Placebo) beobachtet, was darauf hinweist, dass der beobachtete Vorteil der Erhaltungstherapie mit Lynparza® auch bei der nachfolgenden Therapie anhielt.
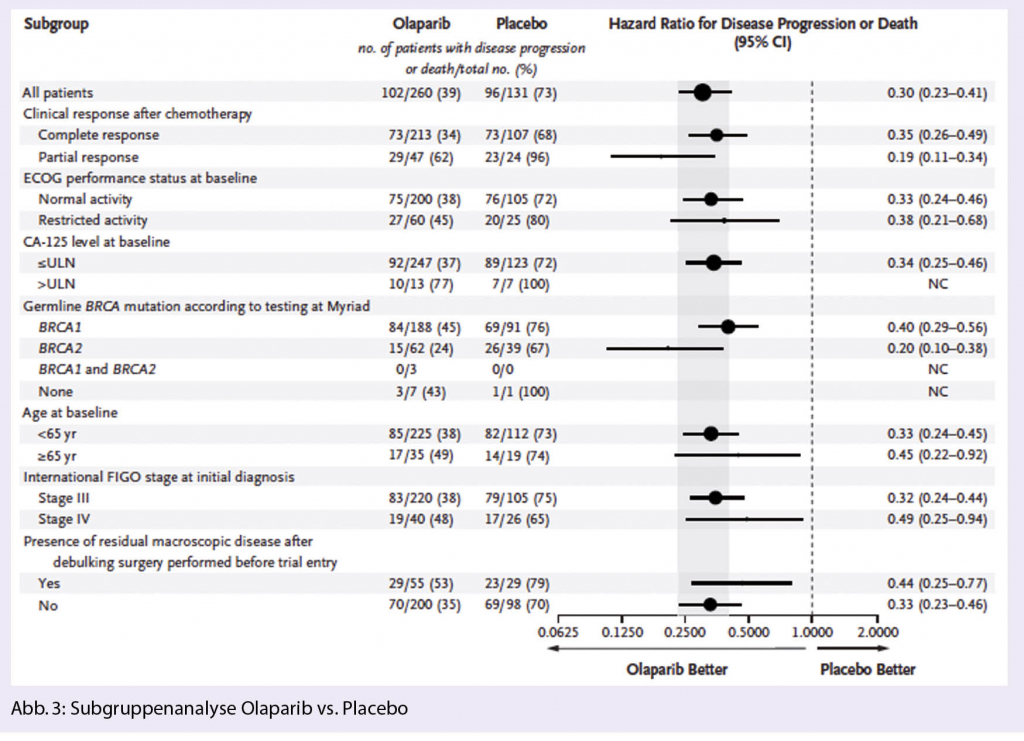
Zum Zeitpunkt der PFS-Analyse waren die Interimsdaten zum OS mit Ereignissen bei 82/391 (21%) Patientinnen noch unreif (HR 0,95; 95%-KI 0,60–1,53; Median OS nicht erreicht). Bei den mit Lynparza® behandelten Patientinnen wurde eine klinisch bedeutende und statistisch signifikante Verbesserung der TFST (time to first subsequent therapy or death) verzeichnet (HR 0,30; 95%- 0.30; 95% CI: 0.23 zu 0.41; P< 0.001). Im Dendrogramm zeigt sich zudem eindrücklich, dass auch in der Subgruppenanalyse alle bezüglich PFS deutlich profitiert haben:
In der Zwischenzeit wissen wir aber, dass auch Patientinnen ohne BRCA-Mutation von den PARP-Inhibitoren profitieren. Die Firmen AstraZeneca und MSD führen derzeit weitere Studien beim Ovarialkarzinom durch, einschliesslich der laufenden Phase-III-Studie PAOLA-1. Diese Studie untersucht die Erhaltungstherapie von Olaparib in Kombination mit Bevacizumab vs. Bevacizumab mit Placebo nach einer primär Platin-basierten Chemotherapie bei Patientinnen mit neu diagnostiziertem, fortgeschrittenem Ovarialkarzinom, unabhängig von ihrem BRCA-Status. Erste Ergebnisse sollten im zweiten Halbjahr 2019 erwartet werden.
Zejula® (Niraparib) ohne BRCA-Mutation zugelassen nach Vorbehandlung
Neben Lyparza mit der bereits vorliegenden, von Swissmedic zugelassenen Indikation (4). Zur Erhaltungstherapie (Mo-notherapie) bei Patientinnen mit fortgeschrittenem, rezidivierten Ovarialkarzinom mit BRCA Mutation im Anschluss an eine platinhaltige Chemotherapie bei Vorliegen einer kompletten oder partiellen Remission.
ist in der Schweiz bei Patientinnen bei platinsensitivem, vorbehandelten Ovarialkarzi-nom Zejula® (Niraparib) als Erhaltungstherapie ebenfalls wie folgt zugelassen: Zejula® (Niraparib) ist indiziert für die Erhaltungstherapie erwachsener Patientinnen mit einem Platin-sensitiven, rezidivierenden primären epithelialen serösen high-grade (hochgradig entdifferenzierten) Ovarial-, Tuben- oder Peritonealkarzinom. Die Patientin muss vollständig oder teilweise auf eine Platin-basierte Chemotherapie angesprochen haben.
Anwendung
Die Behandlung mit Zejula® muss durch einen in der Anwendung antineoplastischer Medikamente erfahrenen Arzt eingeleitet und überwacht werden.
Dosierung
Die Anfangsdosis von Zejula® beträgt zwei Kapseln zu 100 mg einmal täglich, entsprechend einer täglichen Gesamtdosis von 200 mg.
Die BRCA-Mutation ist hier also keine Voraussetzung!
Die noch laufende randomisierte, Placebo-kontrollierte, doppelblinde Phase-III-Studie ENGOT-OV26/PRIMA untersucht die Erhaltungstherapie mit Zejula® (Niraparib) nun in der Erstlinientherapie, nämlich bei Frauen mit fortgeschrittenem Ovarialkarzinom (FIGO-Stadium III oder IV), die auf die Platin-basierte Erstlinien-Chemotherapie mit einer partiellen oder kompletten Remission angesprochen haben. Sie erhalten, analog der SOLO1-Studie mit Lynparza® in einer 2:1 Randomisierung täglich 300 mg Niraparib als Dauertherapie in 28-tägigen Zyklen oder Placebo. Alle Patientinnen werden auf eine Homologe Rekombinationsdefizienz (HRD) des Tumors getestet. Primärer Endpunkt ist das PFS bei HRD-positiven Patientinnen.
Zusammenfassend
haben wir nun sowohl in der Erstlinien wie auch in der Folgetherapie bei platinsensitiven Patientinnen mit Rezidiv bei einem high-grade Ovarial-Tuben- oder Endometriumkarzinom eine wichtige Behandlungsoption mehr mit einer Erhaltungstherapie mit einem PARP-Inhibitor, welche das Potential hat, die Prognose dieser Patientinnen in einem bedeutsamen Ausmass zu verbessern. Kombinationen mit neueren Angiogeneseinhibitoren wie Cediranib oder der Einsatz von Checkpointinhibitoren in dieser Situation sind weitere spannende Herausforderungen.
Rosengartenstrasse 1d
9000 St. Gallen
thomas.cerny@kssg.ch
Der Autor hat keine Interessenskonflikte im Zusammenhang mit diesem Beitrag deklariert.
- PARP-Inhibitoren sind als Erhaltungstherapie bei Patientinnen mit serösem high-grade Karzinom des Ovars, der Tuben und des Endometriums eindrücklich wirksam.
- Die Wirksamkeit ist sowohl in der Ersttherapie wie bei platinsensitivem Rezidiv eindrücklich.
- Die Wirksamkeit beschränkt sich nicht nur auf BRCA-mutierte Patientinnen, sondern auf alle Patientinnen mit highgrade-serösem, gynäkologischen Karzinom.
- Seit der Entdeckung der Platine und Taxane ist dies die wichtigste therapeutische Errungenschaft für diese Patientinnen.
Messages à retenir
- Les inhibiteurs PARP sont d’ une efficacité impressionnante comme
traitement d’entretien chez les patientes atteintes d’ un carcinome séreux de haut grade de l’ovaire, des trompes et de l’ endomètre. - L’ efficacité est impressionnante aussi bien dans le traitement de
première intention que dans les rechutes sensibles au platine. - L’ efficacité ne se limite pas aux patientes ayant subi une mutation du gène BRCA, mais à toutes les patientes atteintes d’un carcinome
gynécologique séreux de haut grade. - Depuis la découverte du platine et des taxanes, il s’ agit de l’ accomplissement thérapeutique le plus important pour ces patients.
1. Moore K, et al. Maintenance Olaparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. NEJM 2018
2. Mirza MR et al, Latest clinical evidence and further development of PARP inhibitors in ovarian cancer. Ann Oncol 2018
3. Spriggs DR and Longo DL. PARP Inhibitors in Ovarian Cancer Treatment. Editorial. NEJM 2016
4. Mirza MR et al. Niraparib maintenance therapy in platinum-sensitive, recurrent ovarian cancer. NEJM 2016
info@onco-suisse
- Vol. 9
- Ausgabe 2
- April 2019