- Rückblick und Highlights in der Hämatologie
In der Hämatologie erleben wir äusserst spannende Zeiten mit grossem Erkenntnisgewinn aber auch Fortschritten in der Behandlung benigner und maligner Erkrankungen des Blutsystems. Diese Zusammenfassung ist z.T. subjektiv gefärbt und in der erlaubten Kürze sicher nicht vollständig. Ebenso liegt es in der Natur der Sache, dass nicht alles was hier besprochen wird, sich auch langfristig durchsetzen wird.
Sichelzellanämie
Die Sichelzellanämie ist eine schwere, angeborene vaso-okkludierende Erkrankung, welche in unseren Breiten wegen der Migration zunehmend an Bedeutung gewinnt. Die Bedeutung dieser Krankheit ist weltweit immens, bei uns ist sie selten, wo Malaria auftritt, wegen dadurch bedingtem Selektionsdruck, häufig. Zunehmend sind nun die Notfallstationen mit den Problemen der Schmerzkrisen und dem sog. acute chest syndrom sowie die Hämatologien mit dem Langzeitmanagement dieser Patienten konfrontiert. Seit der Einführung von Hydroxyurea in den 90er Jahren und L-Glutamin (1) in den USA 2017, beides formell in der CH nicht zugelassen bzw. nicht für diese Indikation registriert, sind nun neue interessante Entwicklungen hinzugekommen. L-Glutamin in pharmakologischen (sehr teuren) Dosen vermindert oxidativen Stress in den Erythrozyten und dadurch die Häufigkeit schmerzhafter Krisen. Crizanlizumab ist ein monoklonaler anti-P Selektin Antikörper (wird alle 4 Wochen i.v. infundiert), er blockiert das Adhäsionsmolekül P Selektin an Endothelien und Thrombozyten und reduzierte in einer randomisierten Studie die Zahl der Schmerzkrisen (2). Crizanlizumab ist letztes Jahr von der FDA zugelassen worden. Voxelotor, eine oral täglich einzunehmende Substanz, stabilisiert oxygeniertes Hämoglobin und reduziert dadurch die Polymerisierung von Hämoglobin und somit die Sichelzellbildung. In einer grossen randomisierten Studie erhöht sich unter Voxeletor (FDA Zulassung 2019) im Vergleich zu Placebo das Hämoglobin von Sichelzellpatienten (3). Nach Jahren ohne Fortschritte, in denen nur supportive Massnahmen wie Transfusionssupport oder Blutaustausch (zur Verdünnung des Sichelzellhämoglobins), Hydroxyurea und für eine kleine Minderheit mit sehr schwerem Verlauf, die allogene Stammzelltransplantation zur Verfügung standen, gibt es nun neue Substanzen, deren bestmöglicher Einsatz, möglicherweise in Kombination, untersucht werden muss, um die schweren vasookklusionsbedingten Organtoxizitäten und den frühen Tod dieser Patienten zu verhindern. Mittelfristig sind auch mit Spannung die Langzeitresultate verschiedener Gentherapien zu erwarten. Diesbezüglich gibt es verschiedenste Ansätze, wie man den Krankheitsverlauf beeinflussen könnte.
Hämophilie
Im Bereich der Hämostasiologie sind die Fortschritte auf dem Gebiet der Hämophiliebehandlung bemerkenswert. In den letzten Jahren haben sich zunehmend Faktoren VIII und IX mit verlängerter Halbwertszeit durchgesetzt, welche vor allem in der prophylaktischen Situation eine weniger häufige Infusion benötigen. Diese Strategie ist beim Faktor IX erfolgreicher als bei FVIII. FVIII ist ein viel grösseres Molekül und benötigt das von Willebrand Protein als Transportvehikel und als Schutz vor Degradation. Demzufolge ist die Verlängerung der Halbwertszeit des Faktors VIII über die des von Willebrand Faktors hinaus schwieriger umzusetzen. Jedoch werden aktuell weiter veränderte FVIII-Moleküle, die dies durchbrechen mögen, aktiv geprüft. Emicizumab ist ein subkutan zu verabreichender bispezifischer monoklonaler Antikörper der an Faktor IXa und Faktor X bindet und somit FVIII überbrückt (4). Hier sei eine Arbeit zitiert, welche zeigt, dass unter wöchentlicher oder zweiwöchentlicher s.c. Applikation, die Blutungsrate im Vergleich zu Plazebo auf einen Drittel gesenkt werden konnte. Eine rezente Publikation beschreibt die Fortsetzung der Erfolge der Gentherapie bei der Hämophilie A (5). Gentherapie bei Hämophilie A ist komplizierter als bei Hämophilie B wegen der Grösse des Gens und der Verpackungskapazität der verwendeten viralen Vektoren (Adeno-assoziierte Viren). Anders als bei den Malignomen (siehe unten, CAR-T) werden hier keine Retroviren verwendet. Die hier besprochene Arbeit zeigt bei 15 Patienten langdauernde (2-3 Jahre) Expression von Faktor VIII, im tiefen Bereich. Patienten mit schwerer Hämophilie A werden dadurch zu Patienten mit milder Hämophilie, eine gewichtige Verbesserung der Sicherheit und Lebensqualität. Viele Patienten machen eine Adenovirus Hepatitis durch, welche mit Kortikoiden kontrolliert werden kann. Interessante Entwicklungen bei der Hämophilie B (FIX) ist die Gentherapie mit einer über-funktionierenden Variante des Faktors IX (FIX-Padua), dadurch wird die FIX Funktion trotz tieferer Expression annähernd normalisiert (6). Die Fortschritte im Bereich der Hämophiliebehandlung verlaufen rasant von Faktoren aus Plasma gereinigt, über gentechnisch hergestellte Faktoren, zu Faktoren mit verlängerter Halbwertszeit und Non-Faktor Strategien bis zur Gentherapie. Bis anhin sind die Zahlen der mit Gentherapie behandelter Patienten gering, es scheint aber, dass dies die Zukunft für viele schwere Hämophilie Patienten sein kann.
Zelluläre Therapien; CAR-T
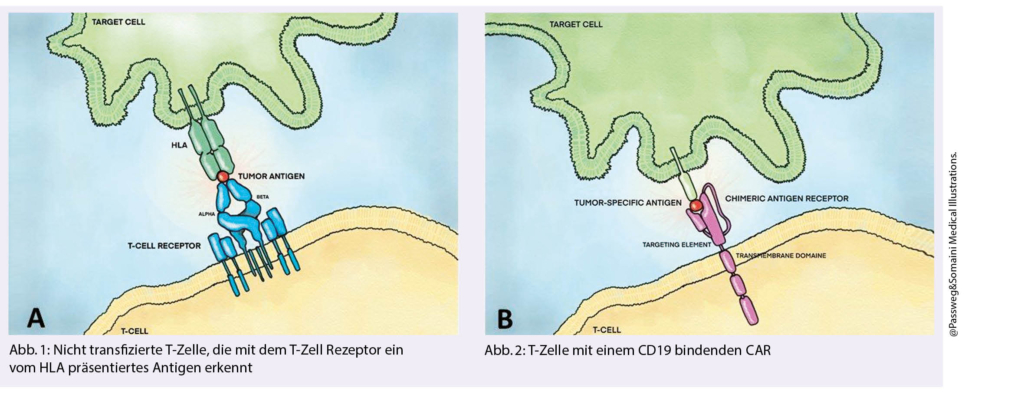
Auf dem Gebiet der malignen Hämatologie sind sicher die zellulären Therapien aufsehenerregend. Die Anwendung von chimären Antigenrezeptor genmodifizierten T-Zellen sind 2019 in der Schweiz eingeführt und eine Zahl von Patienten mit diffus grosszelligem B-Zell-Lymphom (DLBCL) und mit ALL sind behandelt worden. In den USA und China sind weit grössere Zahlen von Patienten so therapiert, mehrere Registerstudien haben Daten zu Hunderten von Patienten mit DLBCL und ALL präsentiert, welche die Eindrücke der Phase 2 Studien betreffend Wirksamkeit und Toxizität grossenteils bestätigen; erste Guidelines sind publiziert (7). Zugelassen sind die Produkte CD19 spezifische CAR-T bei rezidivierten/refraktären grosszelligen Lymphomen (inkl. primär mediastinalem) und bei der akuten lymphatischen Leukämie des jungen Patienten (< 25 Jahre). Die Abbildung (Abb. 1) zeigt eine T-Zelle mit einem CD19 bindenden CAR (B), und gegenüber eine nicht transfizierte T-Zelle, die mit dem T-Zell Rezeptor ein vom HLA präsentiertes Antigen erkennt (A). Interessant sind die Anwendungen in weiteren Lymphomentitäten, z.B. Follikuläres Lymphom (8) oder Mantelzell Lymphom. CD19 wird ja auf allen B-Lymphozyten exprimiert ausser auf den terminal differenzierten Plasmazellen. Eine unübersichtliche Fülle an neuen Entwicklungen wird präsentiert, hier als Beispiel die kombinierte Anwendung von CD19 und CD22 CAR-T bei Lymphomen und der ALL (9). Diese Strategie soll es den Tumorzellen erschweren, Rückfälle unter Downregulierung der Antigenexpression (sog. antigen escape) zu verursachen. Ob diese Strategie erfolgreich sein wird, werden erst vergleichende Studien zeigen können. Hierzu ein interessantes tierexperimentelles Abstract vom ASH 2019 (10) bei Myelom CAR-T mit einer dualen Strategie gegen BCMA (B-cell maturation Antigen) und GPRC5D: Die Wahl der Antigene soll hier keine Rolle spielen; sondern vielmehr die Beobachtung, dass eine Mischung von 2 CAR-T, die je ein Antigen adressieren (CAR-Pool) oder die Expression der 2 CAR, separat in der gleichen Zelle, oder die Expression eines Doppel-CARs mit unterschiedlicher Verknüpfung nicht identische Resultate ergeben sondern im Tierversuch mit einem Myelommodell sehr unterschiedliche Überlebensdaten liefern. CAR-T gegen BCMA bei Myelompatienten werden wahrscheinlich als nächstes in die Klinik eingeführt. Nicht zu vergessen zu diesem Zeitpunkt: bisher sind erst Phase II Studien zu CAR-T publiziert, keine Studien, die CAR-T mit anderen Behandlungsstrategien vergleichen (insbesondere ein Direktvergleich mit einer autologen Transplantation). Dies wird nachgeholt werden. Da die CAR-T Therapien erhebliche Toxizitäten aufweisen (cytokine release Syndrom, ZNS Toxizitäten, Hämophagozytose Syndrom) und ihre Wirkung verlieren können, ist deren Überlegenheit gegen herkömmliche Therapien noch nicht bewiesen. Eine weitere Herausforderung sind die Kosten solcher innovativen Therapien.
Lymphome
Auf Seiten der Lymphome gehört sicher die Publikation der Echelon-2 Studie, welche die Wertigkeit von Brentuximab Vedotin bei CD30 exprimierenden T-Zell Lymphomen aufzeigte mit einem längeren PFS von 48 im Vergleich zu 21 Monaten (Brentuximab-CHP vs. CHOP) zu den wichtigen Ereignissen. Nach Jahren der Stagnation in der Behandlung der T-Zell Lymphome bei gleichzeitig spektakulären Fortschritten bei den B-Zell Lymphomen ist dies ein wichtiger Schritt vorwärts (11). Brentuximab ist ein Monomethylauristatin E, einem Mikrotubulus Hemmer konjugierter Antikörper, dieselbe Konjugation gibt es auch als Polatuzumab vedotin mit einem Anti CD79b Antikörper verknüpft. Hier sei eine Studie zitiert bei rezidivierten/refraktären DLBCL in der Polatuzumab, Bendamustin, Rituximab, der Kombination Bendamustin Rituximab in PFS aber auch Gesamtüberleben klar überlegen war (12).
Plasmazell Myelom
Auf dem Gebiet des Plasmazellmyeloms sind die Entwicklung von Zweit- und Drittgenerations Immunmodulatoren und Proteasominhibitoren sowie die Verwendung der monoklonalen Antikörper wichtig. Wie bei anderen niedrigmalignen B-Zell Neoplasien gilt für die Behandlungsindikation, dass zugewartet werden soll, solange die Krankheit asymptomatisch ist. Diese Haltung wird durch eine Studie herausgefordert (13), 182 Patienten mit asymptomatischem Myelom wurden mit Lenalidomid behandelt oder beobachtet. Das PFS war nach 3 Jahren 91% vs. 66%. Ob eine solche Studie zur Änderung der Paradigmen zur Behandlungsindikation führen wird, ist unklar, der Unterschied war vorwiegend durch die Untergruppe der «Hochrisiko» - Patienten mit asymptomatischem Myelom bedingt. Risiko ist hier definiert über Knochenmarks-Plasmazellinfiltration (>20%), Höhe des M Proteins (>20g/L), und Ratio der freien Leichtketten (betroffen/nicht betroffen) >20. D.h. bei der frühen Behandlung von asymptomatischem Myelom profitiert vor allem die Gruppe von Patienten, welche dem symptomatischen Myelom am nächsten ist. Beim symptomatischen Myelom sei die CASSIOPEIA Studie (14) welche die heute nicht mehr so übliche Dreierkombination VTD vs. VTD-Daratumumab in der Erstlinienbehandlung bei Patienten, die auch eine autologe Stammzelltransplantation erhielten, verglich. Die Kombination mit dem CD38 Antikörper erreichte eine komplette Remissionsrate von 64% vs. 44%. Das Risiko für Tod oder Krankheitsprogress war halbiert. Die Einordnung dieser Daten ist heute sicher noch schwierig. Wahrscheinlich werden in Zukunft monoklonale Antikörper Teil der Erstlinienbehandlung werden. Neue Substanzen werden in grossem Masse vorwiegend bei rezidivierten / refraktären Patienten getestet, hier als Beispiel Selinexor (15) ein nuklearer Exportin1 Blocker, der bei über 100 dreifach refraktären Patienten (Imide, Proteasominhibitoren, Antikörper), bei einem Viertel der Patienten zu einem mindesten partiellen Ansprechen geführt hat. Die Einordnung solcher Substanzen ist auf Grund der Datenlage natürlich schwierig.
Chronische Lymphatische Leukämie
Auch in der CLL überschlagen sich die Ereignisse, Bruton und andere Kinase Inhibitoren werden zunehmend in der ersten Behandlungs-Linie verwendet werden. Die E1912 Studie konnte erstmals einen Überlebensvorteil für Ibrutinib im Vergleich zu Chemoimmuntherapie (FCR) in der Erstlinientherapie zeigen (16). Ibrutinib kombiniert mit dem BCL2 Inhibitor Venetoxlax führt zu tiefen Remissionen. Die Bedeutung der Negativität für minimale Resterkrankung wird intensiv diskutiert. In einer Studie mit meist älteren Patienten mit Hochrisiko-CLL, > 90% mit: IGHV unmutiert, p53 Aberration oder Chromosom 11q Aberration erreicht die grosse Mehrheit eine komplette Remission und 61% eine komplette Remission ohne minimale Resterkrankung unter der Kombination von Ibrutinib und Venetoclax (17). Nun ist das noch keine Heilung, obwohl bei fast allen lymphoiden Neoplasien die Tiefe der Remission mit der Remissionsdauer korreliert. Die Untersuchung langfristiger Remissionen bei der CLL wird wegen der langen Dauer schwierig, die Studienendpunkte müssen diskutiert werden. Progressionsfreies Überleben, Zeit bis zur Zweitlinienbehandlung und möglicherweise die Tiefe der Remission werden verwendet, weil das Gesamtüberleben dekadenlange Beobachtungszeiten erfordert. In einer weiteren publizierten Studie aus dem letzten Jahr (18) wurde bei über 400 Patienten Venetoclax in Kombination mit dem anti CD20 Antikörper Obinotuzumab mit Chlorambucil + Obinotuzumab in der Erstlinienbehandlung verglichen mit einem PFS von 88% vs. 64% nach 2 Jahren.
Akute Leukämien
Bei der akuten lymphatischen Leukämie (ALL) wurden in einer eindrücklichen Studie mit über 200 Patienten unter 30 Jahren, mit rezidiverter B-ALL nach einer Induktionschemotherapie eine Randomisation durchgeführt für weitere Zyklen Chemotherapie oder der Dauerinfusion mit dem bispezifischen (CD3 / CD19) Antikörper Blinatumomab. Diese bispezifischen Antikörper sollen T-Zellen des Patienten an die lymphatischen Blasten binden und so immunotherapeutisch wirksam werden. Im Blinatumomab Arm konnten signifikant mehr Patienten anschliessend stammzell-transplantiert werden. Das Gesamtüberleben nach 2 Jahren war 79% vs. 59% im Blinatumomab vs. Standardtherapie Arm bei gleichzeitig geringerer Nebenwirkungsrate (19). Die meisten Entwicklungen bei der ALL gehen in Richtung erweiterter Immuntherapie oder zelluläre Therapien (siehe oben). Bei der akuten myeloischen Leukämie (AML) gibt es derart viele Entwicklungen, dass diese hier nicht alle besprochen werden können: dazu gehören, optimierte Verwendung von hypomethylierenden Substanzen, neue zielgerichtete Substanzen, IDH1 und IDH2 Antagonisten, FLT3 Hemmer und unspezifischere Therapien wie der bcl2 Inhibitor Venetoclax oder der Hedgehog Inhibitor Glasdegib. In einer Studie verbessert Decitabine Erhaltungstherapie nach Induktionschemotherapie versus keine Therapie das PFS und das Gesamtüberleben, wenn auch in relativ geringem Umfang (20). Noch interessanter, die Studie mit Erhaltungstherapie mit oralem Azacytidine, placebokontrolliert, mit einem medianen Überlebensvorteil von 25 vs. 15 Monaten (21) mit fast 500 randomisierten Patienten. Gezielte Therapien wie der IDH1 Antagonist Enasidenib wurden in einer Studie getestet mit einer kompletten Remissionsrate von 58% unter der Kombination Enasidenib + Azacytidine versus 12% mit Azazytidine alleine (22). Interessante Studien sind auch mit dem bcl2 Inhibitor Venetoclax unterwegs, z.T. in Kombination mit niedrig dosierter Chemotherapie oder in Kombination mit Standard Induktionstherapien bei jüngeren Patienten (23). Es laufen auch Studien mit Mehrfachkombinationen, von zielgerichteten Substanzen mit hypomethylierenden Medikamenten und z.B. dem bcl2 Inhibitor. Es konnte gezeigt werden, dass leukämische Blasten Resistenzen entwickeln z.B. gegen FLT3 Kinaseinhibitoren. Durch Mehrfachkombinationen können möglicherweise solche Resistenzbildungen unterdrückt werden. Zuletzt sei hier die Wiederauferstehung von Gentuzumab Ozogamicin (GO) vermeldet, einem konjugierten Anti-CD33 Antikörper, der bei Core Binding Factor (CBF) AML (d.h. den genetischen Aberrationen vom Typ (t8:21) und (inv16)) besonders wirksam zu sein scheint, mit einer deutlich verbesserten PFS nach FLAG-GO vs. der Kombinationschemotherapie FLAG-Idarubicin von 87% vs. 68% nach 5 Jahren (24). Die CBF AML haben eine starke CD33 Expression, was möglicherweise diese Daten erklärt. Zuvor war GO wegen vermeintlicher Unwirksamkeit vom Handel zurückgezogen worden, jetzt wird es wieder eingeführt.
In der vorgegebenen Kürze ist es leider nicht möglich, weitere Aspekte und wichtige Krankheitsbilder wie die myeloproliferativen Neoplasien, die myelodysplastischen Syndrome und weitere chronische Leukämien zu besprechen. Es soll dem Leser aber der Eindruck vermittelt werden, dass die Zahl der Neuerungen immens ist und dass die Registrierungen in der Schweiz mit der Entwicklung nicht unbedingt Schritt halten können. Nicht zu reden vom Einschluss in die Spezialitätenliste, welche ja erst die geregelte Vergütung dieser fortschrittlichen Therapiekonzepte ermöglichen wird.
Prof. Dr. med. Jakob R. Passweg
Prof. Dr. med. Dimitrios Tsakiris
PD Dr. med. Andreas Holbro
PD Dr. med. Dominik Heim
PD Dr. med. Jörg Halter
Klinik Hämatologie, Universitätsspital Basel
Spitalstrasse 21, 4031 Basel
Jakob.Passweg@usb.ch
Klinik für Hämatologie
Hämatologische Diagnostik Labormedizin
Universitätsspital Basel und Blutspendezentrum beider Basel SRK
Petersgraben 4
4031 Basel
1. Niihara Y, Miller ST, Kanter J, et al A Phase 3 Trial of l-Glutamine in Sickle Cell Disease. N Engl J Med. 2018 Jul 19;379(3):226-235
2. Ataga KI, Kutlar A, Kanter J, Crizanlizumab for the Prevention of Pain Crises in Sickle Cell Disease. N Engl J Med. 2017 Feb 2;376(5):429-439.
3. Vichinsky E, Hoppe CC, Ataga KI, et al. A Phase 3 Randomized Trial of Voxelotor in Sickle Cell Disease. N Engl J Med. 2019 Aug 8;381(6):509-519
4. Mahlangu J, Oldenburg J, Paz-Priel I et al. Emicizumab Prophylaxis in Patients Who Have Hemophilia A without Inhibitors. N Engl J Med. 2018 Aug 30;379(9):811-822
5. Pasi KJ, Rangarajan S, Mitchell N, et al. Multiyear Follow-up of AAV5-hFVIII-SQ Gene Therapy for Hemophilia A. N Engl J Med. 2020 Jan 2;382(1):29-40
6. George LA, Sullivan SK, Giermasz A, et al. Hemophilia B Gene Therapy with a High-Specific-Activity Factor IX Variant. N Engl J Med. 2017 Dec 7;377(23):2215-2227
7. Jain T, Bar M, Kansagra AJ, et al. Use of Chimeric Antigen Receptor T Cell Therapy in Clinical Practice for Relapsed/Refractory Aggressive B Cell Non-Hodgkin Lymphoma: An Expert Panel Opinion from the American Society for Transplantation and Cellular Therapy. Biol Blood Marrow Transplant. 2019 Dec;25(12):2305-2321.
8. Hirayama AV, Gauthier J, Hay KA, et al. High rate of durable complete remission in follicular lymphoma after CD19 CAR-T cell immunotherapy. Blood. 2019 Aug 15;134(7):636-640
9. Wang N, Hu X, Cao W, et al. Efficacy and safety of CAR19/22 T-cell cocktail therapy in patients with refractory/relapsed B-cell malignancies. Blood. 2020 Jan 2;135(1):17-27
10. Fernandez de Larrea C et al. Optimal Dual-Targeted CAR Construct Simultaneously Targeting Bcma and GPRC5D Prevents Bcma-Escape Driven Relapse in Multiple Myeloma. American Society of Hematology Abstracts 2019
11. Horwitz S, O’Connor OA, Pro B, Brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma (ECHELON-2): a global, double-blind, randomised, phase 3 trial.Lancet. 2019 Jan 19;393(10168):229-240.
12. Sehn LH, Herrera AF, Flowers CR et al. Polatuzumab Vedotin in Relapsed or Refractory Diffuse Large B-Cell Lymphoma. J Clin Oncol. 2019 Nov 6: [Epub ahead of print]
13. Lonial S, Jacobus S, Fonseca R, Randomized Trial of Lenalidomide Versus Observation in Smoldering Multiple Myeloma. J Clin Oncol. 2019 [Epub ahead of print]
14. Moreau P, Attal M, Hulin C, et al. Bortezomib, thalidomide, and dexamethasone with or without daratumumab before and after autologous stem-cell transplantation for newly diagnosed multiple myeloma (CASSIOPEIA): a randomised, open-label, phase 3 study. Lancet. 2019 Jul 6;394(10192):29-38.
15. Chari A, Vogl DT, Gavriatopoulou M et al. Oral Selinexor-Dexamethasone for Triple-Class Refractory Multiple Myeloma. N Engl J Med. 2019 Aug 22;381(8):727-738
16. Shanafelt TD, Wang XV, Kay NE, et al. Ibrutinib-rituximab or chemoimmunotherapy for chronic lymphocytic leukemia. N Engl J Med. 2019; 381(5):432-443.
17. Jain N, Keating M, Thompson P, et al. Ibrutinib and Venetoclax for First-Line Treatment of CLL. N Engl J Med. 2019 May 30;380(22):2095-2103
18. Fischer K, Al-Sawaf O, Bahlo J, et al. Venetoclax and Obinutuzumab in Patients with CLL and Coexisting Conditions. N Engl J Med. 2019 Jun 6;380(23):2225-2236
19. Brown PA et al. A Randomized Phase 3 Trial of Blinatumomab Vs. Chemotherapy As Post-Reinduction Therapy in High and Intermediate Risk (HR/IR) First Relapse of B-Acute Lymphoblastic Leukemia (B-ALL) in Children and Adolescents/Young Adults (AYAs) Demonstrates Superior Efficacy and Tolerability of Blinatumomab: A Report from Children’s Oncology Group Study AALL1331. American Society of Hematology 2019 abstracts
20. Foran JM et al. Maintenance Decitabine (DAC) Improves Disease-Free (DFS) and Overall Survival (OS) after Intensive Therapy for Acute Myeloid Leukemia (AML) in Older Adults, Particularly in FLT3-ITD-Negative Patients: ECOG-ACRIN (E-A) E2906 Randomized Study. American Society of Hematology 2019 abstracts
21. Wei A et al. The QUAZAR AML-001 Maintenance Trial: Results of a Phase III International, Randomized, Double-Blind, Placebo-Controlled Study of CC-486 (Oral Formulation of Azacitidine) in Patients with Acute Myeloid Leukemia (AML) in First Remission American Society of Hematology 2019 abstracts
22. diNardo CF et al. Enasidenib Plus Azacitidine Significantly Improves Complete Remission and Overall Response Compared with Azacitidine Alone in Patients with Newly Diagnosed Acute Myeloid Leukemia (AML) with Isocitrate Dehydrogenase 2 (IDH2) Mutations: Interim Phase II Results from an Ongoing, Randomized Study. American Society of Hematology 2019 abstracts
23. Aboudalle I et al. A Phase Ib/II Study of the BCL-2 Inhibitor Venetoclax in Combination with Standard Intensive AML Induction/Consolidation Therapy with FLAG-IDA in Patients with Newly Diagnosed or Relapsed/Refractory AML American Society of Hematology 2019 abstracts
24. Borthakur GM et al. Fludarabine, Cytarabine, G-CSF and Gemtuzumab Ozogamicin (FLAG-GO) Regimen Results in Better Molecular Response and Relapse-Free Survival in Core Binding Factor Acute Myeloid Leukemia Than FLAG and Idarubicin (FLAG-Ida) American Society of Hematology 2019 abstracts
info@onco-suisse
- Vol. 10
- Ausgabe 1
- Februar 2020