- State of the Art und Neues mit speziellem Fokus auf Radiotherapie
Die Radiotherapie spielt eine führende Rolle bei der Behandlung von Kopf-/Hals-Plattenepithelkarzinomen (HNSCC), stellt für viele Patient/-innen die einzige organerhaltende Behandlungsoption dar und bietet zudem eine Therapieoption für inoperable Tumoren (1, 2). In den letzten Jahrzehnten hat es viele neue Entwicklungen in der radioonkologischen Behandlung von HNSCC gegeben. In dieser Übersicht werden die aktuellsten Entwicklungen vorgestellt, mit dem Ziel, die onkologischen Ergebnisse, die Toxizität und die Lebensqualität zu verbessern.
Radiotherapy plays a leading role in the treatment of head and neck squamous cell carcinoma (HNSCC), is the only organ-preserving treatment option for many patients and also offers a treatment option for inoperable tumours (1, 2). There have been many new developments in the radio-oncological treatment of HNSCC in recent decades. In this review, the most recent developments are presented with the aim of improving oncological outcomes, toxicity and quality of life.
Key words: Radiotherapy, Chemotherapy, Immunotherapy, De-escalation
Kombinationstherapien zusammen mit Radiotherapie
Der Nutzen einer definitiven simultanen Radiochemotherapie wurde in einer grossen Metaanalyse hervorgehoben (3, 4). Darüber hinaus, hat sich in den letzten Jahren die Immuntherapie zunehmend als therapeutische Option für die Krebsbehandlung bewährt. Bei lokal fortgeschrittenen HNSCC war bereits bekannt, dass die Kombination von Radiotherapie und Cetuximab Vorteile gegenüber der alleinigen Radiotherapie hat (5), obwohl das in 3 prospektiv-randomisierten Studien der Standard-Kombination mit Cisplatin unterlegen war (6–8). Kürzlich zeigte die NRG/RTOG 0920 Studie, dass bei HNSCC der intermediären Risikogruppe nach vollständiger Resektion (R0), die postoperative Kombinationstherapie mit Radiotherapie und Cetuximab ein längeres PFS ermöglicht (9). Andererseits führte diese Behandlung zu signifikant mehr Toxizitäten (Grad ≥ 3): 70.3 % (Radiotherapie + Cetuximab) gegenüber 39.7 % (9). Damit bleibt die Rolle von Cetuximab in der kurativen HNSCC-Therapie begrenzt.
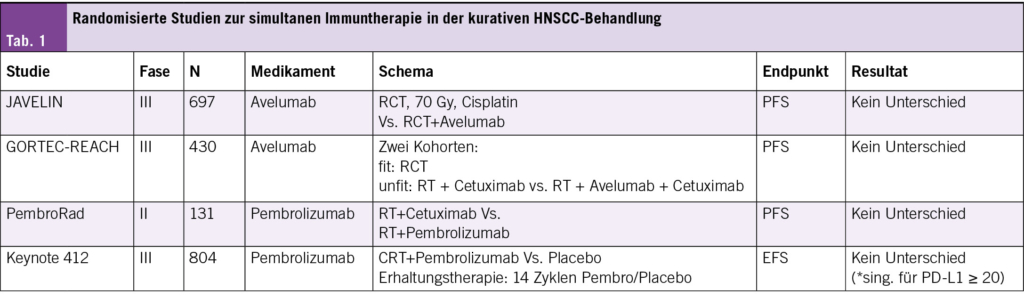
Die Immuncheckpoint-Inhibition mittels anti-PD1 oder anti-PD-L1 simultan zur Bestrahlung alleine oder als trippel-Kombination mit Chemotherapie ist gut verträglich, hat aber – zumindest für unselektierte Patienten – in mehreren randomisierten Studien überhaupt keinen Vorteil bzgl. onkologischem Outcome gezeigt (Tab. 1). Eine Schlüsselfrage bleibt der Zeitpunkt/die Reihenfolge der Therapie, d. h. Immuntherapie konkomitant oder sequentiell zur Radio(chemo)therapie (10). Randomisierte Phase-III-Studien, in denen Anti-PD-1/PD-L1 konkomitant mit einer definitiven Radiochemotherapie eingesetzt wurde, brachten keine signifikante Verbesserung der Ergebnisse im Vergleich zur alleinigen Radiochemotherapie (11, 12). Zandberg et al. stellten die Hypothese auf, dass sich das Tumormilieu während und nach der Therapie verändert und dass eine sequenzielle Behandlung mit anti-PD1 erfolgreich sein könnte (10). Nach einer Nachbeobachtungszeit von 4 Jahren hatten Hochrisikopatienten mit sequentieller Behandlung signifikant bessere onkologische Ergebnisse als bei konkomitanter Behandlung. Interessanterweise wurde in der Studie auch das Immunmikromilieu des Tumors analysiert, wobei signifikante Unterschiede zwischen den beiden Gruppen festgestellt wurden (10).
Xevinapant
Ein neu entwickeltes Medikament für die Kombination mit Radiochemotherapie ist Xevinapant, ein erstklassiger Antagonist von Apoptose-Inhibitor-Proteinen, der die Empfindlichkeit der Krebszellen gegenüber Chemo- und Radiotherapie erhöht (13, 14). Die ersten Phase II-Studien waren vielversprechend. Sun et al. zeigten in einer GORTEC Studie, dass sich die lokale Kontrolle mit Xevinapant von 33 % auf 54 % verbesserte. Die Kombination mit Xevinapant zeigte auch einen Vorteil für das progressionsfreie Überleben mit einer Hazard Ratio von 0.37 (15). Auch die mediane Überlebenszeit nach fünf Jahren verbesserte sich in dieser Phase-II-Studie bei den mit Xevinapant behandelten Patienten (16). Auf der Grundlage dieser Phase-II-Ergebnisse wurden zwei Phase-III-Studien eingeleitet: Trilynx und XrayVision (13, 14). Leider mussten diese beiden Studien aufgrund der deutlich negativ ausgefallenen ersten Zwischenanalyse der Trilynx-Studie abgebrochen werden.
Deeskalation der Behandlung in HPV-positiven Oropharynxkarzinomen (OPC)
Die Deeskalation der Behandlung bei HPV-positiven OPC ist derzeit ein wichtiges Thema. Eine Idee für die Deeskalation würde auf Stratifizierung basierend auf dem Ausmass der Tumor-Hypoxie basieren, wobei Hypoxie zu Radioresistenz führt und einen negativen prognostischen Marker darstellt (17, 18). In der Studie von Lee et al. wurde ein FMISO-PET-Scan durchgeführt, um residuelle Hypoxie nach 20 Gy und einem Zyklus Cisplatin zu erkennen. Fällt der FMISO-PET-Scan positiv aus (Hypoxie vorhanden), erhalten die Patienten insgesamt die Standard-Therapie. Gab es keine Anzeichen von Hypoxie, wurde die Behandlung auf 30 Gy und 2 Zyklen Cisplatin reduziert. Die Rate der Lokalrezidive war bei einer medianen Nachbeobachtungszeit von 28 Monaten die gleiche (19). Derzeit läuft basierend auf diesen beeindruckenden Ergebnissen eine Phase III non-inferiority multizentrische Studie (19).
Hypofraktionierung in der kurativen Situation
Die Hypofraktionierung ist eine gute Behandlungsoption, insbesondere für Patienten mit langen Anfahrtswegen und Ländern mit reduzierten Ressourcen. Bei der HYPNO-Studie handelte es sich um eine randomisiert-kontrollierte Studie, in der die hypofraktionierte Radiotherapie mit der normofraktionierten akzelerierten Radiotherapie verglichen wurde. Die Patienten wurden mit 66 Gy in 33 Fraktionen, 6 Mal pro Woche, oder 55 Gy in 20 Fraktionen, 5 Mal pro Woche, behandelt. Die hypofraktionierte Behandlung ist der normal fraktionierten, akzelerierten Radiotherapie in Bezug auf Nebenwirkungen und Tumorkontrolle nicht unterlegen (20).
Protonen versus Photonen
Protonen werden schon zur HNSCC-Behandlung angewendet. Zur klinischen Orientierung wurden Modelle für die Wahrscheinlichkeit von Normalgewebskomplikationen (NTCP) entwickelt. Mit diesen Modellen lassen sich systematisch die Patienten ermitteln, die am meisten von einer Protonentherapie bezüglich Toxizität profitieren könnten (21). Die Effektivität wurde bis jetzt nie randomisiert mit moderner Photonen-Bestrahlung verglichen. Bei OPC zeigte neulich die erste Phase-III-Studie, dass die Behandlung mit Protonen im Vergleich zur Photonentherapie in Bezug auf das progressionsfreie Überleben nicht unterlegen war. Darüber hinaus zeigte die Protonentherapie bessere Ergebnisse in Bezug auf akute und subakute Toxizitäten wie Dysphagie und Gewichtsverlust (22). Eine weitere grosse Studie zu diesem Thema ist die TORPEdO Trial (23), die diese Frage endgültig beantworten wird.
Dysphagie-optimierte Radiotherapie
Dysphagie ist eine der führenden Nebenwirkungen der HNSCC-Radiotherapie. Insbesondere die Dysphagie als Spätfolge basiert auf eine Fibrosierung der Schluckmuskulatur (pharyngeale Konstriktoren). Nutting et al., zeigten zum ersten Mal in einem prospektiv-randomisierten Modus, dass die gezielte, durch moderne intensitäts-modulierte Radiotherapie mögliche Schonung der Konstriktoren ausserhalb des Hoch-Dosis-Bereichs zu objektiv wie subjektiv hoch-signifikanter Verbesserung der Schluckfunktion und der Lebensqualität führen kann (24). Diese neue Strategie stellt die neue Standardbehandlung dar.
Adaptive Radiotherapie
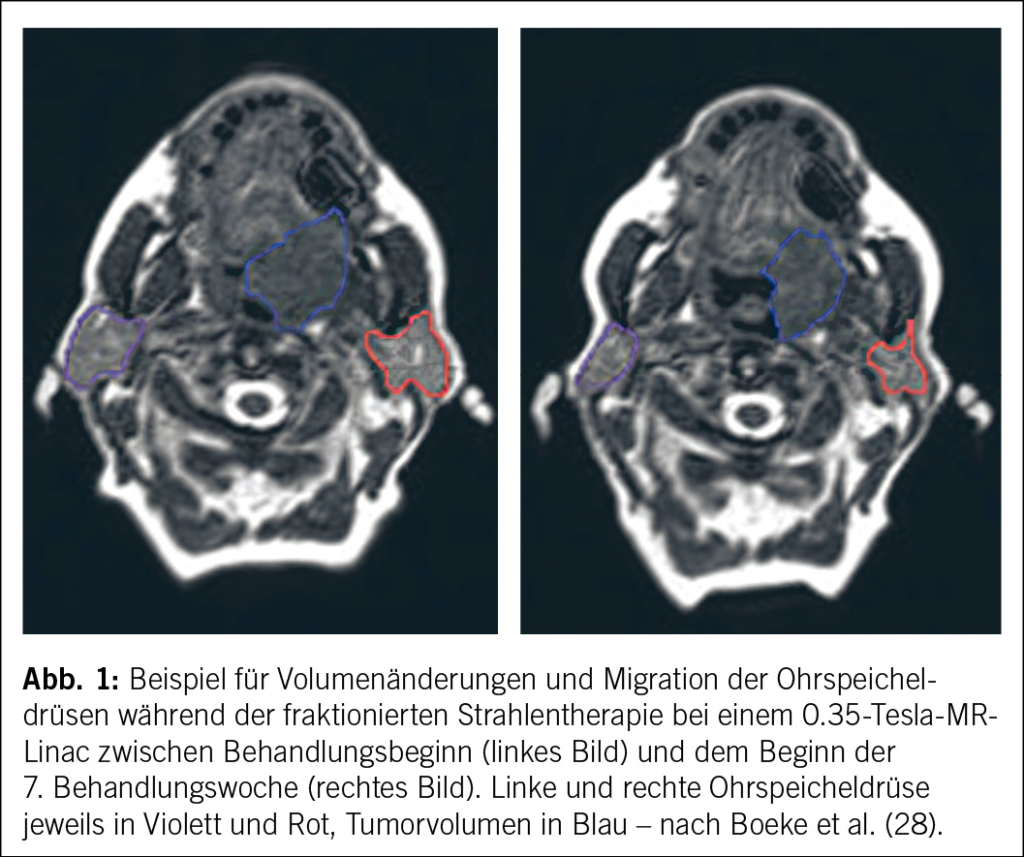
Bei der adaptiven Radiotherapie wird der Behandlungsplan anhand von bildgebenden Verfahren an patientenindividuellen Schwankungen, Organ- und Tumor-Veränderungen angepasst. In den letzten zwei Jahrzehnten wurde diese adaptive Therapie in grossem Umfang für die Radiotherapie von HNSCC eingesetzt, wobei die Schrumpfung des Tumors, der Gewichtsverlust und die Migration von Organen/Strukturen berücksichtigt werden (Abb. 1) (25). Heute wird die adaptive Radiotherapie häufig eingesetzt, um bedrohte Organe wie die Speicheldrüsen zu schonen (26). Allerdings bleibt der Umfang des klinischen Benefits unklar. Die erste randomisierte Studie, basierend auf wöchentliche CT-gestützte Adaptation zeigte keinen Vorteil bezogen auf den primären Endpunkt, nämlich Speichelfluss ein Jahr nach Radiatio (27). Auch die MR-gesteuerte adaptive Radiotherapie ist eine Technik, die zunehmend eingesetzt wird, mit den Vorteilen einer besseren Differenzierung der Weichteile, einer täglichen Anpassung des Plans und sogar einer «Live»-Überwachung der Strukturen ohne Strahlenbelastung (28).
Nasopharynxkarzinom
Das Nasopharynxkarzinom (NPC) ist eine in den westlichen Ländern seltene Erkrankung, kommt aber in Südostasien häufiger vor (29). Hier wurden im aktuellen ASCO-Kongress zwei bahnbrechende positive Studien präsentiert. Eine neueste Entwicklung in der Therapie ist der Zusatz von Endostar – einem Angiogenesehemmer (30). Die Idee dahinter ist, dass Endostar durch Normalisierung der Vaskularisierung die Hypoxie reduziert und damit die Radiosensibilisierung fördert. In der Intention-to-Treat-Population von Patienten mit NPC im Stadium III/IVB führte die Zugabe von Endostar zur Radiochemotherapie zu einer Verbesserung des progressionsfreien Überlebens (PFS) von 75.1 % auf 84.8 % und des OS nach 3 Jahren von 85.3 % auf 89.2 % (30). Klassische NPC sind stark immunisiert und lymphatisch infiltriert. Für lokal fortgeschrittenen NPC (Stadium III/IVA) wurde eine neue Phase III-Studie zur adjuvanten PD-1 Blockade mit Camrelizumab durchgeführt, in der die adjuvante Camrelizumab-Behandlung eine Verbesserung des ereignisfreien 3-Jahres-Überlebens (EFS) von 77.3 % auf 86.9 % zeigte (Hazard Ratio 0.56, p = 0.012) (31). Beide dieser Studien haben das Potential den heutigen Standard zu verändern, aber die optimale Strategie muss noch erforscht werden.
Copyright Aerzteverlag medinfo AG
Universitätsspital Zürich
Klinik für Radio-Onkologie
Kompetenzzentrum für Palliative Care
Interdisziplinäres Zentrum für Hochpräzisionstherapie
Rämistrasse 100
8091 Zürich
Universitätsspital Zürich
Klinik für Radio-Onkologie
Kompetenzzentrum für Palliative Care
Interdisziplinäres Zentrum für Hochpräzisionstherapie
Rämistrasse 100
8091 Zürich
Die Autorenschaft haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert
- Immuntherapie simultan zur Bestrahlung bringt keinen Vorteil in
der kurativen Behandlung der Kopf-Hals-Tumoren. Eine sequentielle Applikation erscheint mehr versprechend. - Phase-II-Trials mit Xevinapant zeigten vielversprechende Ergebnisse, aber zwei grosse Phase-III-Trials wurden gleich nach der ersten Interim-Analyse abgebrochen.
- Selektierte OPC-Patient/-innen mit erwarteter hoher Toxizität könnten von einer radioonkologischen Behandlung mit Protonen bezüglich Akuttoxizität profitieren.
- Hypofraktionierung ist eine valide Option, wenn eine Normofraktionierung aus logistischen Gründen problematisch ist.
- Die gezielte Schonung der Schluckmuskulatur ist möglich und führt zu signifikanter Verbesserung der Schluckfunktion und Lebensqualität.
- Endostar als Hypoxie-Sensitizer simultan und adjuvant zur Radiochemotherapie als auch anti-PD1 Immuntherapie verbessern das Überleben bei lokoregional fortgeschrittenem Nasopharynxkarzinom.
1. Machiels JP, René Leemans C, Golusinski W, Grau C, Licitra L, Gregoire V. Squamous cell carcinoma of the oral cavity, larynx, oropharynx and hypopharynx: EHNS-ESMO-ESTRO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2020;31(11):1462-75.
2. Aaltonen LM, Rautiainen N, Sellman J, Saarilahti K, Mäkitie A, Rihkanen H, et al. Voice quality after treatment of early vocal cord cancer: a randomized trial comparing laser surgery with radiation therapy. Int J Radiat Oncol Biol Phys. 2014;90(2):255-60.
3. Lacas B, Carmel A, Landais C, Wong SJ, Licitra L, Tobias JS, et al. Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): An update on 107 randomized trials and 19,805 patients, on behalf of MACH-NC Group. Radiother Oncol. 2021;156:281-93.
4. Pignon JP, le Maître A, Maillard E, Bourhis J. Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): an update on 93 randomised trials and 17,346 patients. Radiother Oncol. 2009;92(1):4-14.
5. Bonner JA, Harari PM, Giralt J, Cohen RB, Jones CU, Sur RK, et al. Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer: 5-year survival data from a phase 3 randomised trial, and relation between cetuximab-induced rash and survival. Lancet Oncol. 2010;11(1):21-8.
6. Gillison ML, Trotti AM, Harris J, Eisbruch A, Harari PM, Adelstein DJ, et al. Radiotherapy plus cetuximab or cisplatin in human papillomavirus-positive oropharyngeal cancer (NRG Oncology RTOG 1016): a randomised, multicentre, non-inferiority trial. Lancet. 2019;393(10166):40-50.
7. Mehanna H, Robinson M, Hartley A, Kong A, Foran B, Fulton-Lieuw T, et al. Radiotherapy plus cisplatin or cetuximab in low-risk human papillomavirus-positive oropharyngeal cancer (De-ESCALaTE HPV): an open-label randomised controlled phase 3 trial. Lancet. 2019;393(10166):51-60.
8. Rischin D, King M, Kenny L, Porceddu S, Wratten C, Macann A, et al. Randomized Trial of Radiation Therapy With Weekly Cisplatin or Cetuximab in Low-Risk HPV-Associated Oropharyngeal Cancer (TROG 12.01) – A Trans-Tasman Radiation Oncology Group Study. Int J Radiat Oncol Biol Phys. 2021;111(4):876-86.
9. Machtay M, Torres-Saavedra P, Thorstad WL, Nguyen-Tan PF, Siu LL, Holsinger FC, et al. Randomized Phase III Trial of Postoperative Radiotherapy with or without Cetuximab for Intermediate-Risk Squamous Cell Carcinoma of the Head and Neck (SCCHN): NRG/RTOG 0920. International Journal of Radiation Oncology*Biology*Physics. 2023;117(4):e1.
10. Zandberg DP, Clump DA, Isett BR, Bao R, Wang H, Vujanovic L, et al. A randomized phase II study of concurrent vs. sequential pembrolizumab with chemoradiation (CRT) in locally advanced head and neck cancer (LA HNSCC): 4-year results and tumor-immune microenvironment analysis. Ann Oncol. 2023;34:S554-S93.
11. Machiels JP, Tao Y, Licitra L, Burtness B, Tahara M, Rischin D, et al. Pembrolizumab plus concurrent chemoradiotherapy versus placebo plus concurrent chemoradiotherapy in patients with locally advanced squamous cell carcinoma of the head and neck (KEYNOTE-412): a randomised, double-blind, phase 3 trial. Lancet Oncol. 2024;25(5):572-87.
12. Lee NY, Ferris RL, Psyrri A, Haddad RI, Tahara M, Bourhis J, et al. Avelumab plus standard-of-care chemoradiotherapy versus chemoradiotherapy alone in patients with locally advanced squamous cell carcinoma of the head and neck: a randomised, double-blind, placebo-controlled, multicentre, phase 3 trial. Lancet Oncol. 2021;22(4):450-62.
13. Bourhis J, Burtness B, Licitra LF, Nutting C, Schoenfeld JD, Omar M, et al. Xevinapant or placebo plus chemoradiotherapy in locally advanced squamous cell carcinoma of the head and neck: TrilynX phase III study design. Future Oncol. 2022;18(14):1669-78.
14. Ferris RL, Mehanna H, Schoenfeld JD, Tahara M, Yom SS, Haddad R, et al. Xevinapant plus radiotherapy in resected, high-risk, cisplatin-ineligible LA SCCHN: the phase III XRay Vision study design. Future Oncol. 2024;20(12):739-48.
15. Sun XS, Tao Y, Le Tourneau C, Pointreau Y, Sire C, Kaminsky MC, et al. Debio 1143 and high-dose cisplatin chemoradiotherapy in high-risk locoregionally advanced squamous cell carcinoma of the head and neck: a double-blind, multicentre, randomised, phase 2 study. Lancet Oncol. 2020;21(9):1173-87.
16. Tao Y, Sun XS, Pointreau Y, Le Tourneau C, Sire C, Kaminsky MC, et al. Extended follow-up of a phase 2 trial of xevinapant plus chemoradiotherapy in high-risk locally advanced squamous cell carcinoma of the head and neck: a randomised clinical trial. Eur J Cancer. 2023;183:24-37.
17. Rajendran JG, Schwartz DL, O‘Sullivan J, Peterson LM, Ng P, Scharnhorst J, et al. Tumor hypoxia imaging with [F-18] fluoromisonidazole positron emission tomography in head and neck cancer. Clin Cancer Res. 2006;12(18):5435-41.
18. Zschaeck S, Löck S, Hofheinz F, Zips D, Saksø Mortensen L, Zöphel K, et al. Individual patient data meta-analysis of FMISO and FAZA hypoxia PET scans from head and neck cancer patients undergoing definitive radio-chemotherapy. Radiother Oncol. 2020;149:189-96.
19. Lee NY, Sherman EJ, Schöder H, Wray R, Boyle JO, Singh B, et al. Hypoxia-Directed Treatment of Human Papillomavirus–Related Oropharyngeal Carcinoma. Journal of Clinical Oncology. 2024;42(8):940-50.
20. Bentzen SM, Rosenblatt E, Gupta T, Agarwal JP, Laskar SG, Bhasker S, et al. Randomized Controlled Trial of Hypofractionated vs. Normo-fractionated Accelerated Radiation Therapy with or without Cisplatin for Locally Advanced Head and Neck Squamous Cell Carcinoma (HYPNO). International Journal of Radiation Oncology, Biology, Physics. 2023;117(4):e2.
21. Gan Y, Langendijk JA, van der Schaaf A, van den Bosch L, Oldehinkel E, Lin Z, et al. An efficient strategy to select head and neck cancer patients for adaptive radiotherapy. Radiother Oncol. 2023;186:109763.
22. Frank SJ, Busse P, Rosenthal DI, Hernandez M, Swanson DM, Garden AS, et al. Phase III randomized trial of intensity-modulated proton therapy (IMPT) versus intensity-modulated photon therapy (IMRT) for the treatment of head and neck oropharyngeal carcinoma (OPC). Journal of Clinical Oncology. 2024;42(16_suppl):6006-.
23. Price J, Hall E, West C, Thomson D. TORPEdO – A Phase III Trial of Intensity-modulated Proton Beam Therapy Versus Intensity-modulated Radiotherapy for Multi-toxicity Reduction in Oropharyngeal Cancer. Clin Oncol (R Coll Radiol). 2020;32(2):84-8.
24. Nutting C, Finneran L, Roe J, Sydenham MA, Beasley M, Bhide S, et al. Dysphagia-optimised intensity-modulated radiotherapy versus standard intensity-modulated radiotherapy in patients with head and neck cancer (DARS): a phase 3, multicentre, randomised, controlled trial. Lancet Oncol. 2023;24(8):868-80.
25. Yan D, Lockman D, Martinez A, Wong J, Brabbins D, Vicini F, et al. Computed tomography guided management of interfractional patient variation. Semin Radiat Oncol. 2005;15(3):168-79.
26. Castelli J, Simon A, Lafond C, Perichon N, Rigaud B, Chajon E, et al. Adaptive radiotherapy for head and neck cancer. Acta Oncol. 2018;57(10):1284-92.
27. Castelli J, Thariat J, Benezery K, Hasbini A, Gery B, Berger A, et al. Weekly Adaptive Radiotherapy vs Standard Intensity-Modulated Radiotherapy for Improving Salivary Function in Patients With Head and Neck Cancer: A Phase 3 Randomized Clinical Trial. JAMA Oncol. 2023;9(8):1056-64.
28. Boeke S, Mönnich D, van Timmeren JE, Balermpas P. MR-Guided Radiotherapy for Head and Neck Cancer: Current Developments, Perspectives, and Challenges. Front Oncol. 2021;11:616156.
29. Zhang Y, Rumgay H, Li M, Cao S, Chen W. Nasopharyngeal Cancer Incidence and Mortality in 185 Countries in 2020 and the Projected Burden in 2040: Population-Based Global Epidemiological Profiling. JMIR Public Health Surveill. 2023;9:e49968.
30. Kang M, Ma D, Gao J, Wang F, Yu B, Lu Y, et al. Endostar combined with concurrent chemoradiotherapy versus concurrent chemoradiotherapy alone for locoregionally advanced nasopharyngeal carcinoma (LA-NPC): A phase III, prospective, randomised-controlled, multicenter clinical trial. Journal of Clinical Oncology. 2024;42(16_suppl):6002-.
31. Ma J, Sun Y, Liang Y-L, Liu X, Shen L, Hu W, et al. Adjuvant PD-1 blockade with camrelizumab in high-risk locoregionally advanced nasopharyngeal carcinoma (DIPPER): A multicenter, open-label, phase 3, randomized controlled trial. Journal of Clinical Oncology. 2024;42(17_suppl):LBA6000-LBA.
info@onco-suisse
- Vol. 14
- Ausgabe 7
- November 2024








