- Status der regionalen Hyperthermie in der Schweiz
Die moderate regionale Hyperthermie wird in der Schweiz als Radiosensitizer in Kombination mit der Radiotherapie angewandt. Mit dem technologischen Fortschritt, zunehmender klinischer Evidenz sowie der erhöhten Nachfrage für Therapieoptionen bei Rezidivsituationen rückt sie erneut in den Fokus. In der Schweiz besteht seit 2017 eine Kostenübernahmepflicht für spezifische Indikationen. Die standardisierte, qualitativ hochstehende Anwendung der Hyperthermie wird durch das Schweizer Hyperthermie Netzwerk und das entsprechende, wöchentliche Hyperthermie-Tumorboard sichergestellt. Die erhöhte Nachfrage führte zu einer breiteren Verfügbarkeit der Hyperthermie in der Schweiz.
Moderate regional hyperthermia is concurrently applied with radiotherapy and thereby acts as a radiosensitizer. Due to advances in technology, increasing preclinical and clinical evidence and the increasing need for additional treatment options for cancer recurrences, hyperthermia is attracting interest in the oncologic society. Since 2017 granted reimbursement for several indications exists. Standardized and high-quality application of hyperthermia is ensured by the Swiss Hyperthermia Network and the corresponding weekly hyperthermia tumorboard. The increased demand for this treatment modality led to a broader availability of hyperthermia in Switzerland.
Key Words: Moderate, regionale hyperthermia, Radiosensitizer, Radiotherapy, Swiss Hyperthermia Network
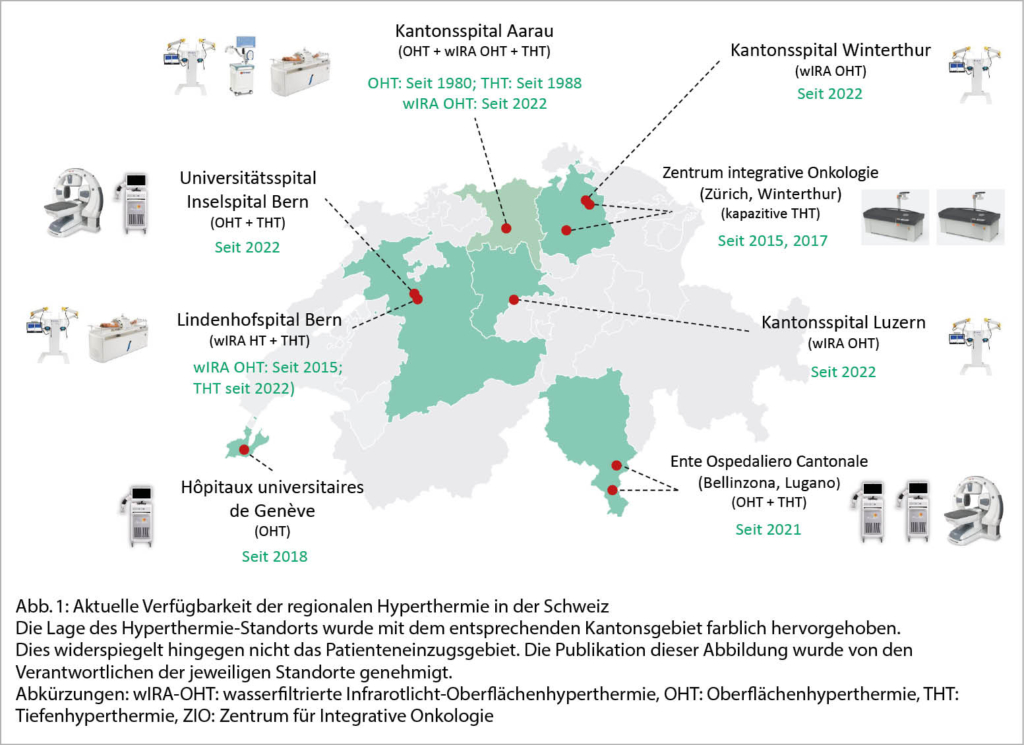
Die Applikation von Wärme im Bereich der Onkologie, zusammengefasst unter dem Begriff «thermal medicine», hält verstärkt Einzug in die onkologischen Therapiekombinationen. Mögliche Gründe sind die neuen technologischen Errungenschaften mit der Möglichkeit zur präziseren Anwendung und eine erhöhte Nachfrage für Therapieoptionen bei Rezidivsituationen. Dies spiegelt sich einerseits in einer vermehrten Anzahl an registrierten klinischen Studien wider. Beispielsweise haben wir 2015 im Studienregister «ClinicalTrials.gov» 23 registrierte Studien zur Evaluation der Hyperthermie (HT) analysiert (1), wobei das 5-Jahres-Update eine Verdoppelung mit 44 registrierten Studien (+95.6%) zeigt (2). Andererseits führte das steigende Interesse in der Schweiz zur Bildung des Schweizer Hyperthermie Netzwerks (SHN) (3) mit wachsender Anzahl an HT anbietenden Spitälern (4) (Abb. 1).
Bei der HT wird eine moderate Temperaturerhöhung von 39-43°C erzeugt und in enger zeitlicher Beziehung mit einer Radiotherapie (RT) oder Chemotherapie (ChT) angewendet. Sie wirkt nicht primär direkt zytotoxisch auf die Krebszellen, sondern sensibilisiert sie für die Angriffspunkte der RT- oder ChT (Radio-Sensitizer und Chemo-Sensitizer).
Die HT führt zu einer verbesserten Perfusion des Tumors mit besserer Oxygenierung des Gewebes und Reduktion der intrazellulären Azidose. Durch den Sauerstoffeffekt kann die in engem Zeitintervall mit der HT applizierte RT mehr DNA-Doppelstrangbrüche induzieren. Durch die temperaturabhängige Hemmung der DNA-Reparaturmechanismen (z.B. homologe Rekombination und nicht-homologe Rekombination) werden diese weniger effizient repariert. Diese stellen die Hauptmechanismen der HT-induzierten Radiosensibilisierung dar (5).
Wärme kann mit intrakavitärer, hyperthermer, lokaler ChT wie z.B. HIPEC oder von extern mittels radiativer, regionaler HT appliziert werden (6, 7). Die Überlegenheit der kombinierten RT+HT im Vergleich zur alleinigen RT wurde in randomisierten Phase-III-Studien insbesondere bei lokal fortgeschrittenen HNO-Tumoren, lokal fortgeschrittenen Zervixkarzinomen und Mammakarzinom-/Thoraxwandrezidiven gezeigt (8-10). Es änderte sich hingegen zeitgleich der Behandlungsstandard von alleiniger Radiotherapie zur kombinierten Radio-Chemotherapie, womit die Aussagekraft dieser Studien eingeschränkt wurde. Der konkomitierenden Chemotherapie mit ihrer wesentlich einfacheren Applikation und breiteren Verfügbarkeit wurde im klinischen Alltag trotz der höheren Toxizität den Vorzug gegeben. Im vorliegenden Artikel befassen wir uns ausschliesslich mit der regionalen HT, deren Geschichte und den häufigsten Indikationen hierzu in der Schweiz.
Geschichte und Entwicklung der regionalen Hyperthermie in der Schweiz
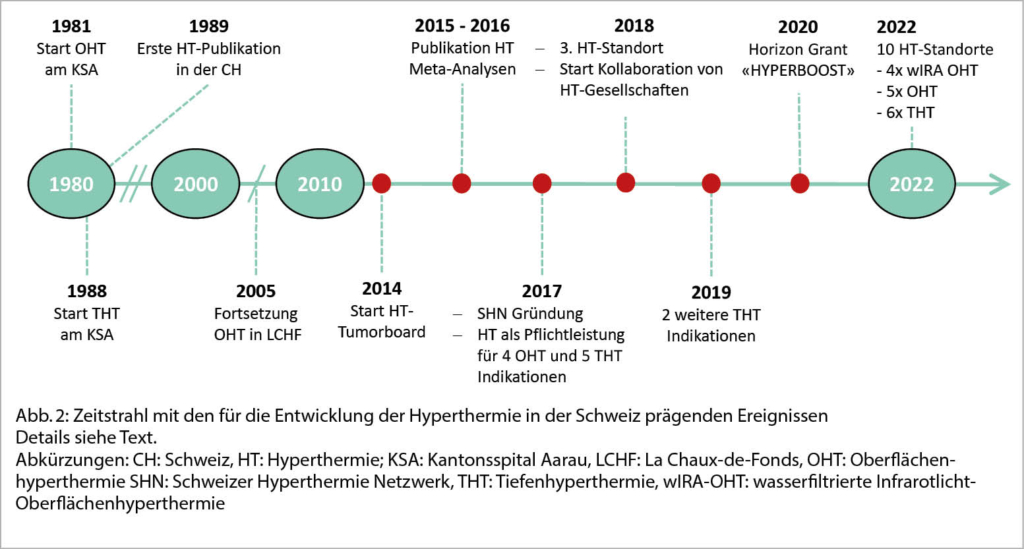
Die Radio-Onkologie des Kantonsspital Aarau gilt als Pionier der HT in der Schweiz. 1981 wurde das erste Oberflächenhyperthermie-Gerät (OHT) in Betrieb genommen, worauf 1988 ein Tiefenhyperthermie-Gerät (THT) und kurz darauf die erste HT-Publikation in der Schweiz folgte (11). Von 2004 an wurden die HT-Aktivitäten am Kantonsspital Aarau unterbrochen und die OHT ab 2005 an der Radio-Onkologie La Chaux-de-Fonds angeboten. Ab 2006 respektive ab 2010 wurde die OHT und THT am Kantonsspital Aarau wieder mit neuen Gerätschaften relanciert. Seit 2016 wird die OHT an der Radio-Onkologie Lindenhofspital Bern anstelle der Radio-Onkologie La Chaux-de-Fonds angeboten.
Für die HT in Kombination mit RT (RT+HT) musste vor jeder HT ein individuelles Kostenübernahmegesuch bei der Krankenkasse erfolgen. 2015 wurden Metaanalysen für die Indikationen Mammakarzinom (9), HNO Tumore (10) und das lokal fortgeschrittene Zervixkarzinom (12) erstellt, wobei sich ein signifikant besserer lokaler Effekt der Kombination HT+RT gegenüber der RT alleine, beim Zervixkarzinom zusätzlich ein Benefit im Gesamtüberleben zeigte.
Zur Vereinfachung der HT-Zuweisungen und Koordination von Forschungstätigkeiten wurde 2017 das Schweizer Hyperthermie Netzwerk (SHN) gegründet und die HT national organisiert. Dazu gehörte ein wöchentliches, virtuelles HT-Tumorboard. Zusätzlich kam es im selben Jahr zur Aufnahme von 4 OHT und 5 THT-Indikationen in den Pflichtleistungs-Katalog (OKP)(3). Bis zu diesem Zeitpunkt erfolgte noch keine erwähnenswerte Kooperation zwischen nationalen und internationalen HT-Gesellschaften. Dies änderte sich, als im November 2019 ein erstes Treffen des SHN, der Deutschen Hyperthermie-Gesellschaft sowie der European Society of Hyperthermia in Oncology (ESHO) zur Planung von gemeinsamen Studien und Förderprogrammen erfolgte. Ein Durchbruch gelang 2020, als das von den Niederlanden aus initiierte, internationale «HYPERBOOST» Projekt zur Förderung der Evidenzschaffung in der HT mit einem European Horizon 2020 Grant von 3.7 Mio Euro mit 14 PhD-Kandidaten ausgestattet wurde (13). Dieses Projekt erforscht die biologischen Aspekte der HT, entwickelt und validiert Therapieplanungs-Modelle und führt klinische Studien durch. Ab 2019 wurden die vier OHT-Indikationen definitiv in den Pflichtleistungskatalog aufgenommen, worauf dann 2021 auch zwei THT-Indikationen folgten. Zeitgleich wurden hingegen drei THT-Indikationen, namentlich Rektumkarzinom, Blasenkarzinom und Pankreaskarzinom, nicht mehr als Pflichtleistungen verlängert, da für diese Indikationen noch keine Level 1B Evidenz vorlag. Die Kostenübernahme der THT in Kombination mit RT muss für diese Indikationen erneut wieder per Kostengutsprachegesuch beantragt werden. Mittlerweile wurden aber insbesondere für die Behandlung des fortgeschrittenen Rektumkarzinoms zwei Phase-II-Studien publiziert (14, 15); eine nachfolgende internationale Phase-III-Studie ist in Planung. Die Nachfrage nach der regionalen HT in der Schweiz stieg, was sich in den aktuell vorhandenen 10 HT-Standorten in der Deutschschweiz, der Romandie und im Tessin zeigt. Die THT wird an 6 dieser Standorten angeboten (Abb. 2).
Eine Patterns-of-care Analyse der in der Zeitspanne von 2017 bis Mitte 2021 zur Evaluation einer RT+THT am Schweizer Hyperthermie Tumorboard vorgestellten und dann mit RT+THT behandelten Patienten zeigte über die Jahre eine leichte kontinuierliche Steigerung der Fallzahlen. Ca. 2/3 der Patienten wurden von externen Spitälern zur THT zugewiesen, wobei die häufigsten Indikationen Lokalrezidive mit Kompressionssymptomatik (20%), Rektum- (14.7%) und Blasenkarzinome (13.7%) waren.
Ca. 50% der Patienten wurden in kurativer Intention, 42% im Rahmen einer Re-Bestrahlung und 30% innerhalb oder analog eines laufenden Studienprotokolls behandelt (4).
Indikationen für eine kombinierte RT+HT
Die Effektivität der Kombination aus RT+HT wurde in einer Tumorentitäten-übergreifenden Metaanalyse von 3400 Patienten in 38 randomisierten und nicht-randomisierten 2-Arm Studien gezeigt. Die Kombination RT+HT führte dabei zu einer signifikanten Verbesserung der kompletten Ansprechrate um 15% (54.9% vs. 39.8% mit alleiniger RT; p < 0.001) ohne zusätzliche Grad 3-4 Nebenwirkungen (16).
Die kombinierte RT+HT ist somit insbesondere bei fortgeschrittenen Tumorsituationen, bei denen eine alleinige Radiotherapie wenig erfolgsversprechend ist, sinnvoll. Dies kann einerseits bei intrinsisch strahlenresistenten Tumoren wie z.B. Weichteilsarkomen sein oder in Situationen bei denen die benötigte RT-Dosis wegen angrenzenden gesunden Gewebe nicht appliziert werden kann; z.B. bei Re-Bestrahlungen oder wenn eine definitive RT mit dem Ziel des Organerhalts (z.B. tiefsitzendes Rektumkarzinom) notwendig ist.
Bei der Re-RT fördert die HT die Durchblutung des radiogen vorbelasteten und fibrosierten Gewebes und somit die lokale Verfügbarkeit von Sauerstoff (Reoxygenierung) (17).
In der Schweiz wird die moderate, regionale Hyperthermie meist mit elektromagnetischen Wellen gemäss den internationalen Richtlinien (18, 19) appliziert. Je nach Frequenz wird zwischen Radiofrequenz (3 Hz – 300 MHz), Mikrowellen (300 MHz – 300 GHz) und Infrarot (300 GHz – 430 THz) differenziert, welche sich insbesondere in der unterschiedlichen Eindringtiefe unterscheiden (6). Die radiativen und kapazitiven THT-Geräte verwenden eine Frequenz von 13.56 MHz, 70 MHz und 100-120 MHz und werden für Tumore in einer Tiefe von > 4 cm ab Körperoberfläche verwendet. Die radiativen OHT-Geräte verwenden 434 MHz und 915 MHz und können Tumore bis 4 cm ab Körperoberfläche erwärmen. Die OHT mit wasserfiltriertem Infrarotlicht (wIRA) kann grosse Hautoberflächen erwärmen (20), hat dabei aber eine eingeschränkte Eindringtiefe von ca. 1,5cm (21). Entsprechend der Flächen- und Tiefenausdehnung des Tumors wird die entsprechende HT-Technik am Schweizer Hyperthermie Tumorboard diskutiert.
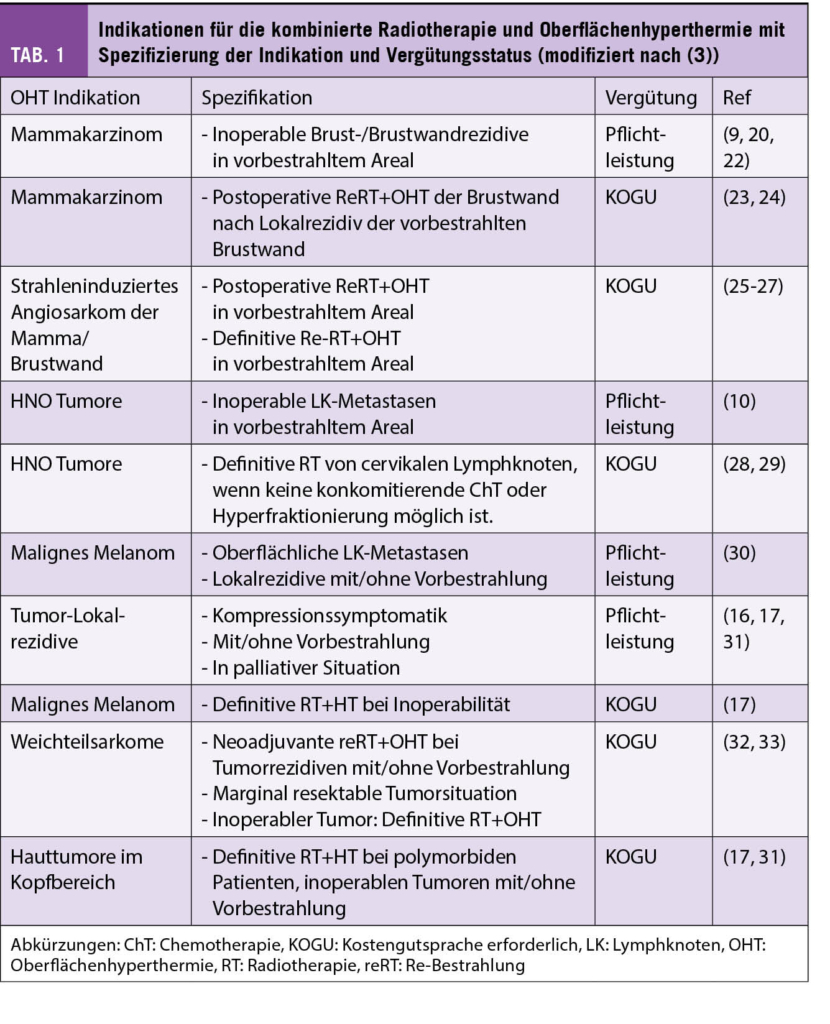
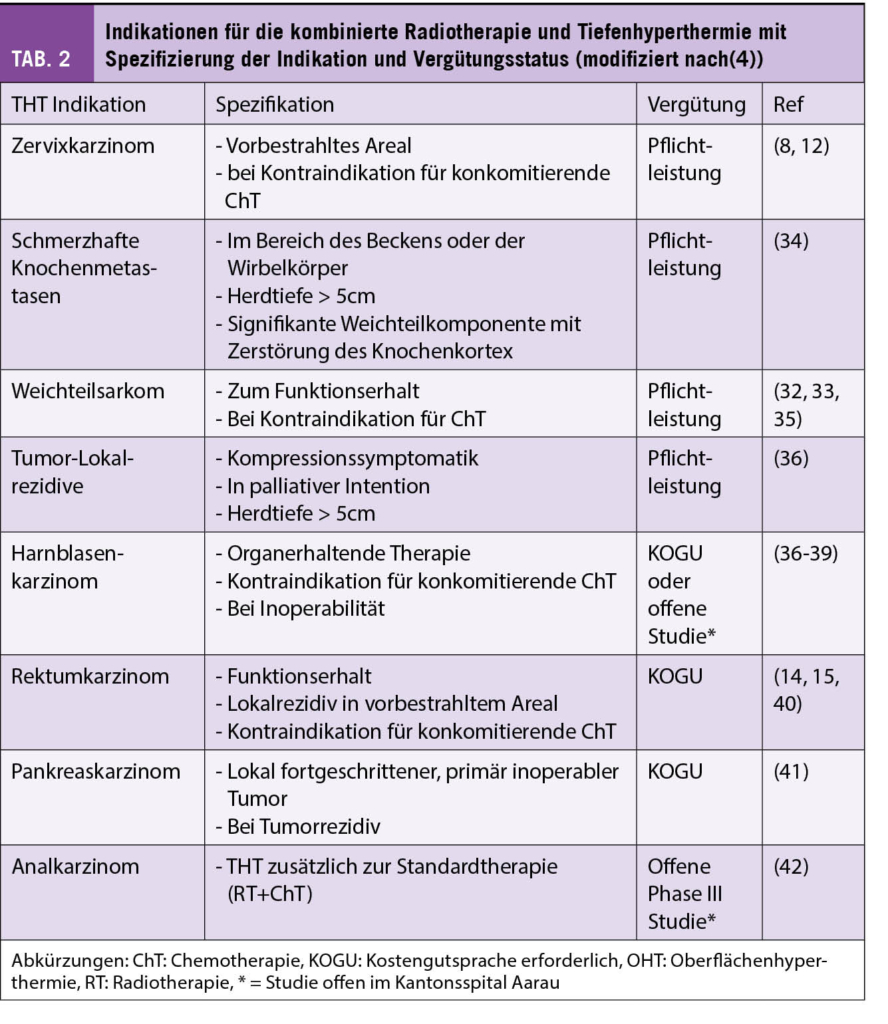
In den Tabellen 1 und 2 sind die häufigsten Indikationen in der Schweiz für die Kombination RT+HT nach OHT und THT mit der entsprechenden Krankenkassen-Vergütung und entsprechenden Referenzen zusammengefasst.
Zusammenfassung und Diskussion
Unter Führung des Kantonsspitals Aarau konnte durch die strukturierte Zusammenstellung der Evidenz und die Bestrebungen einer nationalen Organisation im Rahmen des Schweizer Hyperthermie Netzwerks die Basis für eine strukturierte Anwendung der HT und Aufnahme einzelner Indikationen als Pflichtleistung in das OKP geschaffen werden. Das wöchentliche SHN-Tumorboard bildet die Grundlage für eine qualitativ hochwertige Indikationsstellung und anschliessende Durchführung der HT in der Schweiz (4). Diese Organisationsstruktur in der HT ist weltweit einzigartig und stellt einen Grund für die nun breitere lokale Verfügbarkeit dieser effektiven und zudem nebenwirkungsarmen onkologischen Therapieoption dar.
Dr. med. Emanuel Stutz 1*
Dr. med. Markus Notter 2*
Dr. med. Emsad Puric 3*
Dr. med. Boris Hübenthal 4*
Prof. Dr. med. Daniel M. Aebersold 1
Prof. Dr. med. Oliver Riesterer 3#
1 Universitätsklinik für Radio-Onkologie
Inselspital, Universität Bern
2 Radio-Onkologie, Lindenhofspital, Bern
3 Radio-Onkologie-Zentrum KSA-KSB, Kantonsspital Aarau
4 Zentrum für Integrative Onkologie, Zürich
* SHN Vorstand
# SHN Präsident
Danksagung: Ein grosser Dank gebührt den Pionieren der Hyperthermie in der Schweiz, Dr. Markus Notter, Dr. Emsad Puric und Prof. Stephan Bodis, die mit ihrem visionären Ideen und deren praktischen Umsetzungen die Hyperthermie in der Schweiz entscheidend weitergebracht haben.
Copyright bei Aerzteverlag medinfo AG
Oberarzt Radio-Onkologie
Universitätsklinik für Radio-Onkologie Inselspital
Freiburgstrasse
3010 Bern
emanuel.stutz@insel.ch
SHN Präsident
Radio-Onkologie-Zentrum KSA-KSB
Kantonsspital Aarau, Tellstrasse 25
5001 Aarau
Die Autoren haben keine Interessenskonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Die konkomitierende, regionale Hyperthermie wirkt als Radiosensitizer und verbessert den Effekt der Radiotherapie
◆ Für spezifische Indikationen konnte dieser Effekt in randomisierten Studien nachgewiesen werden
◆ In der Schweiz wird die Hyperthermie bei verschiedenen Indikationen von den Krankenkassen bezahlt
◆ Aufgrund erhöhter Nachfrage wird die Hyperthermie nun an mehreren Standorten angeboten mit somit breiterer Verfügbarkeit in der Schweiz.
1. Cihoric N, Tsikkinis A, van Rhoon G, Crezee H, Aebersold DM, Bodis S, et al. Hyperthermia-related clinical trials on cancer treatment within the ClinicalTrials.gov registry. International journal of hyperthermia : the official journal of European Society for Hyperthermic Oncology, North American Hyperthermia Group. 2015;31(6):609-14.
2. Peeters H, van Zwol EM, Brancato L, MG MCdC, Bogers J. Systematic review of the registered clinical trials for oncological hyperthermia treatment. International journal of hyperthermia : the official journal of European Society for Hyperthermic Oncology, North American Hyperthermia Group. 2022;39(1):806-12.
3. Stutz ED, N.R.; Puric, E.; Bodis, S. Stellenwert der regionären Hyperthermie in der Krebstherapie. Swiss Medical Forum [German]. 2017;17(48):1074–6.
4. Stutz E, Puric E, Ademaj A, Künzi A, Krcek R, Timm O, et al. Present Practice of Radiative Deep Hyperthermia in Combination with Radiotherapy in Switzerland. Cancers. 2022;14(5).
5. Datta NR, Kok HP, Crezee H, Gaipl US, Bodis S. Integrating Loco-Regional Hyperthermia Into the Current Oncology Practice: SWOT and TOWS Analyses. Front Oncol. 2020;10:819.
6. Kok HP, Cressman ENK, Ceelen W, Brace CL, Ivkov R, Grüll H, et al. Heating technology for malignant tumors: a review. International journal of hyperthermia : the official journal of European Society for Hyperthermic Oncology, North American Hyperthermia Group. 2020;37(1):711-41.
7. van der Zee J, Vujaskovic Z, Kondo M, Sugahara T. The Kadota Fund International Forum 2004–clinical group consensus. International journal of hyperthermia : the official journal of European Society for Hyperthermic Oncology, North American Hyperthermia Group. 2008;24(2):111-22.
8. Lutgens L, van der Zee J, Pijls-Johannesma M, De Haas-Kock DF, Buijsen J, Mastrigt GA, et al. Combined use of hyperthermia and radiation therapy for treating locally advanced cervix carcinoma. Cochrane Database Syst Rev. 2010;2010(3):Cd006377.
9. Datta NR, Puric E, Klingbiel D, Gomez S, Bodis S. Hyperthermia and Radiation Therapy in Locoregional Recurrent Breast Cancers: A Systematic Review and Meta-analysis. International journal of radiation oncology, biology, physics. 2016;94(5):1073-87.
10. Datta NR, Rogers S, Ordóñez SG, Puric E, Bodis S. Hyperthermia and radiotherapy in the management of head and neck cancers: A systematic review and meta-analysis. International journal of hyperthermia : the official journal of European Society for Hyperthermic Oncology, North American Hyperthermia Group. 2016;32(1):31-40.
11. Notter M. Hyperthermie – ein neues Element in der Krebsbehandlung. Schweiz Rundschau Med (PRAXIS). 1989;78; 23, 897-904.
12. Datta NR, Rogers S, Klingbiel D, Gómez S, Puric E, Bodis S. Hyperthermia and radiotherapy with or without chemotherapy in locally advanced cervical cancer: a systematic review with conventional and network meta-analyses. International journal of hyperthermia : the official journal of European Society for Hyperthermic Oncology, North American Hyperthermia Group. 2016;32(7):809-21.
13. https://www.amsterdamumc.org/en/research/researchers/johannes-crezee.htm
14. Gani C, Lamprecht U, Ziegler A, Moll M, Gellermann J, Heinrich V, et al. Deep regional hyperthermia with preoperative radiochemotherapy in locally advanced rectal cancer, a prospective phase II trial. Radiotherapy and oncology : journal of the European Society for Therapeutic Radiology and Oncology. 2021;159:155-60.
15. Ott OJ, Gani C, Lindner LH, Schmidt M, Lamprecht U, Abdel-Rahman S, et al. Neoadjuvant Chemoradiation Combined with Regional Hyperthermia in Locally Advanced or Recurrent Rectal Cancer. Cancers. 2021;13(6).
16. Datta NR, Ordóñez SG, Gaipl US, Paulides MM, Crezee H, Gellermann J, et al. Local hyperthermia combined with radiotherapy and-/or chemotherapy: recent advances and promises for the future. Cancer treatment reviews. 2015;41(9):742-53.
17. Jones EL, Oleson JR, Prosnitz LR, Samulski TV, Vujaskovic Z, Yu D, et al. Randomized trial of hyperthermia and radiation for superficial tumors. J Clin Oncol. 2005;23(13):3079-85.
18. Dobšíček Trefná H, Crezee J, Schmidt M, Marder D, Lamprecht U, Ehmann M, et al. Quality assurance guidelines for superficial hyperthermia clinical trials : II. Technical requirements for heating devices. Strahlentherapie und Onkologie : Organ der Deutschen Rontgengesellschaft [et al]. 2017;193(5):351-66.
19. Bruggmoser G, Bauchowitz S, Canters R, Crezee H, Ehmann M, Gellermann J, et al. Guideline for the clinical application, documentation and analysis of clinical studies for regional deep hyperthermia: quality management in regional deep hyperthermia. Strahlentherapie und Onkologie : Organ der Deutschen Rontgengesellschaft [et al]. 2012;188 Suppl 2:198-211.
20. Notter M, Thomsen AR, Nitsche M, Hermann RM, Wolff HA, Habl G, et al. Combined wIRA-Hyperthermia and Hypofractionated Re-Irradiation in the Treatment of Locally Recurrent Breast Cancer: Evaluation of Therapeutic Outcome Based on a Novel Size Classification. Cancers. 2020;12(3).
21. Crezee J, Bakker A, Zweije R, Kolff MW, van den Bongard HJGD, van Tienhoven G, et al. Combined Use of wIRA and Microwave or Radiofrequency Hyperthermia. In: Vaupel P, editor. Water-filtered Infrared A (wIRA) Irradiation: From Research to Clinical Settings. Cham: Springer International Publishing; 2022. p. 97-106.
22. Vernon CC, Hand JW, Field SB, Machin D, Whaley JB, van der Zee J, et al. Radiotherapy with or without hyperthermia in the treatment of superficial localized breast cancer: results from five randomized controlled trials. International Collaborative Hyperthermia Group. International journal of radiation oncology, biology, physics. 1996;35(4):731-44.
23. Bakker A, Tello Valverde CP, van Tienhoven G, Kolff MW, Kok HP, Slotman BJ, et al. Post-operative re-irradiation with hyperthermia in locoregional breast cancer recurrence: Temperature matters. Radiotherapy and oncology : journal of the European Society for Therapeutic Radiology and Oncology. 2021;167:149-57.
24. Linthorst M, van Geel AN, Baaijens M, Ameziane A, Ghidey W, van Rhoon GC, et al. Re-irradiation and hyperthermia after surgery for recurrent breast cancer. Radiotherapy and oncology : journal of the European Society for Therapeutic Radiology and Oncology. 2013;109(2):188-93.
25. de Jong MA, Oldenborg S, Bing Oei S, Griesdoorn V, Kolff MW, Koning CC, et al. Reirradiation and hyperthermia for radiation-associated sarcoma. Cancer. 2012;118(1):180-7.
26. Linthorst M, van Geel AN, Baartman EA, Oei SB, Ghidey W, van Rhoon GC, et al. Effect of a combined surgery, re-irradiation and hyperthermia therapy on local control rate in radio-induced angiosarcoma of the chest wall. Strahlentherapie und Onkologie : Organ der Deutschen Rontgengesellschaft [et al]. 2013;189(5):387-93.
27. Notter M, Stutz E, Thomsen AR, Vaupel P. Radiation-Associated Angiosarcoma of the Breast and Chest Wall Treated with Thermography-Controlled, Contactless wIRA-Hyperthermia and Hypofractionated Re-Irradiation. Cancers. 2021;13(15).
28. Arcangeli G, Benassi M, Cividalli A, Lovisolo GA, Mauro F. Radiotherapy and hyperthermia. Analysis of clinical results and identification of prognostic variables. Cancer. 1987;60(5):950-6.
29. Valdagni R, Amichetti M. Report of long-term follow-up in a randomized trial comparing radiation therapy and radiation therapy plus hyperthermia to metastatic lymph nodes in stage IV head and neck patients. International journal of radiation oncology, biology, physics. 1994;28(1):163-9.
30. Overgaard J, Gonzalez Gonzalez D, Hulshof MC, Arcangeli G, Dahl O, Mella O, et al. Randomised trial of hyperthermia as adjuvant to radiotherapy for recurrent or metastatic malignant melanoma. European Society for Hyperthermic Oncology. Lancet (London, England). 1995;345(8949):540-3.
31. Gabriele P, Ferrara T, Baiotto B, Garibaldi E, Marini PG, Penduzzu G, et al. Radio hyperthermia for re-treatment of superficial tumours. International journal of hyperthermia : the official journal of European Society for Hyperthermic Oncology, North American Hyperthermia Group. 2009;25(3):189-98.
32. Prosnitz LR, Maguire P, Anderson JM, Scully SP, Harrelson JM, Jones EL, et al. The treatment of high-grade soft tissue sarcomas with preoperative thermoradiotherapy. International journal of radiation oncology, biology, physics. 1999;45(4):941-9.
33. Spałek MJ, Borkowska AM, Telejko M, Wągrodzki M, Niebyłowska D, Uzar A, et al. The Feasibility Study of Hypofractionated Radiotherapy with Regional Hyperthermia in Soft Tissue Sarcomas. Cancers. 2021;13(6).
34. Chi MS, Yang KL, Chang YC, Ko HL, Lin YH, Huang SC, et al. Comparing the Effectiveness of Combined External Beam Radiation and Hyperthermia Versus External Beam Radiation Alone in Treating Patients With Painful Bony Metastases: A Phase 3 Prospective, Randomized, Controlled Trial. International journal of radiation oncology, biology, physics. 2018;100(1):78-87.
35. Datta NR, Schneider R, Puric E, Ahlhelm FJ, Marder D, Bodis S, et al. Proton Irradiation with Hyperthermia in Unresectable Soft Tissue Sarcoma. International journal of particle therapy. 2016;3(2):327-36.
36. van der Zee J, González González D, van Rhoon GC, van Dijk JD, van Putten WL, Hart AA. Comparison of radiotherapy alone with radiotherapy plus hyperthermia in locally advanced pelvic tumours: a prospective, randomised, multicentre trial. Dutch Deep Hyperthermia Group. Lancet (London, England). 2000;355(9210):1119-25.
37. Riesterer O, Ademaj A, Puric E, Eberle B, Beck M, Gomez S, et al. Tetramodal therapy with transurethral resection followed by chemoradiation in combination with hyperthermia for muscle-invasive bladder cancer: early results of a multicenter phase IIB study. International journal of hyperthermia : the official journal of European Society for Hyperthermic Oncology, North American Hyperthermia Group. 2022;39(1):1078-87.
38. Datta NR, Stutz E, Puric E, Eberle B, Meister A, Marder D, et al. A Pilot Study of Radiotherapy and Local Hyperthermia in Elderly Patients With Muscle-Invasive Bladder Cancers Unfit for Definitive Surgery or Chemoradiotherapy. Front Oncol. 2019;9:889.
39. Merten R, Ott O, Haderlein M, Bertz S, Hartmann A, Wullich B, et al. Long-Term Experience of Chemoradiotherapy Combined with Deep Regional Hyperthermia for Organ Preservation in High-Risk Bladder Cancer (Ta, Tis, T1, T2). Oncologist. 2019;24(12):e1341-e50.
40. De Haas-Kock DF, Buijsen J, Pijls-Johannesma M, Lutgens L, Lammering G, van Mastrigt GA, et al. Concomitant hyperthermia and radiation therapy for treating locally advanced rectal cancer. Cochrane Database Syst Rev. 2009(3):Cd006269.
41. Rogers SJ, Datta NR, Puric E, Timm O, Marder D, Khan S, et al. The addition of deep hyperthermia to gemcitabine-based chemoradiation may achieve enhanced survival in unresectable locally advanced adenocarcinoma of the pancreas. Clin Transl Radiat Oncol. 2021;27:109-13.
42. Ott OJ, Schmidt M, Semrau S, Strnad V, Matzel KE, Schneider I, et al. Chemoradiotherapy with and without deep regional hyperthermia for squamous cell carcinoma of the anus. Strahlentherapie und Onkologie : Organ der Deutschen Rontgengesellschaft [et al]. 2019;195(7):607-14.
info@onco-suisse
- Vol. 12
- Ausgabe 8
- Dezember 2022