- Strahleninduzierte orale Mukositis
Die orale Radiomukositis gehört zu den unerwünschten Nebenwirkungen der Radiotherapie bei Hals-Nasen-Ohren-Tumoren (HNO-Tumoren), welche die Lebensqualität der Patienten für mehrere Wochen beeinträchtigt sowie den Therapieerfolg gefährden kann. Eine adäquate symptomatische Behandlung ist ein wichtiger Bestandteil, um den womöglich lebensbedrohlichen Folgen vorzubeugen.
La radiomucosite buccale est l’un des effets secondaires indésirables de la radiothérapie dans les tumeurs des oreilles, du nez et de la gorge (ORL), qui peut nuire à la qualité de vie des patients pendant plusieurs semaines et compromettre le succès du traitement. Un traitement symptomatique adéquat est un élément important pour prévenir les conséquences potentiellement mortelles.
background
The proportion of ENT tumors in all malignancies is approximately 5%, with squamous cell carcinoma being the most common histological type in more than 90% of all patients (1). The primary curative treatment includes radiotherapy, surgical treatment or a combined procedure. Radiotherapy prevents mutilating surgery through the organ preservation approach of locally advanced tumors. A concomitant chemo or antibody therapy with cetuximab significantly improves prognosis in high-risk situations (absolute survival advantage of 7% after 5 years). However, a non-surgical approach leads to an increase in the incidence of oral mucositis. (1-4). About 75% of ENT tumors are definitely or postoperatively irradiated (4).
pathophysiology
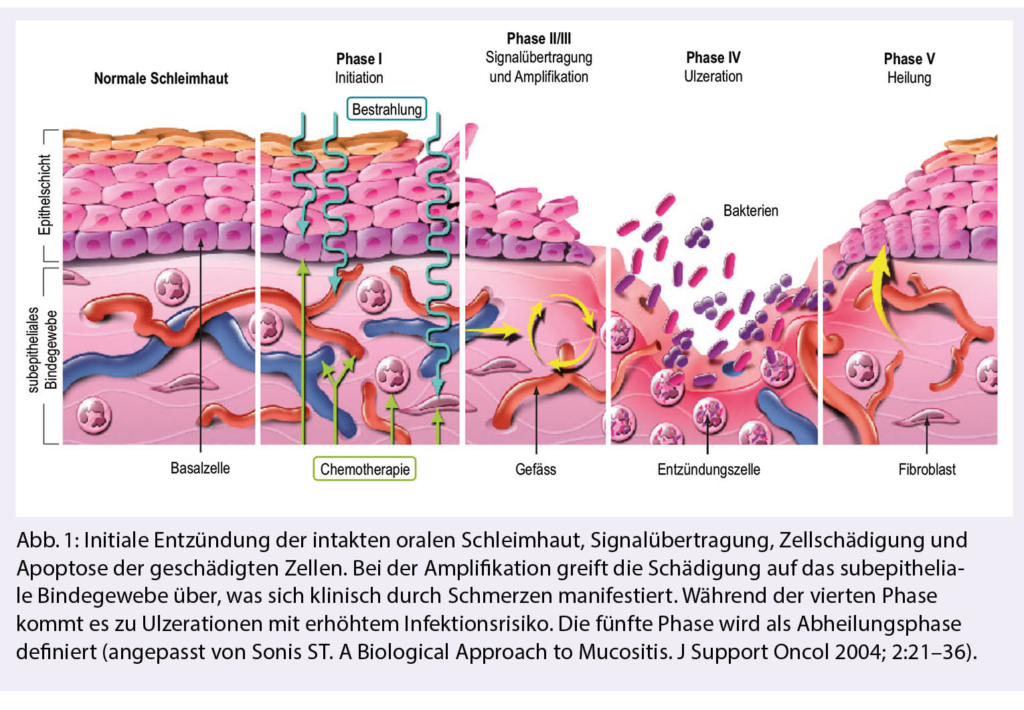
The ionizing radiation in cells in mitosis leads to beach breaks of the DNA and thus to apoptosis. The tumor cells in the head and neck area are highly proliferative and thus particularly sensitive to radiation. However, radiotherapy is not only in the carcinoma cells, but also in the proliferating adjacent normal tissue, especially in the mucous membranes (5, 6). The complex development of oral radiomucositis begins in the submucosal endothelium or adjacent connective tissue layer. In case of intensive attack this leads to a damage of the oral mucous membrane with ulcerations. The risk of local infections to sepsis increases, depending on the extent and duration (2, 5, 7-9).Figure 1 illustrates the five stages of oral mucositis formation (9).
clinic
Die strahleninduzierte Mukositis ist eine stark beeinträchtigende Nebenwirkung bei HNO-Tumoren (10, 11). Das übliche kurative Radiotherapieschema für HNO-Tumore dauert 5 bis 7 Wochen, die Gesamtdosis beträgt rund 70 Gy, wobei häufig ein akzeleriertes Schema bevorzugt wird (2, 12). Im Gegensatz zur normal fraktionierten Radiotherapie (10 Gy pro Woche, in 5 Sitzungen) wird bei der akzelerierten Radiotherapie eine höhere Dosis pro Woche eingestrahlt, was die Behandlungszeit verkürzt. Eine signifikant verbesserte lokale Tumorkontrolle wurde in mehreren randomisierten Studien nachgewiesen (13–15).
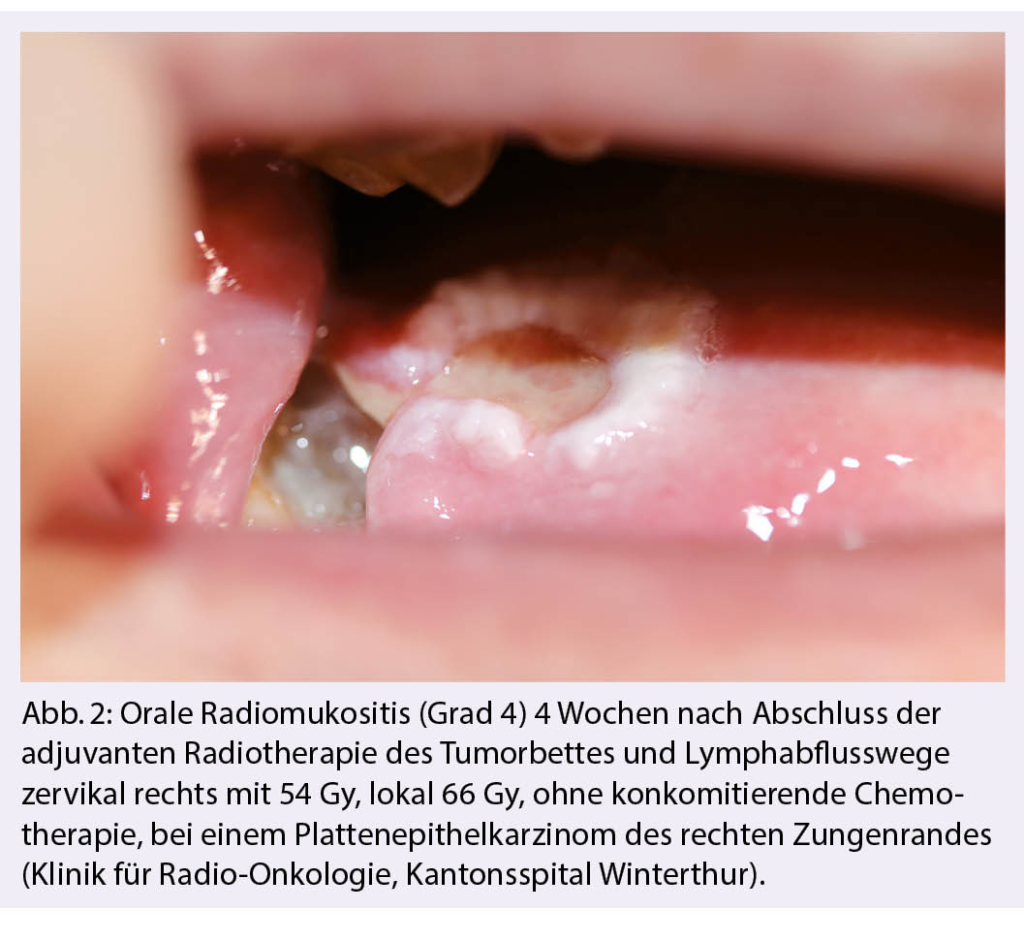
Die Radiomukositis tritt in Abhängigkeit von der eingestrahlten Dosis auf und zeigt sich gewöhnlich ab einer kumulierten Dosis von 15 Gy bis 20 Gy beziehungsweise ab der zweiten bis dritten Behandlungswoche. Eine ulzerative Mukositis kann bereits ab einer kumulierten Dosis von 30 Gy beobachtet werden, welche jeden Bereich der Schleimhaut innerhalb des Bestrahlungsgebiets betreffen kann (16, 17). Die Beschwerden können in abnehmender Intensität bis 4 Wochen und länger nach Abschluss der Behandlung persistieren (Abb. 2) (2). Ihre Inzidenz nimmt mit einer konkomitierenden Chemotherapie sowie bei Anwendung einer nicht-konventionellen Fraktionierung signifikant zu (8, 10, 18).
Das klinische Bild, welches oft mit opportunistischen Infektionen sowie Gewichtsverlust vergesellschaftet ist, beinhaltet Erythem, Ulzera, lokale Schmerzen, Blutung, Xerostomie und dadurch Geschmacksstörung. Diese Nebenwirkungen können eine vorübergehende Unterbrechung der Radiotherapie erzwingen, eine Hospitalisation notwendig machen oder sogar zum Tode führen (2, 10, 19, 20). Therapieunterbrüche sind mit einer reduzierten lokalen und regionalen Kontrolle vergesellschaftet. Bei einer Verlängerung der Behandlungszeit wird der Verlust der lokalen Kontrolle auf etwa 1 bis 1,2 % pro Tag geschätzt (21). Deshalb gefährdet eine nicht adäquat behandelte Radiomukositis den Behandlungserfolg und führt auch zu hohen Folgekosten (2, 22). Die Hospitalisierungsrate aufgrund Komplikationen einer oralen Mukositis beträgt allgemein 16% und 32% bei Patienten, die eine nicht-konventionelle Fraktionierung erhalten haben (10).
Das erhöhte Risiko einer Radiomukositis besteht bei jüngeren Patienten aufgrund der schnelleren Zellteilung und -proliferation sowie bei älteren Patienten durch die tiefere Heilungsrate (20, 23). Zu weiteren Risikofaktoren zählen unter anderem eine vorbestehende schlechte Mundhygiene, Rauchen, Alkoholkonsum, Diabetes mellitus und Mangelernährung. Der letztgenannte Faktor verdient –da potenziell reversibel – eine besondere Aufmerksamkeit (18, 20, 22).
Management
Das Management einer oralen Radiomukositis setzt auf Linderung der Beschwerden und Prävention von Komplikationen. Zentral sind eine engmaschige Mundpflege, eine adäquate Analgesie sowie die Behandlung opportunistischer Infektionen. Die Anpassung der Nahrungsaufnahme spielt dabei auch eine wesentliche Rolle und kann die Verabreichung von Nahrungsergänzungsmitteln sowie die Notwendigkeit einer enteralen und ausnahmsweise einer parenteralen Ernährung zur Folge haben.
Mundpflege
Eine regelmässige und sorgfältige Mund- und Zahnpflege gilt als Schlüsselelement bei der Prävention und der symptomatischen Behandlung einer Radiomukositis (10, 17, 19, 20, 24). Lokale Interventionen wie die Mundspülung mit Natriumbicarbonat- oder Salzwasser und der Einsatz von Benzydamin sind wirksame, weitverbreitete Mittel bei der Prävention und Behandlung der oralen Radiomukositis. Zudem soll auf heisses und scharfes Essen, auf Rauchen sowie Alkoholkonsum verzichtet werden (16–18).
Benzydamin ist ein lokal wirkender nicht-steroidaler Entzündungshemmer, dessen Einsatz in der Mundhöhle gut vertragen wird und aufgrund der analgetischen, antiinflamatorischen und antiseptischen Eigenschaften in mehreren Studien dokumentiert ist (22). Die Anwendung führt nicht nur zur signifikanten Verzögerung des Auftretens einer Radiomukositis, sondern zur verbesserten Schmerzlinderung (11, 16–18, 22, 25).
Die Anwendung von pflanzlichen Mitteln beziehungsweise Tees wird seit langem ausgiebig diskutiert. Einige Studien befürworten den Einsatz von Kamillen-Tee als Mundspülung aufgrund der entzündungshemmenden sowie antibakteriellen Wirkung und der damit verbundenen Reduzierung der bakteriellen Last (19, 20, 22, 23). Alternativ kann Salbeitee angewendet werden (26).
Eine Supplementation mit Zink wird mit einem reduzierten Auftreten der Radiomukositis sowie des Analgetikabedarfs vergesellschaftet (17, 19, 20, 27).
Die Anwendung von Honig als Bestandteil des Managements der Radiomukositis wird kontrovers diskutiert. Einerseits enthält Honig mehrere antibakterielle Stoffe. Zusätzlich besitzt Honig analgetische Eigenschaften und die Fähigkeit, die adäquate Epithelisierung zu fördern (23, 27–29). Andererseits begünstigt die Anwendung von Honig das Auftreten von Karies (23).
Die Anwendung von Aloe Vera bzw. Säfte, welche eine anti-oxidative Wirkung besitzen, wurde ebenfalls als Prävention sowie Behandlung der Radiomukositis in einigen Studien empfohlen. Präklinische Studien zeigten, dass Aloe Vera die Wundheilung fördern kann, da die Anwendung zu einer Reduktion der Vasokonstriktion, vermehrter Synthese von Kollagen und einer verbesserten lokalen Sauerstoffversorgung der Wunden führte. Allerdings sind noch zusätzliche Studien notwendig (5).
Tatsächlich zeigte sich in vielen Studien, dass die Art der Mundspülung weniger Einfluss auf die Ausprägung der Mukositis hat, als die Häufigkeit (4-6 mal pro Tag). Nach Abschluss der Radiotherapie soll die Mundpflege solange fortgesetzt und überwacht werden, bis keine sichtbaren Schleimhautläsionen mehr erkennbar sind und sich die Xerostomie normalisiert hat (30).
Analgesie
Die frühzeitige Einleitung der Schmerzmedikation ist zwingend notwendig. Zur Analgesie bei schwachen bis mässigen Schmerzen stehen Nichtopioid-Analgetika zur Verfügung, entsprechend dem WHO-Stufenschema. Es ist darauf zu achten, welche Galenik ein Patient mit Schluckbeschwerden zu sich nehmen kann. Daher ist die Verschreibung von Metamizol-Tropfen in der Praxis aufgrund ihrer einfachen Applizierbarkeit sowie klinisch gutem Ansprechen beliebt. Starke brennende Schmerzen im Mund- und Rachenraum können oft nur durch Opiate gelindert werden. Die Anwendung von Fentanylpflaster ist bei ausgeprägten Schluckschmerzen zu empfehlen (31, 32). Die lokale zusätzliche Anwendung von Anästhetika wie Lidocaine, Dyclonine oder Diphenhydramine kann hilfreich sein (16, 17, 20). Die Infiltration des Tumors in benachbarte Gewebe kann neben viszeralen auch zu neuropathischen Schmerzen führen. Bei nichtausreichendem Ansprechen auf Opiate ist der Einsatz von Gabapentin als Co-Analgetikum eine Option (2).
Infektionen
Bei der oralen Mukositis besteht ein erhöhtes Risiko für die Entwicklung bakterieller, viraler und pilzartiger Infektionen (33). Die Entwicklung eines Mundsoors in der beeinträchtigten Schleimhaut ist häufig, vor allem bei simultaner strahlensensibilisierender Chemotherapie mit Steroidgabe. Wenn die Speicheldrüsen im bestrahlten Bereich einbezogen sind, gibt es durch die Xerostomie eine progressive Steigerung der oralen Candidabesiedlung (12, 34, 35). Die Behandlung kann mit Fluconazol oder Amphotericin B erfolgen (22). Zur Soorprophylaxe zeigte die Fluconazolgabe (100 mg pro Tag oder 200 mg zweimal wöchentlich mit einem Abstand von mindestens 3 Tagen) eine positive Wirkung (36–38). Die Mundtrockenheit kann durch Speichelersatz abgeschwächt werden (20, 30).
Aussicht: alternative Therapiemöglichkeiten
Die Low-Level-Laser Therapie (LLL-Therapie) wurde in den letzten Jahren in zahlreichen Studien als wirkungsvoll beurteilt. Die LLL-Therapie führt zur Verringerung sowie Neutralisation freier Radikale, was klinisch mit vermehrter Zellteilung, Veränderung der Nerventransmission und Gewebeherstellung verbunden ist. Diese Technik ermöglicht durch die verzögerte Entwicklung der Radiomukositis sowie derer Abschwächung eine ausreichende Schmerzlinderung (1, 17, 19). Ihr Wirkungsmechanismus wurde jedoch mittlerweile bereits in Frage gestellt: in einer 2018 durchgeführten Studie zeigte sich durch die Anwendung der LLL-Thera-pie eine mögliche Beschleunigung des Tumorwachstums (39). Weitere Studien sind notwendig, um hierüber vertiefte Erkenntnisse zu erlangen.
In zahlreichen unterschiedlichen Studien, die bislang durchgeführt wurden, haben sich positive Ereignisse oftmals nur in Bezug auf die aus der Chemotherapie entstehende Mukositis gezeigt. Die Übertragbarkeit der chemotherapeutischen Erkenntnisse auf die Radiotherapie ist nicht in jedem Fall gegeben. Die Anwendung von Kryotherapie, Chlorhexidin und Sucralfat, welche zur Behandlung der durch Chemotherapie bedingten Mukositis geeignet ist, wird bei der Radiomukositis nicht empfohlen (17).
Schlussfolgerung
Die Radiotherapie ist neben der Chirurgie die wichtigste Modalität zur Behandlung von lokalisierten HNO-Tumoren. Neben dem therapeutischen Effekt auf die Tumorzellen kommt es obligat dosisabhängig zu einer Mukositis im Normalgewebe. Die adäquate Prophylaxe und Behandlung spielen eine zentrale Rolle, um die Einbusse an Lebensqualität für die Patienten zu minimieren und die damit verbundenen Komplikationen, welche den Behandlungserfolg insgesamt gefährden, zu verhindern. Eine nicht adäquat behandelte Mukositis führt ausserdem zu Mehrkosten, die es zu verhindern gilt.
Klinik für Radio-Onkologie
Kantonspital Winterthur
Brauerstrasse 15
8400 Winterthur
Klinik für Radio-Onkologie
Kantonspital Winterthur
Brauerstrasse 15
8400 Winterthur
Klinik für Radio-Onkologie
Kantonspital Winterthur
Brauerstrasse 15
8400 Winterthur
Die Autoren geben an, dass für diese Publikation kein Interessenskonflikt vorliegt.
- Für das Management der Radiomukositis ist eine engmaschige und kontinuierliche Betreuung durch das Ärzte- und Pflegeteam ent-
scheidend. - Ein allgemeiner Konsens besteht betreffend der zentralen Bedeutung der Mundpflege, wobei deren konsequente Durchführung entscheidender ist als die Wahl der eingesetzten Mittel.
- Die Mundpflege soll solange fortgesetzt und überwacht werden,
bis alle sichtbaren Schleimhautläsionen abgeheilt sind. - Bei Schmerzen ist eine adäquate Analgesie wesentlich.
- Eine klinisch nachgewiesene Infektion soll ggf. antimykotisch bzw. antibiotisch rechtzeitig behandelt werden.
Messages à retenir
- Pour la prise en charge de la radiomucosite, il est essentiel que l’équipe médicale et infirmière prodigue des soins étroits et continus.
- Il existe un consensus général sur l’importance centrale des soins bucco-dentaires, dont l’application cohérente est plus importante que le choix des moyens utilisés.
- Les soins bucco-dentaires doivent être poursuivis et surveillés jusqu’à ce que toutes les lésions visibles des muqueuses soient guéries.
- Une analgésie adéquate est essentielle en cas de douleurs.
- Une infection cliniquement prouvée doit être traitée avec des antimucosiques ou des antibiotiques en temps utile.
1. Peng, H. et al. A network meta-analysis in comparing prophylactic treatments of radiotherapy-induced oral mucositis for patients with head and neck cancers receiving radiotherapy. Oral Oncol. 75, 89–94 (2017).
2. Milazzo-Kiedaisch, C. A., Itano, J. & Dutta, P. R. Role of Gabapentin in Managing Mucositis Pain in Patients Undergoing Radiation Therapy to the Head and Neck. Clin. J. Oncol. Nurs. 20, 623–628 (2016).
3. Maghami, E., Koyfman, S. A. & Weiss, J. Personalizing Postoperative Treatment of Head and Neck Cancers. Am. Soc. Clin. Oncol. Educ. B. 515–522 (2018). doi:10.1200/EDBK_201087
4. Studer, G; Glanzmann, C; Bredell, M. Kurative Bestrahlung von Kopf-Hals-Tumoren – Toleranzgewinn gegenüber früheren Techniken. info@onkologie (5):7-11 (2013).
5. Aghamohamamdi, A. & Hosseinimehr, S. J. Natural Products for Management of Oral Mucositis Induced by Radiotherapy and Chemotherapy. Integr. Cancer Ther. 15, 60–68 (2016).
6. Rodríguez-Caballero, A. et al. Cancer treatment-induced oral mucositis: a critical review. Int. J. Oral Maxillofac. Surg. 41, 225–238 (2012).
7. Ray-Chaudhuri, A., Shah, K. & Porter, R. J. The oral management of patients who have received radiotherapy to the head and neck region. Br. Dent. J. 214, 387–393 (2013).
8. Krishnatry, R., Nachankar, A. A., Gupta, T. & Agarwal, J. P. Oral Radiation Mucositis: A Short Review. Int. J. Head Neck Surg. 2, 37–43 (2011).
9. Sonis, S. T. A biological approach to mucositis. J. Support. Oncol. 2, 21-32;
discussion 35–6
10. Al-Ansari, S. et al. Oral Mucositis Induced By Anticancer Therapies. Curr. oral Heal. reports 2, 202–211 (2015).
11. Roopashri, G., Jayanthi, K. & Guruprasad, R. Efficacy of benzydamine hydrochloride, chlorhexidine, and povidone iodine in the treatment of oral mucositis among patients undergoing radiotherapy in head and neck malignancies: A drug trail. Contemp. Clin. Dent. 2, 8–12 (2011).
12. Jham, B. C. & Freire, A. R. D. S. Oral complications of radiotherapy in the head and neck. Braz. J. Otorhinolaryngol. 72, 704–708 (2006).
13. Overgaard, J. et al. Five compared with six fractions per week of conventional radiotherapy of squamous-cell carcinoma of head and neck: DAHANCA 6 and 7 randomised controlled trial. Lancet (London, England) 362, 933–40 (2003).
14. Lyhne, N. M. et al. The DAHANCA 6 randomized trial: Effect of 6 vs 5 weekly fractions of radiotherapy in patients with glottic squamous cell carcinoma. Radiother. Oncol. 117, 91–8 (2015).
15. Huguenin, P. et al. Concomitant cisplatin significantly improves locoregional control in advanced head and neck cancers treated with hyperfractionated radiotherapy. J. Clin. Oncol. 22, 4665–73 (2004).
16. Scully, C., Epstein, J. & Sonis, S. Oral mucositis: A challenging complication of radiotherapy, chemotherapy, and radiochemotherapy. Part 2: Diagnosis and management of mucositis. Head Neck 26, 77–84 (2004).
17. Shankar, A. et al. Current Trends in Management of Oral Mucositis in Cancer Treatment. Asian Pac. J. Cancer Prev. 18, 2019–2026 (2017).
18. Mallick, S., Benson, R. & Rath, G. K. Radiation induced oral mucositis: a review of current literature on prevention and management. Eur. Arch. Oto-Rhino-Laryngology 273, 2285–2293 (2016).
19. de Freitas Cuba, L., Salum, F. G., Cherubini, K. & de Figueiredo, M. A. Z. Antioxidant agents: a future alternative approach in the prevention and treatment of radiation-induced oral mucositis? Altern. Ther. Health Med. 21, 36–41
20. Maria, O. M., Eliopoulos, N. & Muanza, T. Radiation-Induced Oral Mucositis. Front. Oncol. 7, 89 (2017).
21. González Ferreira, J. A., Jaén Olasolo, J., Azinovic, I. & Jeremic, B. Effect of radiotherapy delay in overall treatment time on local control and survival in head and neck cancer: Review of the literature. Reports Pract. Oncol. Radiother. J. Gt. Cancer Cent. Pozn. Polish Soc. Radiat. Oncol. 20, 328–39 (2015).
22. Dörr, W., Dölling-Jochem, I., Baumann, M. & Herrmann, T. [The therapeutic management of radiogenic oral mucositis]. Strahlenther. Onkol. 173, 183–92 (1997).
23. Aghamohamamdi, A. & Hosseinimehr, S. J. Natural Products for Management of Oral Mucositis Induced by Radiotherapy and Chemotherapy. Integr. Cancer Ther. 15, 60–68 (2016).
24. Zeynep Gural, S. B. Y., Gural, Z., Sahin, B. & Kadioglu, H. Oral Mucositis:
A Crucial Problem during Radiation Therapy. J. Trauma Treat. 04, 1–3 (2014).
25. Chitapanarux, I. et al. Randomized control trial of benzydamine HCl versus sodium bicarbonate for prophylaxis of concurrent chemoradiation-induced oral mucositis. Support. Care Cancer 26, 879–886 (2018).
26. Höller, U. & Schubert, T. Supportive Therapie in der Radioonkologie. Der Onkol. 21, 318–322 (2015).
27. Thomsen, M. & Vitetta, L. Adjunctive Treatments for the Prevention of Chemotherapy- and Radiotherapy-Induced Mucositis. Integr. Cancer Ther. 17, 1027–1047 (2018).
28. Amanat, A., Ahmed, A., Kazmi, A. & Aziz, B. The Effect of Honey on Radiation-induced Oral Mucositis in Head and Neck Cancer Patients. Indian J. Palliat. Care 23, 317–320 (2017).
29. Cho, H. K., Jeong, Y. M., Lee, H. S., Lee, Y. J. & Hwang, S. H. Effects of honey on oral mucositis in patients with head and neck Cancer: A meta-analysis. Laryngoscope 125, 2085–2092 (2015).
30. Riesenbeck, D., Reimann, P. & Adamietz, I. A. Prophylaxe und Behandlung von Nebenwirkungen der Strahlentherapie. Der Onkol. 19, 267–278 (2013).
31. Giusti, R. et al. The use of fentanyl in pain management in head and neck cancer patients: a narrative review. Br. J. Pain 12, 155–162 (2018).
32. Tung-Chieh Chang, J. et al. Transdermal Fentanyl for Pain Caused by Radiotherapy in Head and Neck Cancer Patients Treated in an Outpatient Setting: A Multicenter Trial in Taiwan. doi:10.1093/jjco/hyp166
33. Devi, S. & Singh, N. Dental care during and after radiotherapy in head and neck cancer. Natl. J. Maxillofac. Surg. 5, 117 (2014).
34. Ramirez-Amador, V., Silverman, S., Mayer, P., Tyler, M. & Quivey, J. Candidal
colonization and oral candidiasis in patients undergoing oral and pharyngeal radiation therapy. Oral Surgery, Oral Med. Oral Pathol. Oral Radiol. Endodontology 84, 149–153 (1997).
35. Panghal, M., Kaushal, V., Kadayan, S. & Yadav, J. P. Incidence and risk factors for infection in oral cancer patients undergoing different treatments protocols. BMC Oral Health 12, 22 (2012).
36. Nicolatou-Galitis, O. et al. Effect of fluconazole antifungal prophylaxis on oral mucositis in head and neck cancer patients receiving radiotherapy. Support. Care Cancer 14, 44–51 (2006).
37. Mücke, R. et al. Fluconazole prophylaxis in patients with head and neck tumors undergoing radiation and radiochemotherapy. Mycoses 41, 421-423 (1998).
38. Rao, NG et al. Effect of prophylactic fluconazole on oral mucositis and candidiasis during radiation therapy for head-and-neck cancer. Pract. Radiat. Oncol. 3, 229-233 (2013).
39. Bamps, M., Dok, R. & Nuyts, S. Low Level Laser Therapy Stimulates Proliferation in Head and Neck Squamous Cell Carcinoma Cells. Front. Oncol. 8, 343 (2018).
info@onco-suisse
- Vol. 9
- Ausgabe 3
- Juni 2019