- Systemtherapie des hepatozellulären und cholangiozellulären Karzinoms
Während beim hepatozellulären Karzinom in den letzten beiden Jahren mit der Kombination Atezolizumab und Bevacizumab eine neue Empfehlung für die Erstlinientherapie herausgekommen ist, konnten beim cholangiozellulären Karzinom noch keine wesentlichen Durchbrüche registriert werden. Der folgende Beitrag fasst die derzeitigen Erkenntnisse zur Systemtherapie zusammen.
Alors que pour le carcinome hépatocellulaire, une nouvelle recommandation pour le traitement de première ligne est apparue ces deux dernières années avec l’association atezolizumab et bevacizumab, aucune avancée significative n’a encore été enregistrée pour le carcinome cholangiocellulaire. L’article suivant résume les résultats actuels de la thérapie systémique.
Hepatozelluläres Karzinom (HCC)
Seit Einführung des Thyrosinkinasehemmers (TKIs) Sorafenib, und später von Lenvatinib, hat sich die Therapielandschaft in der Erstlinientherapie des HCCs bis 2020 wenig verändert.
Phase-II-Studienresultate mit Checkpoint-Inhibitoren haben grosse Hoffnungen in die Immunoonkologie (I-O) gesetzt. Die ersten randomisierten Studien in der Erstlinientherapie (CheckMate 459: Nivolumab versus Sorafenib), als auch in der Zweitlinientherapie (KEYNOTE-240: Pembrolizumab versus Plazebo) haben jedoch enttäuscht: eine therapeutische Überlegenheit eines I-O-Medikaments konnte nicht nachgewiesen werden. Die Vorteile der I-O-Therapie, nämlich eine deutlich bessere Verträglichkeit und eine verbesserte Lebensqualität gegenüber einem TKI, haben für eine Zulassung als I-O-Monotherapie nicht ausgereicht.
Seit Juni 2020 empfiehlt die ESMO erstmalig eine Kombinationstherapie bestehend aus Atezolizumab und Bevacizumab, neben den beiden TKIs Sorafenib und Lenvatinib, als präferenzierte Erstlinientherapien auf der höchsten Evidenzstufe (I,A).
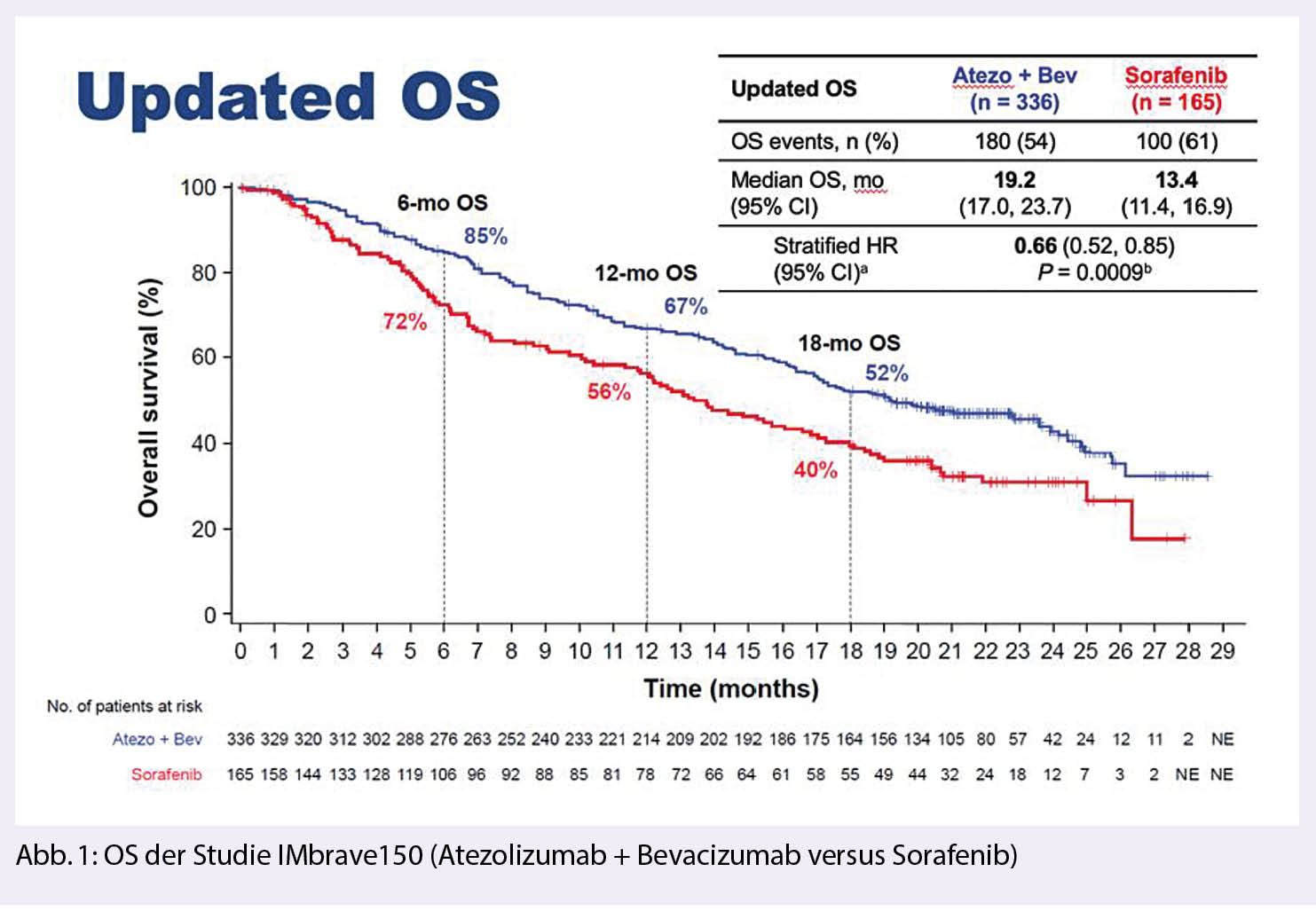
Die Therapieempfehlung für die Kombinationstherapie mit Atezolizumab und Bevacizumab basiert auf den Resultaten der IMbrave150-Studie (1), welche 501 nicht systemisch vorbehandelte Patienten mit fortgeschrittenem HCC (80% BCLC-Stadium C, 20% BCLC-Stadium B) mit erhaltener Leberfunktion (Child-Pugh A) eingeschlossen hat. Die Randomisierung erfolgte im 2:1-Verhältnis in Atezolizumab und Bevacizumab zu Sorafenib. Vor Studieneinschluss wurden zahlreiche HCC-spezifische Ausschlusskriterien abgefragt. Hervorzuheben sind folgende: Patienten mit viel, bzw. rasch rezidivierendem Aszites wurden ausgeschlossen. Zudem waren eine obere Panendoskopie und eine bestmögliche Behandlung aller Varizen erforderlich. Patienten mit chronischer Hepatitis B-Infektion erhielten eine antivirale Medikation, die mindestens 14 Tage vor Therapiestart eingeleitet wurde.
In der Überlebensanalyse zeigte sich eine statistisch signifikante Überlegenheit (HR 0.66) von Atezolizumab und Bevacizumab gegenüber Sorafenib (Abb. 1).
Mehr Patienten in der Sorafenib-Gruppe erhielten nach Tumorprogress weitere Systemtherapien (52%), inkl. I-O-Therapien, gegenüber den Patienten in der Atezolizumab und Bevacizumab-Gruppe (36%), die nachfolgend vorwiegend mit TKIs behandelt wurden.
Der Überlebensvorteil von Atezolizumab und Bevacizumab basiert auf einer längeren progressionsfreien Zeit (7 versus 4 Monate, HR 0.65) und einer höheren Tumoransprechrate gemäss RECIST 1.1 (30% versus 11%). Die mediane Behandlungszeit war demzufolge deutlich länger unter Atezolizumab und Bevacizumab (8 und 7 Monate), als unter Sorafenib (3 Monate).
Bezogen auf behandlungsassoziierte Grad-3- und -4-Toxizitäten ergaben sich keine deutlichen Unterschiede (43%/46%). Das Nebenwirkungsspektrum zeigte hingegen Unterschiede: Hypertension, Proteinurie, Pyrexie traten häufiger unter Atezolizumab und Bevacizumab auf; hingegen dominierte eine Diarrhoe, eine Appetitminderung und ein Hand-Fuss-Syndrom unter Sorafenib. Blutungen traten bei 7% bzw. 5% der Patienten auf.
Viele Patienten erhalten seither die Therapie mit Atezolizumab und Bevacizumab. Es ist zu wünschen, dass diese Behandlung, wie auch nachfolgende Therapiesequenzen innerhalb des SAKK-Registers für Immuntherapien (AlpineTIR) verfolgt werden können. Durch den Einsatz einer I-O-Therapie verschieben sich die nachfolgenden Therapien jeweils um eine Linie. Diese Neuanordnung der Behandlungsabfolge, welche von der ASCO empfohlen wird (3), erfordert eine Neuüberprüfung der Wirksamkeit der TKIs nach Vorbehandlung mit I-O-Therapien.
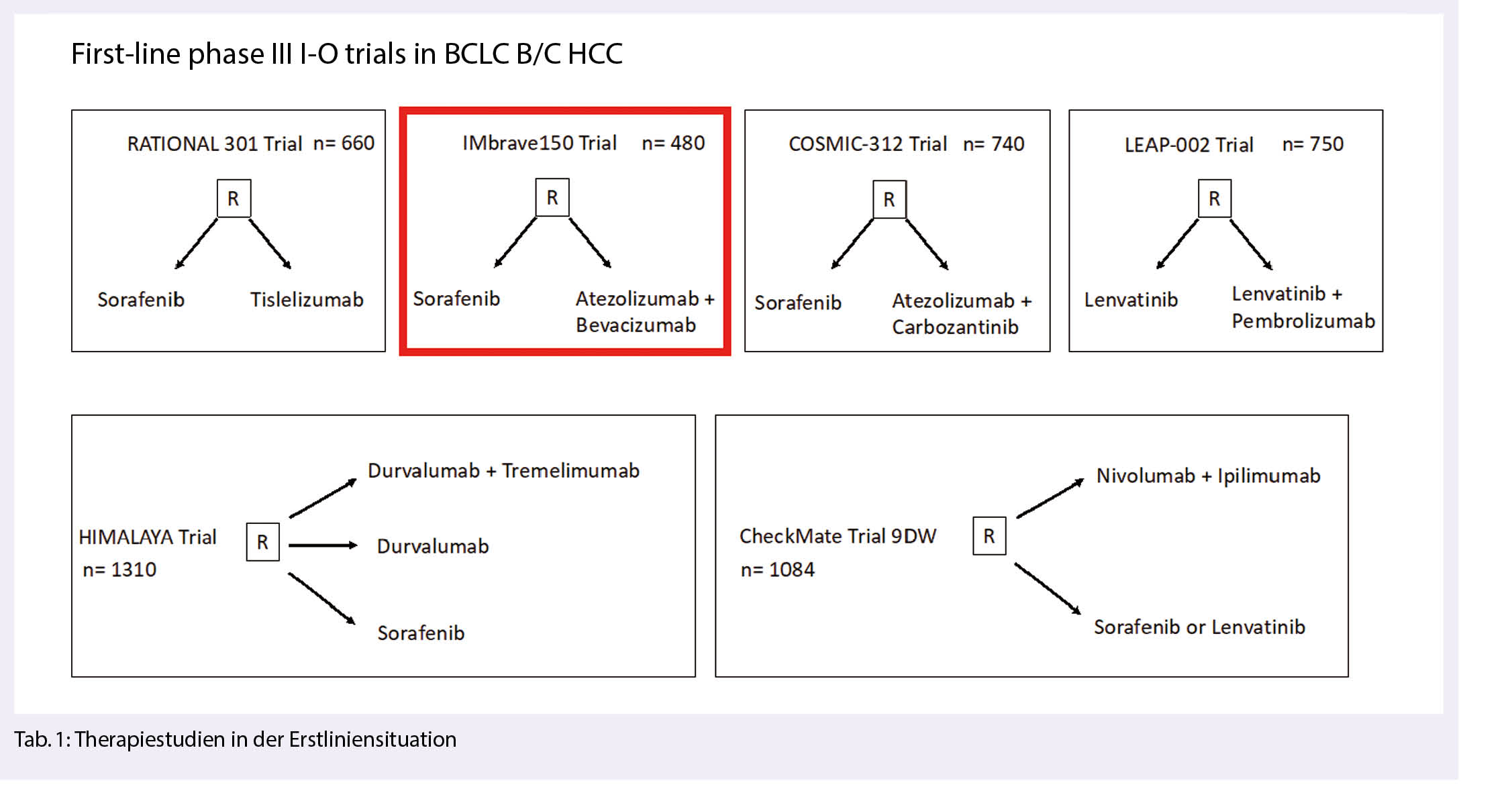
In naher Zukunft wird es weitere Erkenntnisse aus grossen Therapiestudien in der Erstliniensituation geben.
Einen Überblick hierzu gibt Tabelle 1: Interessant sind dabei Kombinationen aus I-O und TKIs, sowie I-O-Kombinationen.
Ferner werden I-O-Therapien auch in 4 grossen adjuvanten Studien (CheckMate 209-9DX, EMERALD-2, Keynote-937, und IMbrave050) entweder als Monotherapie, oder als Kombinationstherapien studiert.
Cholangiozelluläres Karzinom (CCA)
Gallenwegs-, respektive cholangiozelluläre Karzinome (CAA) sind ein Sammelbegriff für klinisch und biologisch heterogene Tumore. Abgesehen von CCA im frühen Tumorstadium ist die Prognose schlecht. Nach Tumorresektion ist eine adjuvante Chemotherapie mit Capecitabine über 6 Monate gemäss BilCAP-Studie (4) ein Behandlungsstandard. Bei R1-Resektion kommt auch eine Radiochemotherapie in Frage.
In der Palliativsituation wird bei Patienten in gutem Allgemeinzustand (ECOG 0-1) eine Chemotherapie mit Cisplatin und Gemcitabine durchgeführt. Diese Behandlung basiert auf einer längeren medianen Lebensdauer (12 versus 8 Monate) unter dieser Kombinationschemotherapie, verglichen mit einer Gemcitabine-Monotherapie in einer randomisierten Studie (5). Eine Monotherapie mit Gemcitabine wird bei eingeschränktem Allgemeinzustand bevorzugt. Die progressionsfreie Zeit in der ABC-02 Studie (5) war bei einer Therapiedauer von bis zu 6 Monaten verlängert (8 versus 5 Monate). Die Tumoransprechrate lag bei 27% versus 16%.
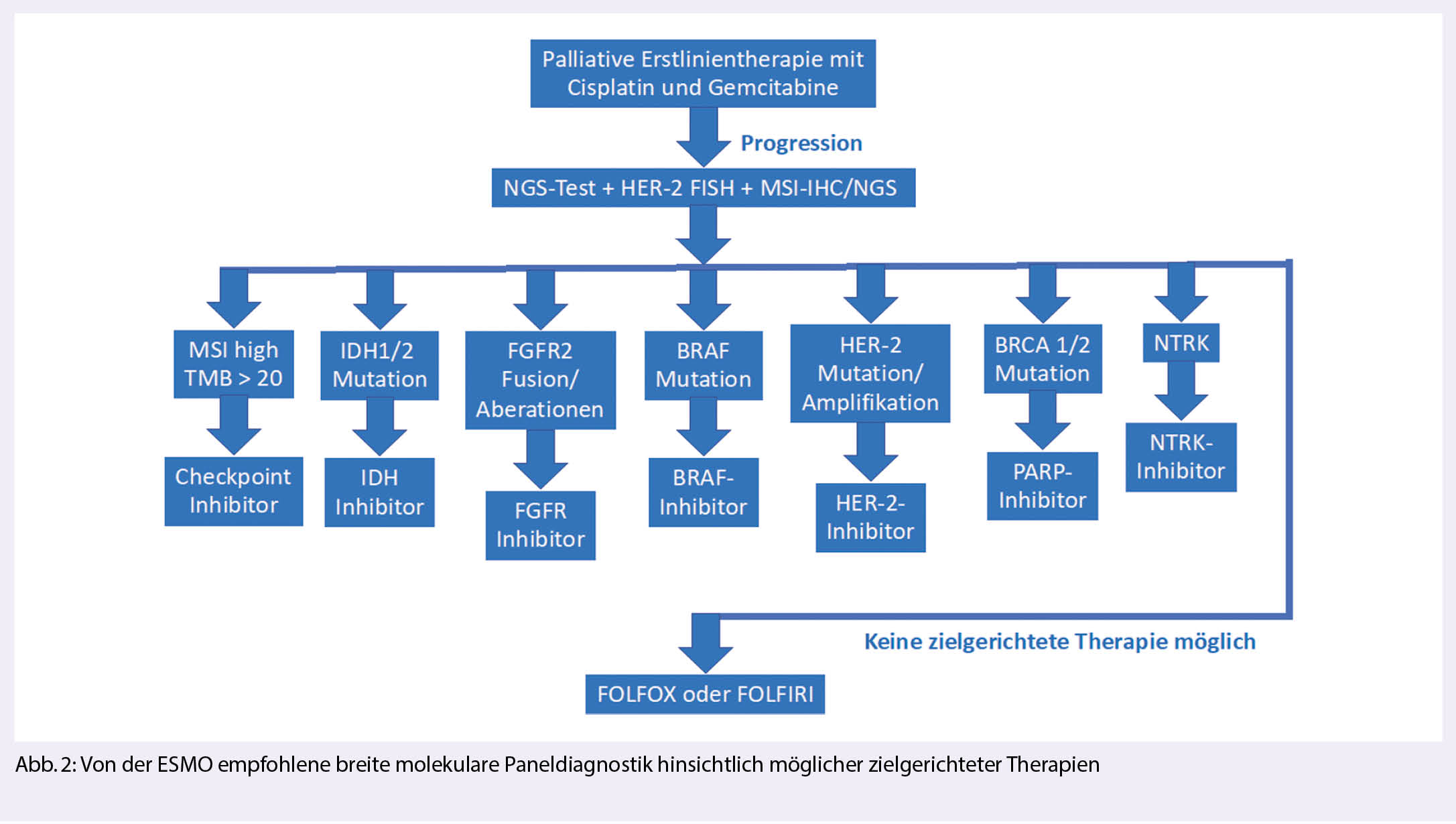
Nach Progression unter bzw. nach der Erstlinientherapie wird frühzeitig von der ESMO eine breite molekulare Paneldiagnostik empfohlen (6), da bei ca. 50% eine prädiktive Veränderung gefunden wird, die eine zielgerichtete Therapie ermöglicht (Abb. 3; abgewandelt von (7)).
Abbildung 2 zeigt die einzelnen Therapieoptionen. Die Verteilung der einzelnen prädiktiven Veränderungen ist abhängig von der Primärlokalisation der Tumore. Beim intrahepatischen CCA dominieren FGFR-1-3-Fusionen oder Rearrangements, sowie IDH 1/2 Mutationen. HER-2-Amplifikationen und BRAF-Mutationen finden sich hingegen gehäuft beim Gallenblasenkarzinom.
In einer Phase III-Studie (8) bei IDH1-mutierten, prädominanten intrahepatischen CCAs konnte der IDH-Inhibitor Ivosidenib gegenüber Placebo ein verlängertes PFS (HR 0.37) nachweisen. 70% der Patienten im Plazeboarm erhielten im weiteren Verlauf Ivosidenib, weswegen kein statistisch signifikanter Überlebensvorteil nachweisbar war. Das gut verträgliche Medikament lässt sich aktuell leider nur in einem «for charge program» via Clinigen beziehen.
Pemigatinib (Pemazyre) ist ein Vertreter von FGFR-Inhibitoren, die in Phase II-Studien eine gute Tumorwirksamkeit bei Patienten mit CCA- und FGFR2-Fusionen oder Rearrangements zeigen. Pemigatinib wurde von der FDA als erstes zielgerichtetes Medikament zur Behandlung des CCAs zugelassen und hat einen «Orphan Statuts» der EMA. Es ist als «Named Patient Programm» in der zweiten Therapielinie verfügbar. Drei FGFR-Inhibitoren (Pemigatinib, Infigratinib und Futibatinib) werden aktuell in Phase III-Studien in der Erstlinientherapie gegenüber einer Chemotherapie mit Cisplatin und Gemcitabine untersucht.
Alle weiteren zielgerichteten Therapien basieren auf Phase II-Studienevidenz. Checkpoint-Inhibitoren zeigten bislang bei unselektionierten Patienten eine geringe Wirksamkeit, ausgenommen bei Patienten mit mikrosatelliteninstabilen CCAs.
Nur wenn keine zielgerichtete Therapie möglich ist, wird eine palliative Zweitlinienchemotherapie mit FOLFOX oder FOLFIRI empfohlen.
Copyright bei Aerzteverlag medinfo AG
St. Claraspital AG
Tumorzentrum
Kleinriehenstrasse 30
4058 Basel
tumorzentrum@claraspital.ch
Advisory-Board-Teilnahme Roche und BMS.
1. Finn RS et al. Atezolizumab plus Bevacicizumab in unresectable hepatocellular carcinoma. NEJM 2020;382:1894-95
2. Finn RS et al. IMbrave150: updated overall survival data from a global, randomized, open-label Phase III study of atezolizumab + bevacizumab vs sorafenib in patients with unresectable hepatocellular carcinoma. ASCO GI 2021. Abstract 267
3. Gordan JD et al. Systemic therapy for advanced hepatocellular carcinoma: ASCO guideline. J Clin Oncol 2020 (36):4317-45
4. Primrose JN et al: Capecitabine compared with observation in resected biliary tract cancer (BILCAP): a randomized, controlled, multicentre, phase 3 study. Lancet Oncol 2019 (5): 663-673
5. Lamaraca A et al. Second-line FOLFOX chemotherapy versus active symptom control for advanced biliary tract cancer (ABC-06): a phase 3, open-label, randomized, controlled trial. Lancet Oncol 2021; 1:690-701
6. Mosele F et al: Recommendations for the use of next-generation sequencing (NGS) for patients with metastatic cancers: a report from the ESMO Precision Medicine Working Group. Ann Oncol 2020;11:1491-1505
7. Harsha Tella S et al: Second-line therapies in advanced biliary tract cancers. Lancet Oncol 2020;21(1):e29-e41
8. Abou-Alfa GK et al: Ivosidenib in IDH1-mutant, chemotherapy-refractory cholangiocarcinoma (ClarIDHy): a muticentre, randomized, double-blind, placebo-controlled, phase 3 study. Lancet Oncol 2020;21(6): 796-807
info@onco-suisse
- Vol. 11
- Ausgabe 3
- Juni 2021