- Systemtherapie in der Behandlung des Nasopharynxkarzinoms
Die Inzidenz des Nasopharynxkarzinoms (NPC) ist in den verschiedenen Teilen der Welt sehr unterschiedlich, wobei das nicht-keratinisierte NPC am häufigsten vorkommt. Zu den klinischen Symptomen gehören Nasenatmungsbehinderung, Epistaxis, Kopfschmerzen, Hörverlust oder Ausfall der kranialen Nerven, und die Patienten weisen häufig eine Lymphadenopathie in einem bereits lokal fortgeschrittenen Stadium auf. Die wichtigste Behandlungsmodalität in kurativen Situationen ist die Radiotherapie, die in den frühen Stadien allein und in den lokal fortgeschrittenen Stadien in Kombination mit der Chemotherapie eingesetzt wird. Die Chirurgie spielt im primär kurativen Konzept kaum eine Rolle, wohl aber bei regionalen Rezidiven oder Persistenz in den Lymphknoten nach RCT. Im Fall eines lokalen oder regionären Rezidivs soll die Möglichkeit einer Salvage-Operation oder einer Re-Bestrahlung evaluiert werden. Sollte keine solche Option bestehen, ist eine palliative Systemtherapie indiziert.
The incidence of nasopharyngeal carcinoma (NPC) varies widely in different parts of the world, with non-keratinized NPC being the most common. Clinical symptoms include nasal obstruction, epistaxis, headache, hearing loss or cranial nerve loss, and patients often present with lymphadenopathy at a locally advanced stage. The most important treatment modality in curative situations is radiotherapy, which is used alone in the early stages and in combination with chemotherapy in the locally advanced stages. Surgery hardly plays a role in the primary curative concept, but it does in the case of regional recurrence or persistence in the lymph nodes after RCT. In the case of local or regional recurrence, the possibility of salvage surgery or re-radiation should be evaluated. If no such option is available, palliative systemic therapy is indicated.
Key Words: Nasophyryngeal carcinoma, chemotherapy, Systemic Therapy
Epidemiologie
Die Inzidenz des Nasopharynxkarzinoms (NPC) unterscheidet sich stark in verschiedenen Teilen der Welt: in den Hochrisikoregionen Asiens kann sie bis 20/100‘000 Einwohner/Jahr erreichen, in Europa und den USA beträgt sie um 0.5-2/100‘000/Jahr (1). Die Rolle der Infektion und der malignen Transformation durch Epstein-Barr-Virus ist unbestritten; vermutlich tragen die noch unklaren genetischen Faktoren zu der hohen Inzidenz in den Hochrisikoregionen Asiens bei (2).
Sowohl die Inzidenz als auch die Mortalität nehmen ab, was vermutlich auf mehrere verschiedene Faktoren zurückzuführen ist: Fortschritte in der Diagnostik, Entwicklung und Verbesserung der multimodalen, Stadium- und Rezidivrisiko adaptierten Therapiestrategien sowie verbessertes Screening in endemischen Gebieten.
Pathologie
Die Nasopharynxkarzinome werden in keratinisierte, nicht-keratinisierte und basaloide Subtypen aufgeteilt. Am häufigsten ist das nicht keratinisierte NPC (>95% in Hochrisikoregionen), welches mit einer EBV-Infektion assoziiert ist. Der nicht keratinisierte Subtyp wird in die differenzierte und de-differenzierte Gruppe unterteilt.
Klinik und Diagnosestellung
Die häufigsten klinischen Symptome umfassen Obstruktion der Nasenatmung, Epistaxis, Kopfschmerzen, Hörminderung oder Ausfall der kranialen Nerven. Häufig präsentieren sich die Patienten im bereits lokal fortgeschrittenen Stadium mit einer Lymphadenopathie. NPC erweist deutlich höhere Raten an Fernmetastasierung verglichen mit den Plattenepithelkarzinomen des Kopf-Hals-Bereichs (HNPCC).
Die Abklärung und Diagnosestellung erfolgt durch Anamnese und klinische Untersuchung inklusive Kontrolle von Hirnnerven, Fiberendoskopie mit Biopsie sowie eine Halssonographie inklusive eine FNP der verdächtigen Lymphknoten. Zur Beurteilung der Tumorausdehnung und des Lymphknotenstatus ist MR die sensitivste Untersuchung. Ein CT mit Kontrastmittel kann zusätzliche Informationen betreffend der Knocheninfiltration geben. Die Suche nach Metastasen mit einem PET-CT soll schon in frühen Stadien, auf jeden Fall bei nodal-positiven Tumoren, durchgeführt werden. Auf dem Tumorgewebe soll die EBV-DNA (EBER-ISH) bestimmt werden.
Staging und Stellenwert der DNA-Bestimmung
Das Staging erfolgt gemäss der 8. Ausgabe des UICC/AJCC Staging Systems. In grossen Zentren in endemischen Gebieten ist die EBV-DNA-Bestimmung im Plasma im Rahmen des Screenings bei der Hochrisiko-Population (Männer im Alter zwischen 50 und 59 Jahren) getestet worden. Bei 20’000 gesunden, asymptomatischen Menschen wurde in Plasma EBV DNA gemessen und bei wiederholt erhöhten Werten ein MR und eine Endoskopie durchgeführt. Bei 34 Personen wurde ein NPC diagnostiziert. Die Diagnose wurde in früheren Stadien als in den historischen Kohorten detektiert, wodurch die Prognose verbessert werden konnte (3).
Des Weiteren wird untersucht, ob der prätherapeutische EBV-DNA Titer das klinisch-anatomische Staging ergänzen kann, um die Therapie dem Rezidivrisiko besser anzupassen.
Dazu konnte gezeigt werden, dass der fehlende Abfall nach der Induktionstherapie bzw. nach der Radiotherapie prognostisch ungünstig ist. In den klinischen Studien wird eine De-Eskalation oder Eskalation in Abhängigkeit vom Verlauf des EBV-DNA Titers geprüft. In den nicht-endemischen Gebieten ist die Rolle des EBV-DNA Titers weniger gut untersucht und der Stellenwert ist unklar.
Therapie in kurativen Situationen
Die wichtigste Therapiemodalität in der kurativen Situation ist die Radiotherapie, welche in der Intensität-modulierten Technik (IMRT) mit einer Dosis von 70 Gy in 33-35 Fraktionen (2-2.12 Gy/Fraktion) während 7 Wochen; jeweils 5x pro Woche, verabreicht wird. Radiotherapie wird in den frühen Stadien allein und in den lokal fortgeschrittenen Stadien in Kombination mit der Chemotherapie eingesetzt (4). Aufgrund der Lokalisation bzw. den anatomischen Verhältnissen hat die Chirurgie im primär kurativen Konzept kaum eine Rolle; spielt jedoch eine wichtige Rolle bei den regionären Rezidiven bzw. Persistenz in den Lymphknoten nach der RCT.
Frühe Stadien: Radiotherapie
Das Stadium T1N0 wird mit alleiniger Radiotherapie behandelt. Im Stadium T2N0 wird eine zusätzliche konkomitierende Chemotherapie nicht empfohlen. Verschiedene Richtlinien (CSCO/ASCO, ESMO, NCCN) empfehlen jedoch, dass in diesem Stadium eine Chemotherapie in Einzelfällen evaluiert werden soll, falls bestimmte Risikofaktoren wie bulky disease oder hohe EBV-DNA Titer vorliegen (5, 6).
Lokal fortgeschrittenes NPC (LANPC): Konkomitierende Radiochemotherapie
Bei mehr als 70% der Patienten besteht bei der Diagnosestellung bereits ein lokal fortgeschrittenes Stadium. Das neueste Update der Metaanalyse von 26 Studien mit insgesamt 7080 Patienten mit LA-NPC und mit einer medianen Beobachtungszeit von 7.4 Jahren wurde im 2022 publiziert. Bei 44.9% der Patienten bestand ein Stadium III und bei 46.5% ein Stadium IV. Bei grosser Mehrheit (97%) bestand der nicht-keratinisierende Subtyp. Wie bereits in einer früheren Publikation der gleichen Metaanalyse gezeigt werden konnte, ergab sich, dass eine Chemotherapie konkomitierend zu einer Radiotherapie verabreicht (mit oder ohne zusätzliche adjuvante Chemotherapie) im Vergleich zu einer alleinigen RT zu einer signifikanten Verbesserung des Gesamtüberlebens führt (HR 0.80 [95%CI 0.70-0.93]) (7). Wird die Chemotherapie ausschliesslich neoadjuvant oder adjuvant verabreicht, wird das Gesamtüberleben nicht verbessert: HR 0.87[0.68-1.12] für adjuvante Chemotherapie, bzw. HR 0.96 [0.80.1.16] für IC. Eine Subgruppenanalyse zeigte, dass der Benefit mit zunehmendem Alter abnimmt.
Somit ist die konkomitierende Radiochemotherapie der wichtigste Bestandteil und der Standard in der kurativen Behandlung des LANPCs. Bezüglich der Wahl des Chemotherapeutikums gilt Cisplatin als Standard. Gemäss den CSCO/ASCO-Richtlinien werden zwei Schemata – Cisplatin 100 mg/m2 alle 3 Wochen für insgesamt 3 Zyklen, oder Cisplatin wöchentlich 40 mg/m2 während der ganzen Bestrahlung – mit der gleichen Evidenzstärke empfohlen (evidence quality «high»; strength of recommendation «strong») (6). ESMO-Guidelines empfehlen Cisplatin q3w mit höherer Evidenzstärke [IA] als Cisplatin weekly [IIA] (5). Dazu empfehlen die Experten – jedoch als Konsensus und mit tieferer Evidenzstärke – eine minimale kumulative Dosis von Cisplatin von 200 mg/m2 für konkomitierende RCT bzw. 160 mg/m2 falls vor einer RCT eine IC durchgeführt worden ist. Als Alternative für die Patienten, die kein Cisplatin erhalten können, empfehlen die CSCO/ASCO-Guidelines Carboplatin (AUC 5-6 q3w) oder Oxaliplatin (70 mg/m2 wöchentlich), bzw. Nedaplatin welches in Europa nicht verfügbar ist. Bei Patienten mit Kontraindikation für Platinpräparate werden Fluorpyrimidine (5FU, Capecitabine) empfohlen (6).
Welche Patienten profitieren von einer Induktionschemotherapie (IC) vor einer konkomitierenden RCT?
NPC hat deutlich höhere Raten an Fernmetastasierung als HNSCC. Mehrere Studien mit entweder Induktionschemotherapie oder adjuvanter Chemotherapie sind mit dem Ziel einer Therapieintensivierung und Verbesserung des Überlebens durchgeführt worden. Im Vergleich zu adjuvanter Chemotherapie, welche in der Regel schlecht toleriert wird, hat eine Induktionschemotherapie aufgrund der besseren Verträglichkeit höhere Chancen, die Anzahl der Zyklen gemäss Plan verabreichen zu können.
Nachdem mehrere ältere Studien keinen Benefit einer IC vor der definitiven RCT gezeigt hatten, konnte in zwei Studien mit Taxotere, Platin und 5FU (TPF) eine signifikante Verbesserung des Gesamtüberlebens bei Patienten in Stadien III-IVb erreicht werden (8-10). Patienten mit T3/T4N0 Tumoren wurden nicht eingeschlossen. Beide Studien zeigten auch eine Verbesserung des progressionsfreien Überlebens sowie eine signifikante Verbesserung der lokalen und der regionären Kontrolle im IC-Arm.
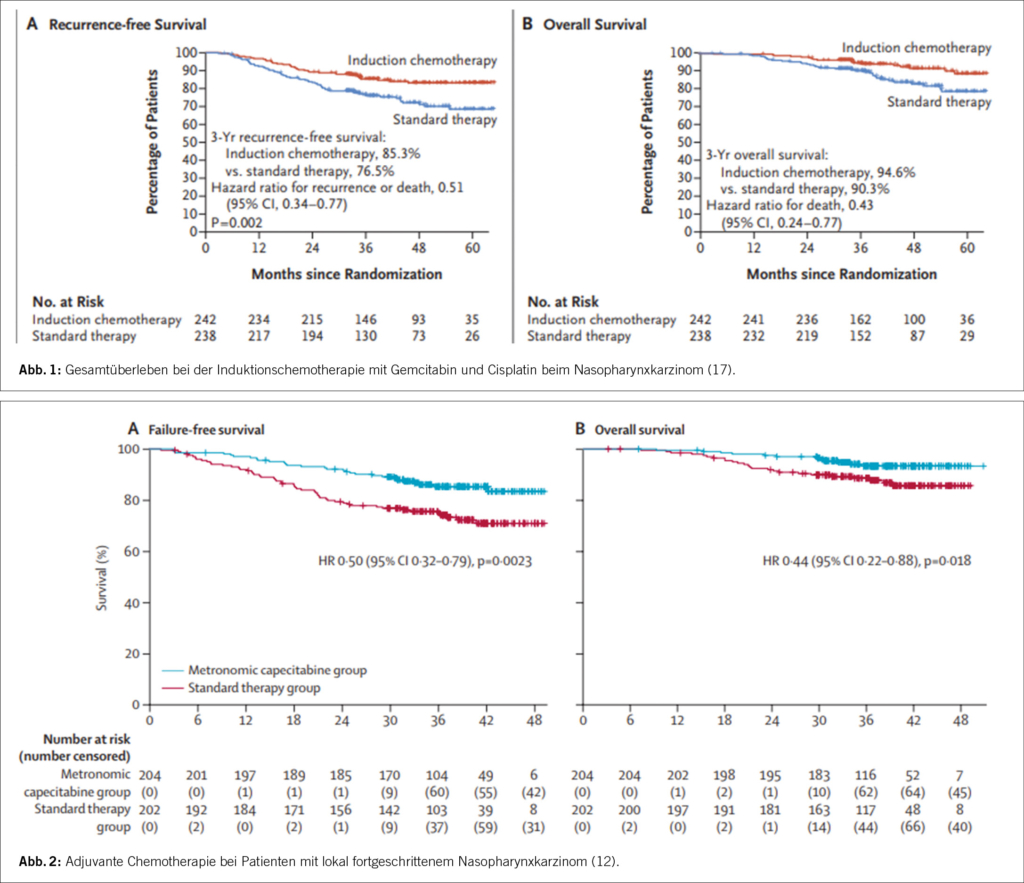
In einer weiteren neoadjuvanten Studie wurden 480 Patienten mit einem NPC im Stadium III-IVb M0 (auch hier unter Ausschluss von T3/T4 N0 Tumoren) in den Standardarm mit der RCT oder in den Studienarm mit 3 Zyklen einer IC mit Cisplatin und Gemcitabin gefolgt von einer RCT randomisiert. Diese Studie zeigte nach einer medianen Beobachtungszeit von 69.8 Monaten eine statistisch signifikante Verbesserung des Gesamtüberlebens (87.9% vs. 78.8%; HR 0.51 [95%CI 0,34-0,78], p=0.001). Das rezidivfreie Überleben war nach drei Jahren 85.3% vs. 76.5% (HR: p=0.001) bei vergleichbarer Spättoxizität. Die Rate der lokoregionären Rezidive wurde nicht verbessert (11).
Wann ist eine adjuvante Chemotherapie sinnvoll?
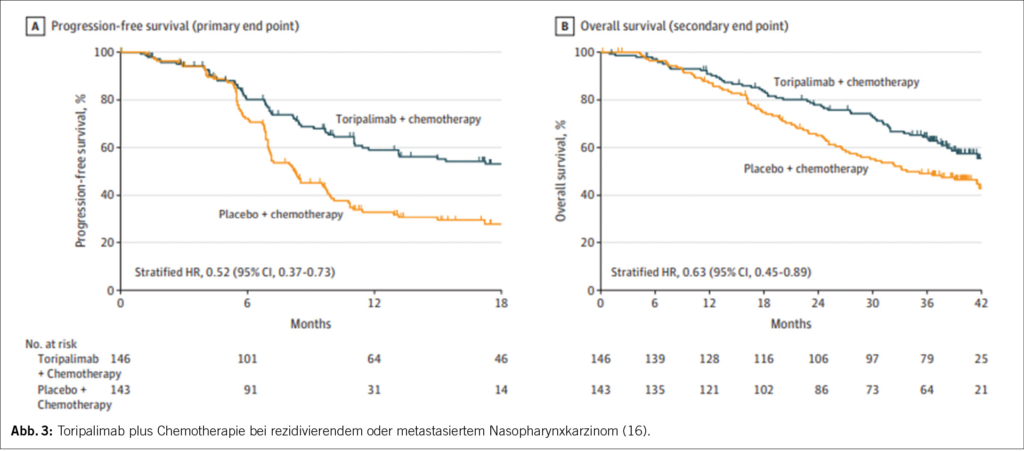
Eine adjuvante Chemotherapie anschliessend an eine konkomitierende Radiochemotherapie wird aufgrund der Toxizität häufig schlecht toleriert. In den meisten älteren Studien wurden Cisplatin und 5FU verabreicht. In der Studie von Chen et al. konnten beispielsweise nur 63% der Patienten die geplanten 3 Chemotherapiezyklen mit Cisplatin und 5FU erhalten und bei 16% wurde die geplante adjuvante Chemotherapie gar nicht begonnen. Diese Studie war negativ (12).
Eine im Jahr 2021 publizierte Studie untersuchte die metronomische adjuvante Chemotherapie mit Capecitabine (650 mg/m2 2x tgl. für insgesamt ein Jahr). Es wurden 408 Patienten im Stadium III-IVa (mit Ausnahme von T3/T4N0 und T3N1) eingeschlossen; die nach dem Abschluss einer RCT in einer kompletten Remission waren. Die Randomisierung erfolgte im Chemotherapie-Arm mit Capecitabine bzw. im Placebo-Arm. Primärer Endpunkt war failure-free survival, welcher nach drei Jahren signifikant höher war im Chemotherapie-Arm (85·3%) als im Standard-Arm (75·7%) (HR 0·50 [95% CI 0·32-0·79]; p=0·0023). Auch das Gesamtüberleben wurde verbessert: nach 3 Jahren waren 93.3% Patienten im Chemotherapie-Arm und 88.6% Patienten im Standardarm am Leben (HR 0.44 [95% CI 0.22–0.88]; p=0.018) (13).
Rezidiviertes und metastasiertes NPC: Systemtherapie und der Stellenwert einer Lokaltherapie
Im Fall eines lokalen oder regionären Rezidivs soll die Möglichkeit einer Salvage-Operation oder einer Re-Bestrahlung evaluiert werden. Sollte keine solche Option bestehen, ist eine palliative Systemtherapie indiziert.
In den letzten Jahren wurden drei Phase-3-Studien publiziert, welche die Rolle von drei verschiedenen anti-PD-1-Inhibitoren in der Erstlinientherapie beim metastasierten NPC geprüft haben. Das Design der Studien war identisch: Die Kombination von einem anti-PD-1 Inhibitor und der Standardchemotherapie mit Cisplatin und Gemcitabin gefolgt von einer Erhaltungstherapie mit dem anti PD-1 Inhibitor wurde verglichen mit der gleichen Chemotherapie und Placebo. Alle drei Studien wurden in den Hochrisikogebieten durchgeführt und haben ihren primären Endpunkt, die Verbesserung des progressionsfreien Überlebens, erreicht.
Die Studie mit Camrelizumab (CAPTAIN-1st) zeigte signifikante Verbesserung vom PFS im Camrelizumab-Arm (9.7 vs. 6.9 Monate, HR 0.54 [95%CI 0.39-0.73]; p<0.001) (14). Die zweite Studie mit gleichem Design, in welcher der anti-PD-1 Antikörper Tislelizumab untersucht wurde (RATIONALE-309), zeigte vergleichbare Ergebnisse: PFS von 9.2 Monaten im Studien-Arm verglichen mit 7.4 Monaten im Kontroll-Arm (HR 0.52 [95%CI 0.38-0.73], p<0.001). Auch die Ansprechraten waren vergleichbar (15).
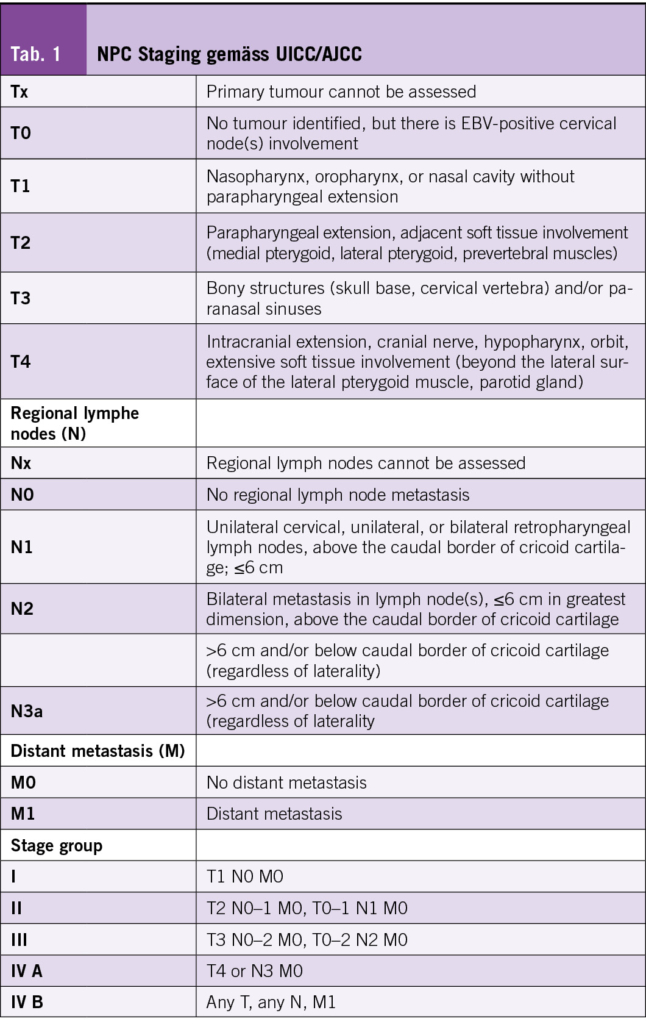
Die Daten für das Gesamtüberleben kommen bis jetzt nur von der Studie mit Toripalimab (JUPITER-2): nach einer Beobachtungszeit von 36 Monaten ist das mediane Gesamtüberleben im Toripalimab-Arm nicht erreicht und im Placebo-Arm 33.7 Monate (HR 0.63, [95% CI, 0.45-0.89]; p = .008). PFS ist auch in dieser Studie verbessert: 21.4 Monate im Toripalimab Arm vs. 8.2 Monate im Placebo Arm; HR 0.52 [95% CI, 0.37-0.73]) (16).
Somit ist die Kombination von Cisplatin und Gemcitabin mit einem der drei Checkpoint-Inhibitoren die wirksamste Therapie, welche den Patienten mit dem metastasierten NPC angeboten werden kann. Leider besteht in der Schweiz für keinen von diesen drei Checkpoint-Inhibitoren eine Zulassung.
Lokale Therapie in primär metastasierter Situation
In einer de novo metastasierten Situation ist eine Systemtherapie die Behandlung der Wahl. Aufgrund der sehr belastenden Symptomatik, die NPC aufgrund seiner Lokalisation verursacht, war eine zusätzliche lokale Therapie immer eine wichtige Fragestellung, die an Tumorboards diskutiert wurde.
Die im JAMA Oncology in 2020 publizierte Studie von You et al. ist dieser Frage nachgegangen. In dieser randomisierten Phase 3 Studie mit 126 Patienten mit de novo metastasiertem NPC sind alle Patienten mit 3 Zyklen Cisplatin und 5FU behandelt worden. Die Patienten, die nach 3 Chemotherapiezyklen ein Ansprechen aufwiesen, sind 1:1 randomisiert worden. Die Patienten im Studienarm sind nach dem Abschluss vom 6. Chemotherapiezyklus mit der RT in der IMRT-Technik behandelt worden. Die Studie hat ihren primären Endpunkt, das Gesamtüberleben, erreicht: Das Gesamtüberleben nach 24 Monaten war 76% im Arm mit der konsolidierenden Radiotherapie und 54% im Arm mit der Chemotherapie allein (HR 0.42 [ 95% CI, 0.23-0.77]; P = .004). Das Progressionsfreie Überleben wurde ebenfalls signifikant verbessert (HR, 0.36; 95% CI, 0.23-0.57).
Copyright bei Aerzteverlag medinfo AG
Kantonsspital St. Gallen, Klinik für Hämatologie
und Onkologie und Brustzentrum
Rorschacherstrasse 95
9007 St. Gallen
Die Autorin hat keinen Interessenskonflikt im Zusammenhang mit diesem Artikel deklariert.
◆ Die Standardtherapie für alle Patienten mit Nasopharynxkarzinom im Stadium III und IV, bei denen keine Kontraindikation besteht, ist eine konkomitierende Radiochemotherapie. Bei ausgewählten Patienten in Stadium II, die Risikofaktoren aufweisen, kann eine Radiochemotherapie evaluiert werden. Dabei ist die Therapie der Wahl Cisplatin wöchentlich (40 mg/m²) oder alle drei Wochen 100mg/m².
◆ Die Induktionstherapie mit Cisplatin und Gemcitabin führt bei Patienten im Stadium III und IV (ausgenommen T3/4N0) zu einer Verbesserung von OS und RFS. Die lokoregionäre Kontrolle wird aber nicht verbessert.
◆ Die adjuvante metronomische Chemotherapie mit Capecitabin hat bei Patienten im Stadium III-IVa (mit Ausnahme von T3/T4N0 und T3N1), die nach dem Abschluss einer RCT in einer kompletten Remission waren, sowohl PFS als auch OS verbessert.
◆ In metastasierten Stadien verbessert die Zugabe von Toripalimab, ein in der EU noch nicht verfügbarer anti-PD-1-Inhibitor, sowohl das PFS als auch das OS. Bei zwei weiteren Checkpoint-Inhibitoren (Camrelizumab und Tislelizumab), die ebenfalls primär in den Studien in China getestet worden sind, konnte eine vergleichbare Verbesserung des PFS, bisher jedoch noch nicht des OS, gezeigt werden. Diese drei Checkpoint-Inhibitoren sind bis jetzt in der EU und in der Schweiz noch nicht zugelassen.
◆ Beim de novo-metastasierten NPC verbessert die Radiotherapie des Primärtumors und der Lymphabflusswege zusätzlich zu einer Systemtherapie sowohl OS als auch PFS.
1 Sung H, Ferlay J, Siegel RL et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin 2021; 71 (3): 209-249.
2 Chua MLK, Wee JTS, Hui EP et al. Nasopharyngeal carcinoma. Lancet 2016; 387 (10022): 1012-1024.
3 Chan KCA, Woo JKS, King A et al. Analysis of Plasma Epstein-Barr Virus DNA to Screen for Nasopharyngeal Cancer. N Engl J Med 2017; 377 (6): 513-522.
4 Zhang B, Mo Z, Du W et al. Intensity-modulated radiation therapy versus 2D-RT or 3D-CRT for the treatment of nasopharyngeal carcinoma: A systematic review and meta-analysis. Oral Oncol 2015; 51 (11): 1041-1046.
5 Bossi P, Chan AT, Licitra L et al. Nasopharyngeal carcinoma: ESMO-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up(dagger). Ann Oncol 2021; 32 (4): 452-465.
6 Chen YP, Ismaila N, Chua MLK et al. Chemotherapy in Combination With Radiotherapy for Definitive-Intent Treatment of Stage II-IVA Nasopharyngeal Carcinoma: CSCO and ASCO Guideline. J Clin Oncol 2021; 39 (7): 840-859.
7 Blanchard P, Lee AWM, Carmel A et al. Meta-analysis of chemotherapy in nasopharynx carcinoma (MAC-NPC): An update on 26 trials and 7080 patients. Clin Transl Radiat Oncol 2022; 32: 59-68.
8 Sun Y, Li WF, Chen NY et al. Induction chemotherapy plus concurrent chemoradiotherapy versus concurrent chemoradiotherapy alone in locoregionally advanced nasopharyngeal carcinoma: a phase 3, multicentre, randomised controlled trial. Lancet Oncol 2016; 17 (11): 1509-1520.
9 Li WF, Chen NY, Zhang N et al. Concurrent chemoradiotherapy with/without induction chemotherapy in locoregionally advanced nasopharyngeal carcinoma: Long-term results of phase 3 randomized controlled trial. Int J Cancer 2019; 145 (1): 295-305.
10 Frikha M, Auperin A, Tao Y et al. A randomized trial of induction docetaxel-cisplatin-5FU followed by concomitant cisplatin-RT versus concomitant cisplatin-RT in nasopharyngeal carcinoma (GORTEC 2006-02). Ann Oncol 2018; 29 (3): 731-736.
11 Zhang Y, Chen L, Hu GQ et al. Final Overall Survival Analysis of Gemcitabine and Cisplatin Induction Chemotherapy in Nasopharyngeal Carcinoma: A Multicenter, Randomized Phase III Trial. J Clin Oncol 2022: JCO2200327.
12 Chen L, Hu CS, Chen XZ et al. Adjuvant chemotherapy in patients with locoregionally advanced nasopharyngeal carcinoma: Long-term results of a phase 3 multicentre randomised controlled trial. Eur J Cancer 2017; 75: 150-158.
13 Zhou H, Lu T, Guo Q et al. Effects of oral maintenance chemotherapy and predictive value of circulating EBV DNA in metastatic nasopharyngeal carcinoma. Cancer Med 2020; 9 (8): 2732-2741.
14 Yang Y, Qu S, Li J et al. Camrelizumab versus placebo in combination with gemcitabine and cisplatin as first-line treatment for recurrent or metastatic nasopharyngeal carcinoma (CAPTAIN-1st): a multicentre, randomised, double-blind, phase 3 trial. Lancet Oncol 2021; 22 (8): 1162-1174.
15 Yang Y, Pan J, Wang H et al. Tislelizumab plus chemotherapy as first-line treatment for recurrent or metastatic nasopharyngeal cancer: A multicenter phase 3 trial (RATIONALE-309). Cancer cell 2023; 41 (6): 1061-1072 e1064.
16 Mai HQ, Chen QY, Chen D et al. Toripalimab Plus Chemotherapy for Recurrent or Metastatic Nasopharyngeal Carcinoma: The JUPITER-02 Randomized Clinical Trial. JAMA 2023; 330 (20): 1961-1970.
info@onco-suisse
- Vol. 14
- Ausgabe 3
- Juni 2024






