- Therapie des Hodgkin Lymphoms: Immuntherapie ersetzt zunehmend Chemo- und Strahlentherapie
Das klassische Hodgkin Lymphom (cHL) ist eine maligne Erkrankung des lymphatischen Systems und tritt in der westlichen Welt mit einer Inzidenz von 2 bis 4 pro 100’000 Einwohnern auf. Erfreulicherweise hat sich die Prognose in den letzten Jahrzehnten deutlich gebessert und heutzutage können insbesondere im jüngeren Alter die meisten Patienten/innen geheilt werden. Ein Grundstein für den Erfolg war die Verfügbarkeit aktiver chemo- und strahlentherapeutischer Behandlungskonzepte und neuerdings immuntherapeutischer Ansätze, insbesondere CD30 basierter Immuntoxine bzw. PD1 spezifischer monoklonaler Antikörper (Mab).
Classical Hodgkin’s lymphoma (cHL) is a malignant disease of the lymphatic system and occurs in the western world with an incidence of 2-4/100,000 inhabitants. Fortunately, the prognosis has improved significantly in recent decades and nowadays most patients can be cured, especially at younger ages. A cornerstone of success has been the availability of active chemo- and radiotherapeutic treatment concepts and more recently immunotherapeutic approaches, in particular CD30-based immunotoxins or PD1-specific monoclonal antibodies (Mab).
Keywords: Hodgkin Lymphom – Immuntoxin – check-point-blockade inhibitor – CD30 Antigen
Die Genese des cHL ist nach wie vor unklar, eine frühere EBV-Infektion wird immer noch als mögliche Ursache diskutiert. Als Ursprungszelle gilt eine entartete B-Vorläuferzelle, die sog. Reed-Sternberg-Zelle (RS) mit typischerweise starker CD30 Antigenexpression. Die bereits seit langem bekannte gestörte Immunreaktion zwischen dieser RS-Zelle und den sie umgebenden T-Zellen konnte inzwischen experimentell belegt werden: Durch Amplifikation des Chromosomenabschnitts 9p24.1 wird das immunsuppressive PD-L1 Molekül auf klassischen RS-Zellen hoch exprimiert und führt durch Interaktion mit dem PD1 Rezeptor auf den umgebenden T-Zellen zu einer T-Zell Anergie (1). Therapeutisch können somit heutzutage sowohl die PD1/PD-L1 Interaktion als auch die starke CD30 Antigenexpression genutzt werden.
Epidemiologie und Klassifikation
Das Hodgkin-Lymphom hat zwei Altersgipfel: Um das 20. Lebensjahr und nach dem 65. Lebensjahr. Männer sind generell häufiger betroffen, aber in der Gruppe der 20-Jährigen erkranken überwiegend Frauen.
Das Hodgkin-Lymphom wird in die 4 Subtypen des klassischen Hodgkin-Lymphoms (cHL) eingeteilt (Tab. 1). Daneben existiert noch das CD20+ noduläre lymphozyten-prädominante Hodgkin-Lymphom (NLPHL), früher noduläres Paragranulom genannt. Die WHO-HAEM5 führt das NLPHL weiterhin in der Familie der Hodgkin Lymphome, schlägt jedoch eine Anpassung der Bezeichnung auf «noduläres, lymphozytenüberwiegendes B-Zell-Lymphom» vor, da die neoplastischen Zellen ein funktionelles B-Zell-Programm aufweisen (2).
Aktuelle Therapiestandards
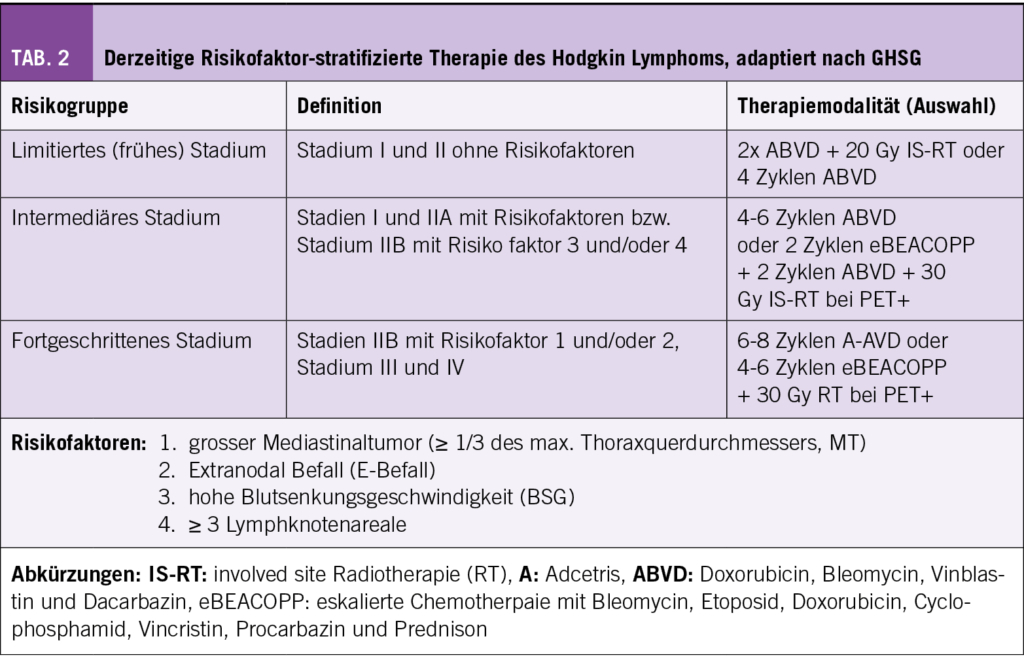
Die Systematik in der cHL Behandlung ist trotz der niedrigen Inzidenzrate beeindruckend fundiert und beruht auf den Ergebnissen mehrerer internationaler Studiengruppen. Ein wesentlicher Grundpfeiler einer Stadien- und Risikofaktor-gerechten Therapie ist dabei eine Erfassung des Ausmasses der Erkrankung gemäss aktueller Lugano Klassifikation (3) und einfach zu bestimmender Blutparameter (z.B. BSG). Da in der Schweiz die meisten Zentren den Empfehlungen der Deutschen Hodgkin Lymphom Studiengruppe (GHSG) in der Erstlinientherapie jüngerer cHL Patienten/innen folgen, möchten wir uns auf diese fokussieren (Tab. 2): Frühe, d.h. lokalisierte Krankheitsstadien werden in der Regel mit einer ABVD Chemotherapie (4 Zyklen) bzw. einer Kombination aus ABVD Chemotherapie (2 Zyklen) und einer Strahlentherapie behandelt. Damit kann ein 5-Jahres Gesamtüberleben (OS) von 98,1% erreicht werden (4).
Patienten/innen mit intermediärem Krankheitsstadium haben zwar häufig eine anatomisch begrenzte Krankheit, weisen aber zusätzliche Risikofaktoren auf (Tab. 2) und sollten daher mit 4-6 Zyklen ABVD Chemotherapie oder 2 Zyklen intensiver Chemotherapie (eBEACOPP) und 2 Zyklen ABVD gefolgt von einer Radiotherapie bei residueller PET-Positivität (Deauville Score ≥ 4) behandelt werden. Die Therapieergebnisse sind auch in diesem Krankheitsstadium exzellent und erreichen ein 5-Jahres Progressions-freies-Überleben (PFS) von 97,3% (5).
Patienten mit fortgeschrittener Erkrankung bedürfen bisher einer noch intensiveren Therapie. Dabei wird häufig entweder gemäss GHSG eine PET-basierte Strategie (HD18 Studie) mit 4-6 Zyklen eBEACOPP (6) oder – favorisiert im amerikanischen Raum – die Kombination aus 6 Zyklen AVD mit dem CD30 spezifischen Immuntoxin Brentuximab Vedotin (BV, Handelsname Adcetris und somit A-AVD Regime gemäss ECHELON-1 Studie) eingesetzt (7). In der HD18 Studie konnte ein 5-Jahres PFS von 91,2 bzw. 93% und in der ECHELON-1 ein 6-Jahres PFS von 82,3% erzielt werden.
Wir sind uns bewusst, dass gerade im fortgeschrittenen Stadium unterschiedliche Therapiealgorithmen fast immer auf einer PET-Untersuchung nach zwei Zyklen (PET2) basierend existieren und De-Eskalationsstrategien bzw. Eskalationsstrategien Anwendung finden. Auch die GHSG stellt sich der Frage einer Toxizitätsreduktion und hat im Rahmen der HD21 Studie eBEACOPP gegen das experimentelle BrECADD Regime getestet (8). Die bisher präsentierten Toxizitätsdaten bestätigen eine geringere Toxizität mit einem deutlich geringeren Transfusionsbedarf, einer geringen Polyneuropathierate und insbesondere auch einer deutlich geringeren Infertilität im BrECADD Arm. Die PFS und OS Daten für die Gesamtpopulation sind weiterhin exzellent, aber noch nicht nach Therapiearmen entblindet.
Entwicklungen
Wie bereits in der Einleitung genannt, weisen die HRS-Zellen durch Amplifikation des Chromosomenabschnitts 9p24.1 eine erhöhte Expression des immunsuppressiven PD-L1/2 Moleküls auf und sind damit kausal für die Anergie PD1 positiver T-Zellen verantwortlich. Aus der Biologie abgeleitet bestätigten sich hohe Ansprechraten für die Therapie mit PD1 Mab. Im direkten Vergleich der PD1 Blockade (P, Pembrolizumab) zu dem CD30 Immuntoxin BV zeigte sich bei Patienten/innen mit rezidiviertem cHL (KEYNOTE 204 Studie (9) im randomisiertem Vergleich nach einer medianen Beobachtungszeit von 25,7 Monaten ein signifikanter PFS-Vorteil von 13,2 Monaten für Pembrolizumab gegenüber 8,3 Monaten für BV (p=0,0027). Die häufigsten behandlungsbedingten Nebenwirkungen Grad 3-5 favorisierten den Einsatz von Pembrolizumab.
Als Konsequenz dieser Daten werden nun PD1 Antikörper in Kombination mit etablierten Chemotherapie-Regimen in der Erstlinie als auch bei cHL Patienten/innen mit refraktärer bzw. früh-rezidivierender Erkrankung mit dem Ziel getestet, einzelne Chemotherapiekomponenten zu eliminieren oder wenigstens in ihrer Dosis zu reduzieren. Die PD1 Applikation kann dabei vorgeschaltet (sequentiell) oder parallel zur Chemotherapie erfolgen.
In einer multizentrischen Phase-II-Studie mit sequentieller Pembrolizumab + AVD-Behandlung erreichten fast zwei Drittel der Patienten/innen mit fortgeschrittener cHL Erkrankung nach drei Dosen Pembrolizumab-Monotherapie ein PET-definiertes vollständiges oder nahezu vollständiges metabolisches Ansprechen (CMR) (10). Darüberhinaus erreichten alle Patienten/innen ein CMR (100%) nach 2 Zyklen AVD-Chemotherapie und bei einer medianen Nachbeobachtungszeit von 33,1 Monaten blieben PFS und OS ebenso bei 100%.
Eine ähnliche Fragestellung adressierte die GHSG in einer multizentrischen, randomisierten Phase-II-Studie in einem etwas anderen Patientenkollektiv, da Einschlusskriterium ein Stadium I bis II mit Risikofaktor(en) war (sog. intermediäres Stadium nach GHSG, 11). Die Systemtherapie beinhaltete vier Zyklen Nivolumab + AVD (N-AVD) oder die sequentielle Behandlung mit vier Dosen Nivolumab, zwei Zyklen N-AVD und zwei Zyklen AVD in Standarddosen gefolgt von einer konsolidierenden 30-Gy-Strahlentherapie. Beim Interims-Staging nach zwei Zyklen N-AVD oder 4 Dosen Nivolumab-Monotherapie erreichten 54 von 54 (100 %) bzw. 49 von 51 (96 %) Patienten/innen, die für ein Ansprechen in Frage kamen, ein objektives Ansprechen mit einer CR bei 47 (87%) bzw. 26 (51%) Patienten. Bei einer medianen Nachbeobachtungszeit von 13 Monaten betrug das 12-Monats PFS bei den Patienten/innen, die Nivolumab parallel zur Chemotherapie erhielten, 100% und bei den Patienten/innen mit sequenzieller Therapie 98%.
Ähnliche Konzepte einer PD1 Kombination mit Chemotherapie werden auch im cHL Rezidiv getestet. Die wahrscheinlich am häufigsten eingesetzte Kombination beruht auf dem Pembrolizumab, Gemcitabine, Vinorelbine und liposomalen Doxorubicin (P-GVD) Regime. In der zugrundeliegenden Phase-II-Studie (12) wurde P-GVD als Zweitlinientherapie bei Patienten/innen mit rezidivierter oder refraktärer (rr) cHL Erkrankung untersucht. Dabei erhielten 31 Patienten/innen zwei Zyklen, acht Patienten vier Zyklen. Die Gesamt- und CR-Raten nach Pembro-GVD lagen bei 100% bzw. 95%.
Sechsunddreissig (95%) Patienten/innen wurden einer Hochdosistherapie mit autologer Stammzelltransplantation unterzogen und 13 (33%) erhielten anschliessend eine BV-Erhaltungstherapie. Alle 36 transplantierten Patienten/innen sind bei einer medianen Nachbeobachtungszeit von 13,5 Monaten nach Transplantation in Remission.
Copyright bei Aerzteverlag medinfo AG
Klinik für Hämatologie & Onkologie Hirslanden Zürich AG
8032 Zürich
Onkozentrum Hirslanden Zürich und Onkozentrum Zürich
Witellikerstrasse 40
8032 Zürich
Christoph.renner@hirslanden.ch
Der Autor hat keine Interessenkonflikte im Zusammenhang mit diesem Artikel deklariert.
◆ Das Hodgkin Lymphom nimmt aufgrund seiner Biologie einen besonderen Stellenwert in der Hämato-Onkologie ein.
◆ Neben der auffälligen Histopathologie sind die Erfolge in der Behandlung durch den Einsatz von Chemo- und Strahlentherapie beeindruckend.
◆ Unter Berücksichtigung des Krankheitsstadiums und Alters können bis zu 95% aller Patienten/innen geheilt werden.
◆ Da vornehmlich junge Patienten/innen erkranken, rücken Spätschäden wie die therapiebedingte Einschränkung der Fertilität und Zweitneoplasien in den Vordergrund.
◆ Mit den neuen Immuntherapien in Form CD30-spezifischer Immuntoxine aber auch PD1/PD-L1 blockierender Antikörper stehen neue Modalitäten zur Verfügung, die klassische Therapien verdrängen und bei geringerer Toxizität weiterhin hohe Heilungschancen erlauben.
1. Ansell SM. Targeting immune checkpoints in lymphoma. Curr Opin Hematol. 2015;22(4):337-42.
2. Alaggio, R., Amador, C., Anagnostopoulos, I. et al. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Lymphoid Neoplasms. Leukemia 2022;36:1720–1748.
3. Cheson BD, Fisher RI, Barrington SF et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification. J Clin Oncol 2014;32:3059–3068.
4. Fuchs M, Goergen H, Kobe C et al. Positron Emission Tomography-Guided Treatment in Early-Stage Favorable Hodgkin Lymphoma: Final Results of the International, Randomized Phase III HD16 Trial by the German Hodgkin Study Group. J Clin Oncol. 2019;37(31):2835-2845.
5. Borchmann P, Plütschow A, Kobe C et al. PET-guided omission of radiotherapy in early-stage unfavourable Hodgkin lymphoma (GHSG HD17): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2021;22(2):223-234.
6. Kreissl S, Goergen H, Buehnen I et al. German Hodgkin Study Group. PET-guided eBEACOPP treatment of advanced-stage Hodgkin lymphoma (HD18): follow-up analysis of an international, open-label, randomised, phase 3 trial. Lancet Haematol. 2021;8(6):e398-e409.
7. Ansell SM, Radford J, Connors JM et al. ECHELON-1 Study Group. Overall Survival with Brentuximab Vedotin in Stage III or IV Hodgkin’s Lymphoma. N Engl J Med. 2022;387(4):310-320.
8. Peter Borchmann et al., Treatment Related Morbidity in Patients with Classical Hodgkin Lymphoma: Results of the Ongoing, Randomized Phase III HD21 Trial By the German Hodgkin Study Group. ASH 2022, Abstract #317.
9. Kuruvilla J, Ramchandren R, Santoro A et al. Pembrolizumab versus brentuximab vedotin in relapsed or refractory classical Hodgkin lymphoma (KEYNOTE-204): an interim analysis of a multicentre, randomised, open-label, phase 3 study. Lancet Oncol. 2021;22(4):512-524.
10. Allen PB, Lu X, Chen Q et al. Sequential Pembrolizumab and AVD is Highly Effective at any PD-L1 Expression Level in Untreated Hodgkin Lymphoma. Blood Adv. 2022;9:bloodadvances.2022008116.
11. Bröckelmann PJ, Goergen H, Keller U et al. Efficacy of Nivolumab and AVD in Early-Stage Unfavorable Classic Hodgkin Lymphoma: The Randomized Phase 2 German Hodgkin Study Group NIVAHL Trial. JAMA Oncol. 2020;6(6):872-880.
12. Moskowitz AJ, Shah G, Schöder H et al. Phase II Trial of Pembrolizumab Plus Gemcitabine, Vinorelbine, and Liposomal Doxorubicin as Second-Line Therapy for Relapsed or Refractory Classical Hodgkin Lymphoma. J Clin Oncol. 2021;39(28):3109-3117.
info@onco-suisse
- Vol. 13
- Ausgabe 5
- August 2023