- Thrombose- Prophylaxe in der onkologischen Chirurgie in Frage gestellt
Ist «A shot a day keeps the CAT away» noch korrekt? – Dies ist ein Kommentar zu dem Paper «How strong is the evidence supporting thromboprophylaxis in surgical oncology?» (1), das unlängst im Journal of Clinical Oncology publiziert wurde. Die Autoren des Papers stellen die Empfehlung der Thrombosenprophylaxe beim chirurgischen Tumor-Patienten in Frage.
Is «A shot a day keeps the CAT away» still correct? – This is a commentary on the paper «How strong is the evidence supporting thromboprophylaxis in surgical oncology?” (1), which was recently published in the Journal of Clinical Oncology. The authors of the paper question the recommendation of thromboprophylaxis in surgical tumor patients.
Key Words: thromboprophylaxis, surgical oncology
5-20% aller Tumor-Patienten erleiden eine venöse Thromboembolie (VTE); 20% aller VTE Patienten leiden an einem Tumor. Es herrscht sicher ein Konsens, dass ein zusätzlicher, chirurgischer Eingriff das VTE Risiko weiter erhöht (2, 3).
Unter der Rubrik «Comments and Controversies», kürzlich publiziert im renommierten Journal of Clinical Oncology (1), melden sich zwei Chirurgen (aus Bethesda und Boston) und ein Sozialwissenschafter aus Abu Dhabi zu Wort und wagen sich denn auch gleich frontal an ein gefühlt in Stein gemeisseltes Paradigma, nämlich sie stellen die starke Empfehlung der Thromboseprophylaxe beim chirurgischen Tumor-Patienten, wie sie in den ASCO guidelines publiziert sind, in Frage. Sie stossen sich an folgender Empfehlung der ASCO, so im Abstract: «Patients undergoing major cancer surgery should receive prophylaxis starting before surgery (and continuing for at least 7 to 10 days)», und konkret im Text: «Clinical Question 3: All patients with malignant disease undergoing major surgical intervention should be offered pharmacologic thromboprophylaxis with either unfractionated heparin (UFH) or LMWH unless contraindicated because of active bleeding, or high bleeding risk, or other contraindications (Type: Evidence quality: high; Strength of recommendation: strong).»
Ihre drei Hauptargumente dagegen sind:
a) Die Endpunkte VTE seien heterogen: So sei der Outcome von venographisch oder dopplersonographisch nachgewiesenen, asymptomatischen VTs sowie derjenige von asymptomatischen segmentären und subsegmentären, LEs unklar. Asymptomatische TVT/LEs könnten allenfalls lediglich Marker und nicht Ursache der Mortalität sein und man könnte die Therapie evtl. ebensogut weglassen (?). Nur ein kleiner Bruchteil der asymptomatischen VTE würde sich in symptomatisch-manifeste, zu behandelnde VTE entwickeln, währenddem die Therapie-Prophylaxe zu gesichert vermehrten Blutungskomplikationen führe.
b) Die Effekte der prophylaktischen Massnahmen auf die Mortalität seien unklar, RCT sind selten genügend gepowered für den Mortalitätsendpunkt, und Meta-Analysen konnten dies nicht sicher genug zeigen.
c) Es fehlten oft die Endpunkte der unterstützenden, symptomatischen Verbesserungen («lack of supportive care outcomes»), wie Schmerzen, Atemnot, postthrombotisches Syndrom, physische und mentale Fitness. Dies wäre zwar wichtig und möglich, aber die harte Evidenz hierfür fehle.
Entsprechend fordern Sie verbesserte Analysen und neue, grosse RCTs zu diesen Themen mit den entsprechenden Endpunkten Tod, symptomatische VTE und Symptome der VTE, ohne vs mit Antikoagulation.
Den Autoren ist zunächst zu ihrer Exposition, resp zu den «harten» und «mutigen» Argumenten scheinbar völlig gegen den Strom der Guidelines der Fachgesellschaft (ASCO) Respekt zu zollen und zu gratulieren, denn sie stossen eine wertvolle und äusserst konsequente Diskussion an.
Ihre Gedanken werden zur kritischen Würdigung und evtl. zu einer gewissen Abschwächung der Empfehlungs-Stärken/Evidenz in den Guidelines führen; wohl aber kaum zu einer tatsächlichen Revision resp. zu einer grundsätzlichen Praxisänderung.
Eine (vermehrte) Individualisierung der Prophylaxe und Therapie unter der Berücksichtigung der individualisierten Risiko-Abwägung des aggregierten Endpunktes VTE/Bleeding im Einzelfall ist hingegen wahrscheinlich und wünschenswert.
Die Gründe für unsere «Lagebeurteilung» werden an einem (extremen) Beispiel vor Augen geführt:
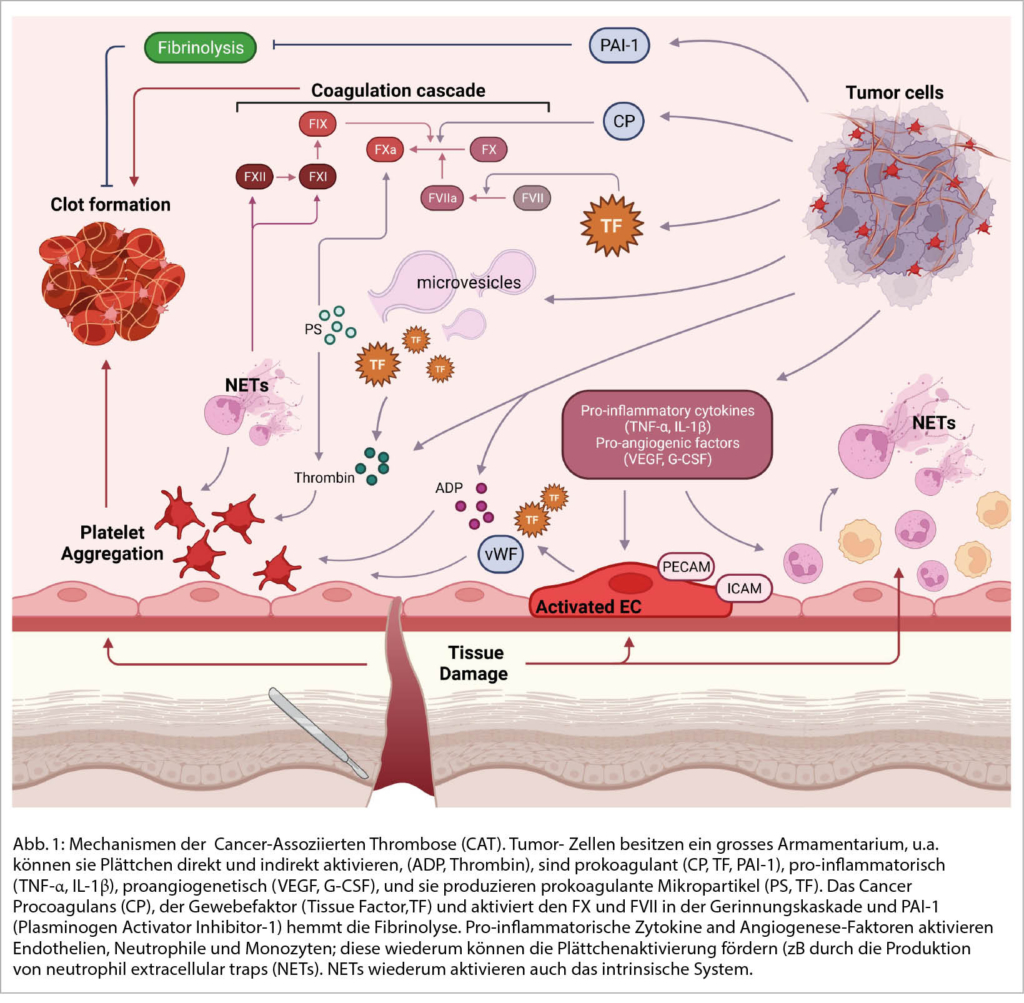
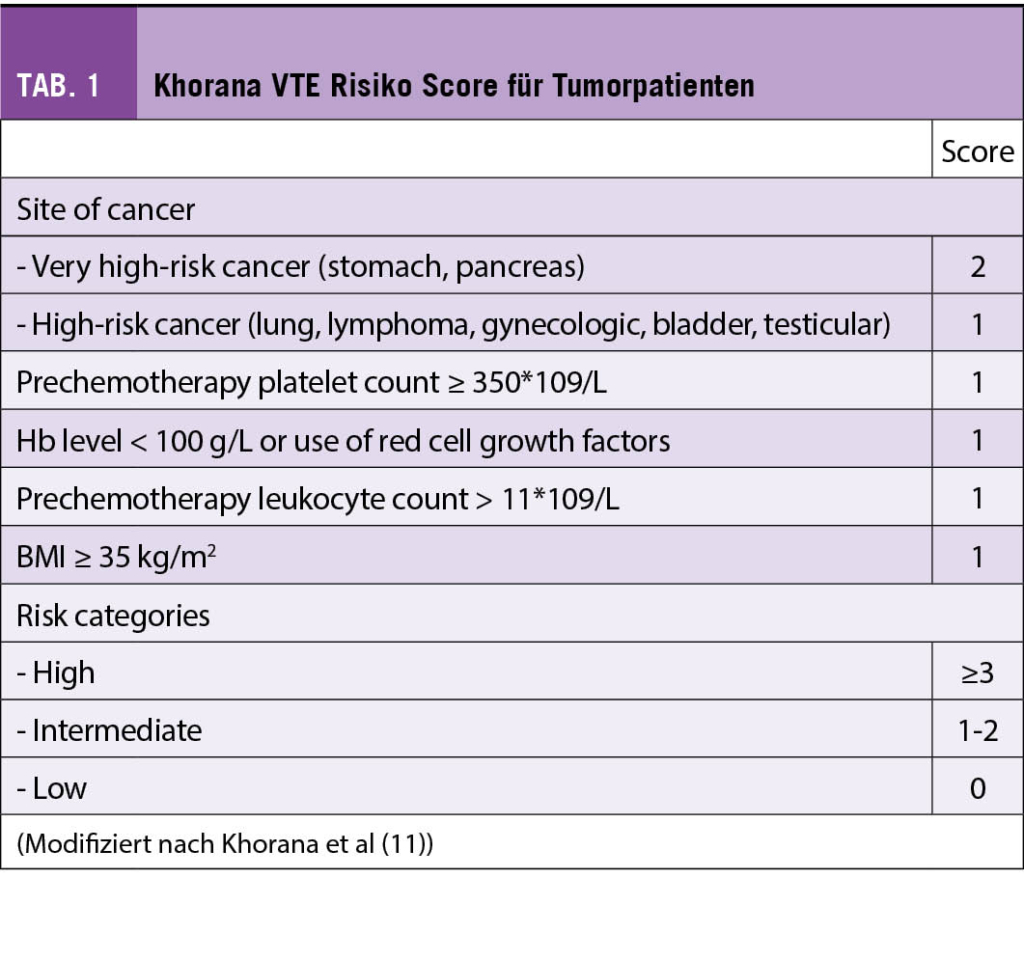
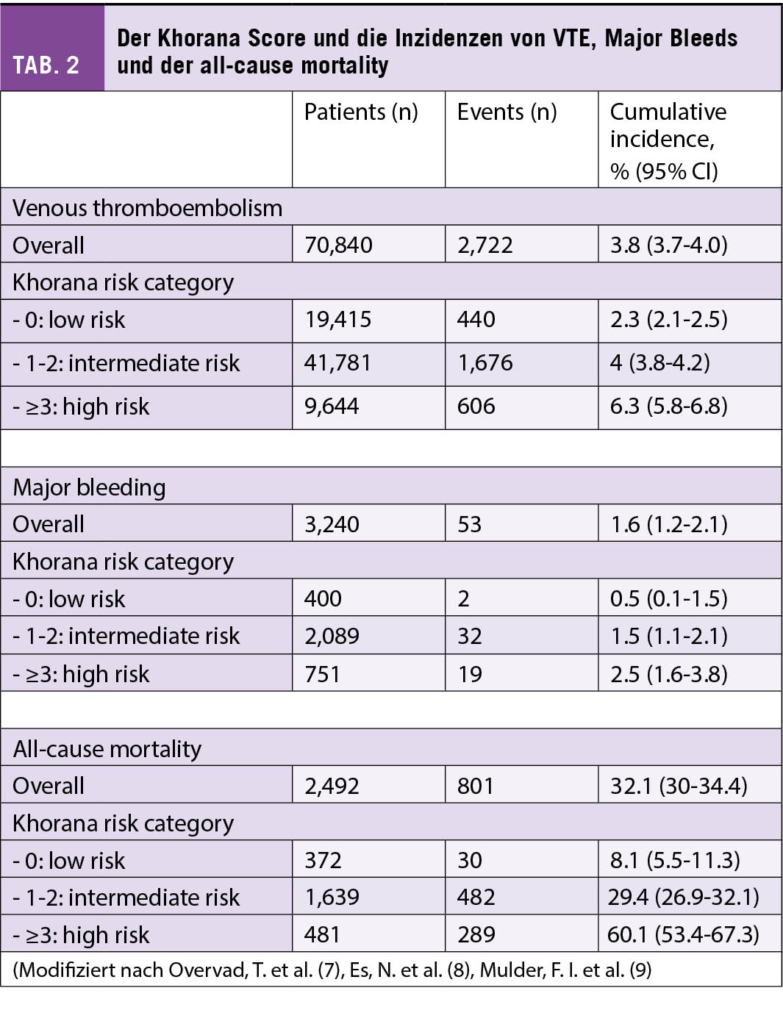
Der Patient, den Sie in eine saubere, riesige (RCT)-Studie, wie von den Autoren vorgeschlagen, einschliessen möchten, leidet an einer (für VTE anerkannt high risk) Tumorerkrankung (Pankreaskopf-Karzinom), ist hospitalisiert, hat eine tumorreduktive Chemotherapie hinter sich und soll sich nun einem klassischen chirurgischen Eingriff (evtl. Whippple) unterziehen; er weist präoperativ im Duplex eine asymptomatische TVT, resp im staging-CT eine asymptomatische (sub)segmentäre LE auf. Der Pat wird sich nicht in einen potentiellen Placebo-Arm randomisieren lassen (Antikoagulation vs. keine Antikoagulation). Er, sein Hausarzt, der Internist im Spital, «Dr Google» und der Onkologe, der Chirurge, das Ethik-Komitee und letztlich der Jurist werden dagegen sein (differenzierte Dastellung der evtuellen Meinungen dieser Exponenten in (3)). Der erfahrene Kliniker wird Ihnen die Pathographie von Armand Trousseau erzählen, über seine Beobachtungen von postoperativen, tödlichen, zentralen LEs berichten, der Hämatologe im Speziellen die Mechanismen der Thrombophilie beim chirurgisch hospitalisierten Tumorpatienten aufzeichnen (Abb. 1, Mechanismen des Tumorprokoagulans, Tissue factor, Immobilisation, Komorbiditäten, Chemotherapie), und der Onkologe die aktuellen, besagten (ASCO) Guidelines vorstellen. Und der Chirurge würde den Eingriff verschieben, mit den entsprechenden Konsequenzen für den Patienten. Auch im Falle eines negative Duplex/CT-Befundes würde analog der ASCO Guidelines betreffend Thromboprophylaxe argumentiert. Im aktuellen (Khorana)-Score qualifiziert der Pat natürlich klar auch ohne stille VTE als Hochrisiko-Patient (Tab. 1, 2, (Ref 7-9)), inklusive natürlich sehr hoher Mortalität mit recht engen Konfidenzintervallen (gemäss Klemen et al aber eben möglicherweise lediglich Assoziation, nicht Kausalität (1)).
Umgekehrt ist es richtig, dass bei Tumorpatienten die Blutungsgefahr oft deutlich erhöht ist (Tumor-Lokalisation, Thrombopenie, Komorbiditäten mit reduzierter Nieren-und Leber-Funktion) und in die Gesamtbeurteilung einzubeziehen ist (korrekterweise heute als «combined adverse events» bereits meist berücksichtigt) und entsprechend ist die prophylaktische Massnahme, die Dauer und Dosis abzuwägen.
Venographische oder Duplex-sonographisch festgestellte Thrombosen gelten heute z.B. in Studien zur venösen Prophylaxe bei orthopädischer Chirurgie bei totalem Knie oder Hüftgelenksersatz oft als akzeptierter Endpunkt für klinische thrombotische Komplikationen resp. Prädiktion (insbesondere gerade in Phase II Studien), da die klinisch manifeste VTEs in zu geringer Zahl für die Grösse der Studien auftreten.
Interessanterweise sind aktuell aber doppelblinde, randomisierte Studien unterwegs, die exakt wie gefordert die Prognose subsegmentärer LEs (SSPE) mit und ohne AK analysieren. Hierbei werden Tumorpatienten aber klar ausgeschlossen («ein kleines Ferkel wird idR über die Zeit ein grosses Schwein» ist ein gelegentlich gehörtes Zitat, das schwer zu entkräften und natürlich ebenso schwer zu übertragen ist!), was die implizite Annahme bestätigt, dass diese Patienten heute behandelt werden sollten. Eine offene Studie zeigte in dieser Frage bereits ein schlechteres Outcome ohne Antikoagulation, Bias können nicht ausgeschlossen werden (10).
Das ist exakt der Hauptunterschied der Lagebeurteilung der «Challengers» (1) zum ASCO-Panel (2) in ihrer Empfehlung/Beurteilung in Punkt Nummer 4.7, (sie bestreiten eben, dass zufällig oder per screening- Ultraschall entdeckte VTE einen ähnlichen Outcome haben wie symptomatische VTE beim Tumorpatienten (2). ASCO deklariert dies klar in ihrem consensus, bei tiefer Evidenz, aber intermediärer Stärke der Empfehlung) im Kontrast zu den «Challenger Chirurgen» (1).
Das ASCO-Panel deklariert an sich korrekt und im Konsensus (1) die relative tiefe Evidenz. Der Unterschied ist die starke unterschiedliche Überzeugung, sinngemäss sagt das ASCO panel also «Absence of evidence» ist nicht «evidence of absence».
Wenn zwei (US-Amerikaner) sich streiten, lohnt sich der Blick auf z.T. noch rezentere Beurteilungen, Empfehlungen und Interpretationen der Literatur Dritter (Panels, Experten und Fachgesellschaften (3-5)), nämlich der ASH, der amerikanischen Hämatologengesellschaft (mit weltweiter Expertenabstützung (3), der ITAC, der International Initiative on Thrombosis and Cancer (ITAC,) und ihrem Advisory Panel 2019 (4) und der NCCN Guidelines des National Comprehensive Cancer Network (5).
Diese liegen wohl «etwas gemässigter», in einem guten, klinischen Kompromissbereich, mit dem sich unsere «3 Challengers» aus (mit obigem Beispiel illustriert) gut einfühlbaren, praktischen Gründen wohl abfinden werden.
So sind die ASH Empfehlungen 2021, die einen lesenswerten, differenzierten Mittelweg darstellen und zum Thema schon primär auf das VTE- und das Blutungs-Risiko ausgerichtet sind (3) moderater: Entsprechend «suggerieren» sie (bedingte Empfehlung, niedrige Sicherheit der Evidenz) differenziert bei tiefem Blutungsrisiko zwar klar die medikamentöse Prophylaxe, beginnend nach dem Eingriff (ASCO: vor dem Eingriff), bei hohem Thrombose-Risiko beides, mechanische und medikamentöse Prophylaxe, bei hohem Blutungsrisiko dagegen ausschliesslich die mechanische Prophylaxe. Interessanterweise differenzieren sie auch nach mutmasslichen Meinungen der Patienten, der Kliniker, klinischen Forscher und der politischen Entscheidungsträger (!).
Weitere Differenz: Die ASCO empfiehlt überdies bei high risk hospitalisierten Patienten eine Thromboprophylaxe über 7-10 Tage nach der Spitalentlassung, währenddem die ASH guidelines weiterhin den Stop bei Spitalaustritt empfehlen und die absoluten Risiken der VTE und der Blutung als NNT/NNH mit der entsprechenden Unschärfe ( recht grossen CIs) vorrechnen: Stopp bei Entlassung vs. protrahierte Prophylaxe: +1 Todesfall an VTE, +3 symptomatische VT und +1PE/1,000 Patienten mehr, vs Weiterführung der Prophylaxe: +19 grössere Blutungen/1,000 Pat., und +1 HIT/1,000 Pat., Dieses Beispiel illustriert gut, dass man selbst bei der heutigen Datenlage getrost verschiedener Meinung sein kann und in diesem Wissen individuell abgestützte Lösungen suchen wird.
Als praktische Konklusion für Kliniker beim Stand der heutigen Datenlage empfehlen wir die detaillierte, individualisierte Risiko-Analyse bzgl. VTE vs. Blutungs-Risiko unter speziellem Einbezug von:
- Art und Ausdehnung des Tumors, resp. dessen VTE und Blutungsrisiko
- Art und Grösse des Eingriffs
- Art und Timing der Chemotherapie
- Patientenfaktoren mit Blutungs- und VTE Anamnese, sowie Organdysfunktionen
- (Hämatologische) Laborwerte
- Neuere Scores nach Khorana (Tab 1&2)
- Patienten-Präferenzen
Mit dieser Checkliste und den Empfehlungen wird man zu einem individuell optimalen Entscheid kommen, auch unter Einbezug der zunehmend beim Tumorpatienten erprobten und eingesetzten DOACs, die ein etwas einfacheres Handling erlauben.
Copyright bei Aerzteverlag medinfo AG
Leiter Gerinnungssprechstunde Kantonsspital Baden, 5404 Baden
Labor für Molekulare Kardiologie, Leiter Plättchenforschung,
Universität Zürich
Wagistrasse 12
8952 Schlieren
hansjuerg.beer@ksb.ch
Labor für Molekulare Kardiologie
Universität Zürich
Wagistrasse 12
8952 Schlieren
JHB deklariert die Unterstützung durch den schweizerischen Nationalfonds (no. 324730_163339), die Schweiz. Herzstiftung, die Kardio- Stiftung Baden, Grants von Bayer und Vortrags-/Beratungs-Honorare von Sanofi-Aventis und Amgen an die Institution. PL deklariert keine potenziellen Interessenkonflikte.
1. ND Klemen, PL Feingold, PL Feingold, Hashimoto: How strong is the evidence supporting thromboprophylaxis in surgical oncology? J Clin Oncol 2021; 40: 320-3.
2. Key NS, Khorana AA, Kuderer NM, et al. Venous thromboembolism prophylaxis and treatment in patients with cancer: ASCO clinical practice guideline update.
J Clin Oncol 2020;38(5):496-520.
3. GH Lyman et al: American Society of Hematology 2021 guidelines for management of venous thromboembolism: prevention and treatment in patients with
cancer. Blood advances 5:927-974; 2021.
4. Farge D, Frere C, Connors JM, et al; International Initiative on Thrombosis and Cancer (ITAC) Advisory Panel. 2019 international clinical practice guidelines for the treatment and prophylaxis of venous thromboembolism in patients with
cancer. Lancet Oncol. 2019;20(10):e566-e581.
5. National Comprehensive Cancer Network. NCCN guidelines. Available at:https://www.nccn.org/professionals/physician_gls/default.aspx#supportive. Accessed 13 January 2021.
6. Cuker A, Arepally GM, Chong BH, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: heparin-induced thrombocytopenia. Blood Adv. 2018;2(22):3360-3392.
7. Overvad, T. et al. Validation of the Khorana score for predicting venous thromboembolism in 40 218 cancer patients initiating chemotherapy. Blood Adv 6, 2967–2976 (2022).
8. Es, N. et al. The Khorana score for prediction of venous thromboembolism in
cancer patients: An individual patient data meta-analysis. J Thromb Haemost 18, 1940–1951 (2020).
9. Mulder, F. I. et al. The Khorana score for prediction of venous thromboembolism in cancer patients: a systematic review and meta-analysis. Haematologica 104, 1277–1287 (2019).
10. Le Gal G, Kovacs MJ, Bertoletti L et al: Risk for Recurrent Venous Thromboembolism in Patients With Subsegmental Pulmonary Embolism Managed Without Anticoagulation. A Multicenter Prospective Cohort Study. Ann Int Med 2022; 175: 29-35.
11. Khorana, A. A., Kuderer, N. M., Culakova, E., Lyman, G. H. & Francis, C. W.
Development and validation of a predictive model for chemotherapy-associated thrombosis. Blood 111, 4902–4907 (2008).
info@onco-suisse
- Vol. 12
- Ausgabe 4
- Juli 2022