- Update zur Immuntherapie
Das kutane Plattenepithelkarzinom (PEK) stellt nach dem Basalzellkarzinom den zweithäufigsten Hauttumor in der hellhäutigen Bevölkerung dar und ist histologisch charakterisiert durch die maligne Proliferation von epidermalen Keratinozyten (1). Das PEK tritt vornehmlich an UV-Licht exponierten Hautarealen auf (80%-90% in der Kopf-Hals-Region) und ist ein Tumor des höheren Alters (>70 Jahre) (2-4). Hauptrisikofaktor für die Entstehung des PEK stellt die kumulative UV-Belastung dar.
Après le carcinome basocellulaire, le carcinome épidermoïde cutané (CEC) est la deuxième tumeur cutanée la plus fréquente dans la population à peau claire et se caractérise histologiquement par la prolifération maligne des kératinocytes épidermiques (1). Le CEC apparaît principalement dans les zones cutanées exposées à la lumière ultraviolette (80 à 90 % dans la région de la tête et du cou) et est une tumeur d’âge avancé (> 70 ans) (2-4). Le principal facteur de risque pour le développement du CEC est l’exposition cumulative à la lumière ultraviolette.
In genomischen Analysen lässt sich für PEKs die typische UV-Mutationssignatur mit ihren charakteristischen C > T oder CC > TT Dinukleotid-Mutationen nachweisen, welche auch für das kutane Melanom charakteristisch sind. Im Vergleicht der verschiedenen Tumorentitäten weist das kutane Plattenepithelkarzinom bei weitem die höchsten Mutationsraten mit durchschnittlich 61,2/Megabase auf und liegt damit um das 4-5-fache höher als beim malignen Melanoms mit 13,2/Megabase (5). Die Heilungschancen sind für die meisten Patienten mit lokalisiertem Plattenepithelkarzinom nach adäquater Therapie (vollständige chirurgische Exzision +/- adjuvanter Radiotherapie im Falle einer R1-Situation oder ausgeprägter Perineuralscheiden-Infiltration) hoch, mit 10 Jahres krankheits-spezifischem Überleben von deutlich über 90% (6). Lediglich 2,8% des von Eigentler et al. prospektiv untersuchten Kollektivs von über 1400 Pateinten entwickelten nach Primärtherapie Metastasen und verstarben an den Folgen der Erkrankung (6). Eine Alternative zur Exzision stellt die primäre Radiotherapie dar mit lokalen Rezidivraten von 3-11% (7).
Systemische Behandlungsansätze des fortgeschrittenen PEK
Während für das lokalisierte PEK zwei Therapiemodalitäten mit ausgezeichneten Heilungschancen (> 90%) zur Verfügung stehen, ist die Behandlung des bereits fortgeschrittenen PEK deutlich problematischer. Dabei wird klinisch zwischen einem rein lokal fortgeschrittenen PEK und dem metastasierten (lymphogen oder peripher) PEK unterschieden. Für beide klinischen Szenarien sind die lokaltherapeutischen Massnahmen entweder wie im Falle des lokal fortgeschrittenen PEK ausgeschöpft (z. Bsp. lokales Rezidiv nach mehrmaliger Exzision oder vorangegangener Radiotherapie), oder aber nicht mehr sinnvoll wie im Falle beim Vorliegen von peripheren Metastasen.
Für diese Patientengruppen liegt eine palliative Gesamtsituation vor und eine systemische Behandlung ist primär indiziert. Bis zur Einführung der Immun-Checkpoint Inhibitoren (ICI) in den klinischen Alltag existierte kein Standard bei der Wahl der Systemtherapie für diese Patienten und die medianen Überlebenszeiten bei Einsatz von konventionellen Chemotherapeutika (z.Bsp. Cisplatin/5-FU, Carboplatin/Taxol) oder Medikamenten gegen den EGF-Rezeptor (Cetuximab, Panitumuab) und dessen Kinase-Domäne (Erlortinib, Gefitinib) betrugen nicht mehr als 16 Monate (8-10).
Immun-Checkpoint Inhibitoren als neue Therapiemöglichkeit des fortgeschrittenen PEK
Seit der Zulassung des ersten Immun-Checkpoint Inhibitors Ipilimumab (anti-CTLA4-Antikörper) im März 2011 durch die FDA für das metastasierte Melanom hat sich die Behandlungslandschaft in der Onkologie rasant verändert. Insbesondere Antikörper zur Blockierung der PD1/PD-L1 Achse, die ein besseres Wirkungs- und günstigeres Nebenwirkungsprofil als die anti-CTLA-4 Antikörper in der Monotherapie aufweisen finden heute Anwendung im klinischen Alltag.
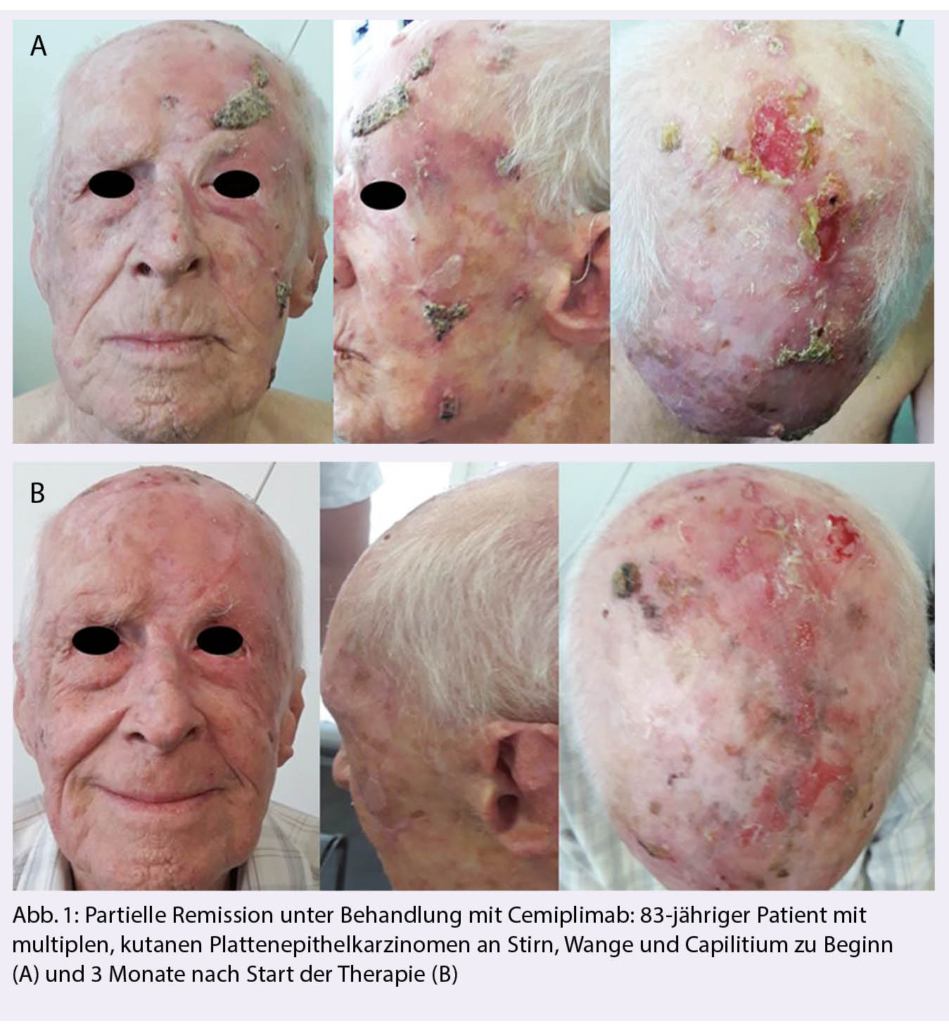
Auf Grund der kausalen Beteiligung der kumulativen UV-Exposition an der Entstehung der PEKs weisen diese, wie bereits eingangs erwähnt, die höchste Mutationsrate unter den verschiedenen Tumorentitäten auf. Unter der Annahme, das für Tumoren mit hohen Mutationsraten, die Wahrscheinlichkeit für die Bildung von Neoantigenen steigt die in der Folge vom Körpereigenen Immunsystem als «fremd» erkannt werden können, sollten die PEKs für die Behandlung mit ICI geradezu prädestiniert sein. Erste klinische Hinweise für die Wirksamkeit von ICIs beim fortgeschrittenen PEK lieferten Fallbeschreibungen zum Einsatz der anti-PD1 Antikörper Pembrolizumab, Nivolumab oder Cemiplimab mit zum Teil langanhaltenden, kompletten Remissionen (> 24 Monate) (10-12). In Abbildung 1 ist der erfreuliche Verlauf eines 83-järigen Patienten mit multiplen PEK unter einer Behandlung mit Cemiplimab dargestellt. Basierend auf diesen vielversprechenden Fallbeschreibungen wurde eine erste prospektive, multizentrische Phase 1/2 Studie mit Cemiplimab lanciert (13): 26 Patienten (10 lokal fortgeschrittenes PEK + 16 metastasiert) aus der erweiterten Phase 1, sowie 59 Patienten mit metastasiertem (lymphogen + peripher) PEK erhielten 2-wöchentlich Cemiplimab in einer Dosierung von 3 mg/Kg Körpergewicht intravenös. Die Behandlung wurde in der Phase 1 bis maximal 48 Wochen in Phase 2 bis insgesamt 96 Wochen fortgeführt. Für 13 der 26 Patienten (50%) aus der Phase 1 und 28 der 59 Patienten (47%) aus der Phase 2 konnte unter der Behandlung ein objektives Ansprechen mit kompletten Remissionen für vier metastatische Patienten erzielt werden. Ein weiterer Zugewinn für einen Teil der Patienten war neben den hohen Ansprechraten auch die Dauer des Ansprechens von mindestens 6 Monaten in mehr als der Hälfte (57%) der «Responder». Als häufigste Nebenwirkungen traten die für eine ICI-Behandlung typischen Symptome wie Durchfall (27%, Müdigkeit (24%), Übelkeit (17%) und Hautauschlag (15%) auf. In den 12-Monats Verlaufsdaten der Kohorte für metastasierte PEK bestätigte sich die hohe Ansprechrate von rund 50% mit einer Dauer des Ansprechens von mehr als 12 Monaten für 75% der «Responder», das mediane Progressionsfreie Überleben betrug 18.4 Monate. (14).
Cemiplimab als neuer Standard in der Systemtherapie
Basierend auf diesen Daten wurde Cemiplimab am 28.9.2018 durch die FDA und von der EMA am 28.6.2019 als Monotherapie zur Behandlung von erwachsenen Patienten mit metastasiertem oder lokal fortgeschrittenem kutanen Plattenepithelkarzinom, die für eine kurative Operation oder kurative Strahlentherapie nicht in Betracht kommen zugelassen. Die Behandlung erfolgt in einer fixen Dosierung von 350mg in 3 wöchentlichen Intervallen gewichtsunabhängig, basierend auf pharmakokinetischen Studien.
Eine separate Phase 2 Studie untersuchte parallel die Wirksamkeit von Cimiplimab für rein lokal fortgeschrittene PEK (Patienten ohne lymphogene oder periphere Metastasen) für die eine kurativ intendierte chirurgische oder radiotherapeutische Behandlung nicht (mehr) in Frage kam (15). Insgesamt 78 Patienten erhielten Cemiplimab 3mg/kg in 2-wöchentlichen Intervallen für maximal 96 Wochen. Dabei konnte erneut eine hohe Ansprechrate von 44% (34 von 78 Patienten mit 10 kompletten Remissionen) erzielt werden. 23 der 34 «Responder» (68%) zeigten zudem eine Dauer des Ansprechens von mindestens 6 Monaten, das mediane progressionsfreie Überleben, sowie das mediane Gesamtüberleben ist für die Kohorte zum Zeitpunkt des Data-cutoffs noch nicht erreicht gewesen. Diese zweite Studie unterstützt nachdrücklich die Entscheidung der FDA und EMA für die Zulassung von Cemiplimab in entsprechender Indikation. Neben der Wirksamkeit wurde in dieser Studie auch der PD-L1 Status und die individuelle Mutationsrate des Tumors als mögliche prädiktive Marker untersucht. Weder der PD-L1 «tumor proportion score» (TPS), noch die Höhe der Mutationsrate (im Mittel 74/Megabase) erwiesen sich diesbezüglich als aussagekräftig.
Neben Cemiplimab werden auch Pembrolizumab (anti-PD1 Antikörper) und Avelumab (anit-PD-L1 Antikörper) in klinischen Studien für das fortgeschrittene PEK untersucht: Erste Daten zu Pembrolizumab als Erstlinien-Therapie zeigten ein Ansprechen für 15 der 39 behandelten Patienten (38.5%). Avelumab wird in einer randomisierten Phase 2 Studie als Monotherapie oder in Kombination mit Cetuximab untersucht und in einer weiteren Phase 2 Studie wird Cemiplimab in Kombination mit einer lokalen Therapie (intraläsionale Applikation eines oncolytischen Virus, RP1) getestet. Aktuell rekrutieren zudem auch zwei randomisierte Phase 3 Studien zur adjuvanten Behandlung mit entweder Cimiplimab oder Pembrolizumab (NCT03969004, NCT03833167).
Copyright bei Aerzteverlag medinfo AG
Klinik für Dermatologie
Inselspital Bern
3010 Bern
Klinik für Medizinische Onkologie
Inselspital Bern
3010 Bern
Julian.Schardt@insel.ch
Die Autoren haben im Zusammenhang mit diesem Artikel keine Interessenskonflikte deklariert.
- Die Behandlung von Patienten mit fortgeschrittenem PEK hat sich mit der Einführung der Checkpoint-Inhibitoren deutlich verbessert. So lassen sich mit dem Einsatz von Cemiplimab Ansprechraten von bis zu 50% der behandelten Patienten erzielen, für ca. 2/3 der «Responder» ist zudem ein Langzeitansprechen von mindestens 6 Monaten möglich.
- Weiterhin fehlen aber verlässliche prädiktive Marker: Weder der PD-L1 TPS-Score noch die Bestimmung der globalen Mutationsrate im Tumor sind in diesem Falle aussagekräftig. Ein weiterhin schwierig zu behandelndes Kollektiv bleibt das fortgeschrittene PEK von Organ-Empfängern unter Immunsuppression. Hier ist der Einsatz von ICI in der Regel mit einer Transplantatabstossung verbunden und es kommen konventionelle Chemotherapien oder anti-EGFR gerichtete Therapien zum Zuge.
- Die Behandlung des fortgeschrittenen PEK mit Cemiplimab stellt bei fehlenden Kontraindikationen gegenwärtig den neuen Standard in der systemischen Therapie dar.
Messages à retenir
- Le traitement des patients atteints du carcinome épidermoïde cutané (CEC) avancé s’est considérablement amélioré avec l’introduction des inhibiteurs de checkpoint. Par exemple, des taux de réponse allant jusqu’à 50 % des patients traités peuvent être obtenus par l’utilisation du Cemiplimab, et pour environ 2/3 des “répondeurs”, une réponse à long terme d’au moins 6 mois est également possible.
- Cependant, il manque encore des marqueurs prédictifs fiables : ni le score TPS PD-L1 ni la détermination du taux de mutation global de la tumeur ne sont significatifs dans ce cas. Le CEC avancé des receveurs d’organes sous immunosuppression reste un collectif difficile à traiter. Ici, l’utilisation de l’ICI est généralement associée à un rejet de greffe et on utilise la chimiothérapie conventionnelle ou des thérapies dirigées contre l’EGFR.
- Le traitement du CEC avancé par le cemiplimab représente actuellement la nouvelle norme en matière de thérapie systémique en l’absence de contre-indications.
- Albert, M.R. and M.A. Weinstock, Keratinocyte carcinoma. CA Cancer J Clin, 2003. 53(5): p. 292-302.
- Alam, M. and D. Ratner, Cutaneous squamous-cell carcinoma. N Engl J Med, 2001. 344(13): p. 975-83.
- Nagarajan, P., et al., Keratinocyte Carcinomas: Current Concepts and Future Research Priorities. Clin Cancer Res, 2019. 25(8): p. 2379-2391.
- Que, S.K.T., F.O. Zwald, and C.D. Schmults, Cutaneous squamous cell carcinoma: Incidence, risk factors, diagnosis, and staging. J Am Acad Dermatol, 2018. 78(2): p. 237-247.
- Pickering, C.R., et al., Mutational landscape of aggressive cutaneous squamous cell carcinoma. Clin Cancer Res, 2014. 20(24): p. 6582-92.
- Eigentler, T.K., et al., Survival of Patients with Cutaneous Squamous Cell Carcinoma: Results of a Prospective Cohort Study. J Invest Dermatol, 2017. 137(11): p. 2309-2315.
- Lansbury, L., et al., Interventions for non-metastatic squamous cell carcinoma of the skin: systematic review and pooled analysis of observational studies. BMJ, 2013. 347: p. f6153.
- Cowey, L.e.a., Treatment patterns and outcomes among patients with advanced cutaneous squamous cell carcinoma (CSCC) in a US community oncology setting. J Clin Oncol, 2019. 37(no. 15_suppl).
- Hillen, U., et al., Advanced cutaneous squamous cell carcinoma: A retrospective analysis of patient profiles and treatment patterns-Results of a non-interventional study of the DeCOG. Eur J Cancer, 2018. 96: p. 34-43.
- Petersen, E.T., et al., Review of systemic agents in the treatment of advanced cutaneous squamous cell carcinoma. Future Oncol, 2019. 15(27): p. 3171-3184.
- Borradori, L., et al., Rescue therapy with anti-programmed cell death protein 1 inhibitors of advanced cutaneous squamous cell carcinoma and basosquamous carcinoma: preliminary experience in five cases. Br J Dermatol, 2016. 175(6): p. 1382-1386.
- Falchook, G.S., et al., Responses of metastatic basal cell and cutaneous squamous cell carcinomas to anti-PD1 monoclonal antibody REGN2810. J Immunother Cancer, 2016. 4: p. 70.
- Migden, M.R., et al., PD-1 Blockade with Cemiplimab in Advanced Cutaneous Squamous-Cell Carcinoma. N Engl J Med, 2018. 379(4): p. 341-351.
- Guminski, A., Phase 2 study of cemiplimab, a human monclonal anti-PD-1 antibody, in patients witih metastatic cutaneous squamous cell carcinomal (mCSCC; Group 1) 12-month follow-up. J Clin Oncol, 2019. 37(suppl):9526.
- Migden, M.R., et al., Cemiplimab in locally advanced cutaneous squamous cell carcinoma: results from an open-label, phase 2, single-arm trial. Lancet Oncol, 2020. 21(2): p. 294-305.
info@onco-suisse
- Vol. 10
- Ausgabe 3
- Juni 2020