- Urothelkarzinom
Beim lokalisierten muskelinvasiven Urothelkarzinom konnte in der multizentrischen ABACUS Studie eine vollständige Negativierung der zirkulierenden ctDNA nach neoadjuvanter Chemotherapie bzw. radikaler Zystektomie die Rezidivfreiheit besser vorhersagen als lediglich ein Rückgang von 50 % bzw. 75 %. Die ctDNA hat damit seine Rolle als vielsprechender Biomarker bestätigt. In der AMBASSADOR Studie führte die adjuvante Therapie mit Pembrolizumab nach radikaler Zystektomie zu einer Reduktion des krankheitsfreien Überlebens. Abschliessende Ergebnisse hinsichtlich des dualen primären Endpunktes von krankheitsfreiem Überleben und Gesamtüberleben stehen jedoch noch aus. Beim lokal fortgeschrittenen bzw. metastasierten muskelinvasiven Urothelkarzinom zeigte eine Subgruppenanalyse der EV-302 Studie mit Enfortumab vedotin plus Pembrolizumab einen konsistenten signifikanten Vorteil im Gesamtüberleben gegenüber der platinhaltigen Chemotherapie auch in den Subgruppen mit historisch schlechter Prognose wie z.B. Lebermetastasen. Die PEMCAB Studie untersuchte die Kombinationstherapie von Cabozantinib plus Pembrolizumab bei Cisplatin-unfitten Patienten und zeigte vielversprechende erste Ergebnisse, bei allerdings deutlich erhöhter Rate an Nebenwirkungen ≥ Grad 3.
In patients with localized muscle-invasive urothelial carcinoma, the multicenter ABACUS demonstrated that complete clearance of circulating ctDNA after neoadjuvant chemotherapy or radical cystectomy predicted relapse-free survival better than just a reduction of 50 % or 75 %, respectively. Thus, measurements of ctDNA confirmed their role as a potential forthcoming biomarker The AMBASSADOR study investigated adjuvant therapy with Pembrolizumab after radical cystectomy and demonstrated a significant advantage in the primary endpoint disease-free survival. Final results regarding the dual primary endpoint disease-free survival and overall survival, however, are still pending. In metastatic muscle-invasive urothelial carcinoma, subgroup analyses of EV-302 study with enfortumab vedotin plus pembrolizumab showed a consistent significant overall survival benefit compared to platinum-based chemotherapy in all investigated subgroups, including those with historically poor prognosis such as liver metastases.The PEMCARB study investigated the combination therapy of Cabozantinib plus Pembrolizumab in cisplatin-unfit patients and showed promising initial results, but at the price of an increased incidence of ≥ grade 3 side effects.
Key Words: Urothelkarzinom, ctDNA, perioperativ metastasiert, Enfotumab vedotin
Lokalisiertes muskelinvasives Urothelkarzinom
Prädiktiver Wert dynamischer ctDNA Veränderungen – ABACUS Studie
In der internationalen, open-label multizenter Phase II ABACUS Studie (1), erhielten Patienten mit einem histologisch gesicherten, lokalisierten muskelinvasiven Urothelkarzinom der Blase (Stadium pT2-T4N0M0), die unfit für Cisplatin Chemotherapie waren oder diese ablehnten, eine adjuvante Immuntherapie mit zwei Zyklen des Checkpointinhibitors Azetolizumab (anti-PD-L1) gefolgt von einer Zystektomie. Vor sowie nach adjuvanter Immuntherapie und nach Zystektomie wurde die zirkulierende, tumorspezifische, DNA (ctNDA) bestimmt. Die Positivität von ctDNA wird als Hinweis auf molekulare residuale Krankheit (MRD) angesehen. Es wird postuliert, dass der Nachweis von ctDNA und deren dynamischer Veränderung unter Therapie mit dem Therapieergebnis korreliert (2). Die vorgestellte explorative Biomarker-Analyse (3) untersuchte die Korrelation zwischen ctDNA-Ansprechrate nach neoadjuvanter Atezolizumab Therapie mit einem kompletten pathologischen Therapieansprechen (pCR) im Zystektomiepräparat sowie mit dem krankheitsfreien Überleben (DFS). Die ctDNA Ergebnisse lagen bei insgesamt 40 der 59 in die Studie eingeschlossenen Patienten vor, davon waren 25 (63 %) ctDNA positiv. Zehn der 25 ctDNA positiv getesteten Pat. (40 %) erreichten eine ctDNA Reduktion von 50 %, bei drei (8 %) war nach neoadjuvanter Therapie keine ctDNA mehr nachweisbar. Bei 30 % der 10 Patienten mit lediglich einer ctDNA Reduktion von 50 % trat innerhalb von 2 Jahren ein Rezidiv auf. Eine Reduktion der ctDNA von 50 beziehungsweise 75 % zeigte keine Korrelation zur erzielten pCR (p=0.24). Es bestand auch kein Zusammenhang zwischen pCR-Rate, ctDNA Ansprechen und dem PD-L1 Status. Im Gegensatz musste bei keinem der Patienten mit vollständiger ctDNA Negativierung ein Rezidiv beobachtet werden. Die Autoren schlussfolgerten, dass eine vollständige ctDNA Negativierung selten ist, jedoch mehr Rückschlüsse auf das Vorhersagen eines Rezidivs zulässt als eine 50 % Reduktion. Die Negativierung der ctDNA sollte daher als Endpunkt in zukünftige neoadjuvante Therapiestudien inkludiert werden.
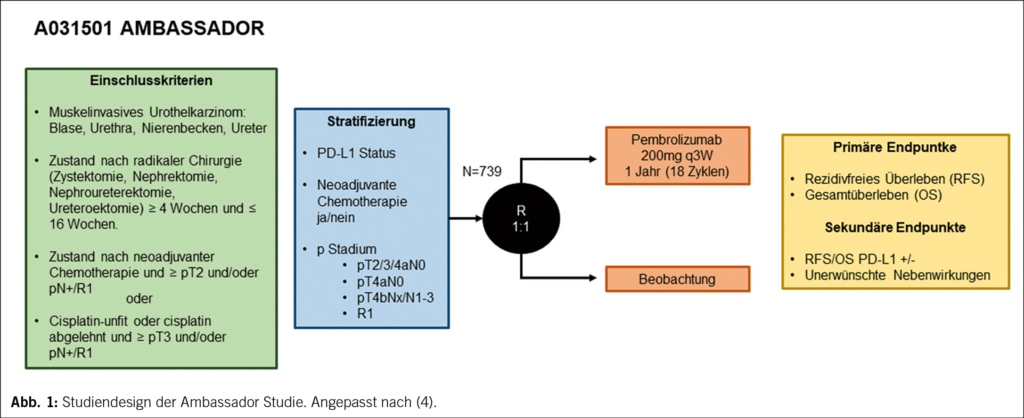
Die AMBASSADOR Studie: Adjuvante Gabe von Pembrolizumab
Das muskelinvasive Urothelkarzinom (MIUC) ist eine aggressive Erkrankung mit Rezidivraten von über 50 % nach alleiniger Zystektomie. Im Rahmen der randomisierten, multizentrischen, nicht verblindeten Phase III AMBASSADOR Studie (4) wurde eine adjuvante Pembrolizumab Therapie zur Senkung der Rezidivrate evaluiert. Eingeschlossen wurden Patienten mit histologisch gesichertem lokalisierten MIUC der Blase, des oberen Harntraktes oder der Urethra, die nach neoadjuvanter Cisplatin Chemotherapie (NAC), beziehungsweise bei Cisplatin-unfitten Patienten ohne NAC, die mindestens ein pT3 Stadium oder pN+ oder positive Resektionsränder aufwiesen (Abb. 1). Im Anschluss an die radikale Chirurgie erfolgte die Randomisierung in den Interventionsarm mit Pembrolizumab 200 mg absolut alle 3 Wochen für 1 Jahr bzw. in den Observationsarm. Duale primäre Endpunkte waren das krankheitsfreie (DFS) und das Gesamtüberleben (OS). Zwischen 09/2017 und 08/2021 wurden insgesamt 702 Patienten eingeschlossen. Die FDA-Zulassung 2021 von Nivolumab zur adjuvanten Therapie des MIUC erzwang den vorzeitigen Rekrutierungsstopp der Studie. Der mediane Nachbeobachtungszeitraum betrug 22.3 Monate für DFS und 36.9 Monate für OS. Das mediane DFS betrug 29.0 Monate im Interventionsarm vs. 14 Monate im Beobachtungsarm (HR 0.69; p=0.0013) und war damit signifikant. Hinsichtlich dem OS zeigte sich bei einer vorläufigen Zwischenanalyse kein statistisch signifikanter Unterschied (50.9 vs. 55.8 Monate; p=0.88). Unerwünschte Ereignisse Grad ≥ 3 traten bei 48,4 % versus 31,8 % der Patienten im Pembrolizumab- bzw. Beobachtungsarmen auf. PD-L1 Positivität (CPS ≥ 10) war kein prädiktiver Biomarker hinsichtlich des Therapieansprechens (HR 0.77; p=0.091). Bei der Interpretation der Studienergebnisse und dem bislang fehlenden OS-Benefit ist erwähnenswert, dass 10 % der Patienten im Observationsarm ihre Einwilligung zur Studienteilnahme zurückzogen und weiter 21 % im Verlauf eine Immuntherapie mit Nivolumab erhielten.
Metastasiertes muskelinvasives Urothelkarzinom
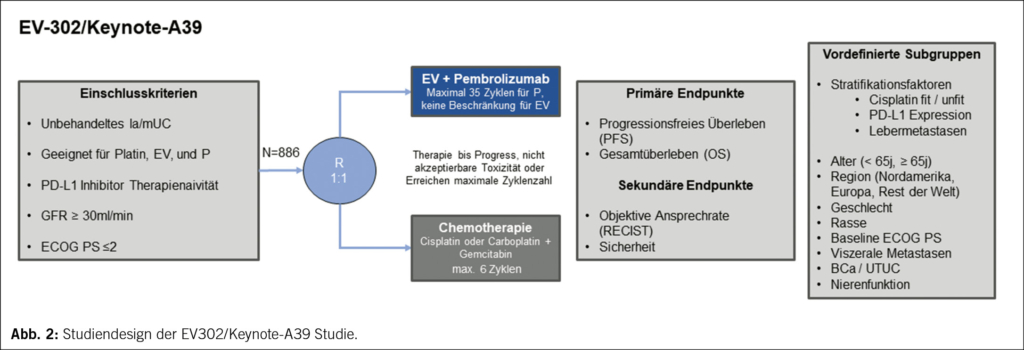
Phase III EV-302 Studie (Enfortumab vedotin + Pembrolizumab): Analyse verschiedener Subgruppen
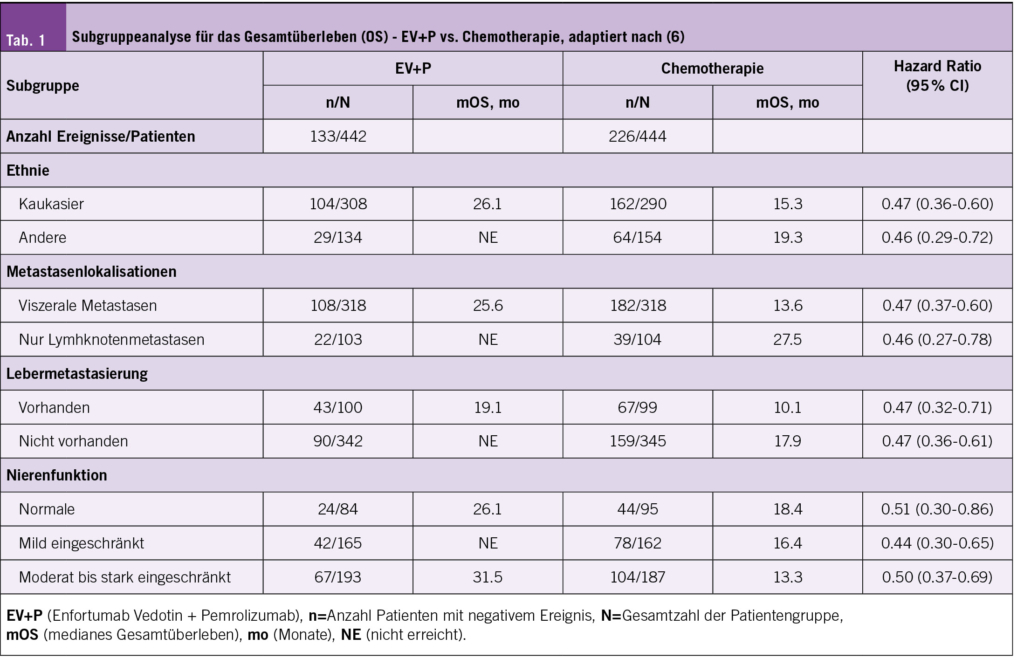
Die Erstlinientherapie des lokal fortgeschrittenen und metastasierten Urothelkarzinoms (la/mUC) wurde durch die Resultate der EV-302 / KEYNOTE A39 Studie (5) (Abb. 2) revolutioniert, welche die Platin-basierte Chemotherapie durch die Kombination des gegen Nectin 4 gerichteten Antibody-Drug-Konjugats Enfortumab Vedotin in Kombination mit dem PD-1 Checkpointinhibitor Pembrolizumab (EV+P) als Standardtherapie ablöste. Die Kombinationstherapie EV+P führt zu einer nahezu Verdoppelung des mittleren OS (31.5 vs. 16.1 Monate, HR 0.47, p<0.00001). Die Präsentation der beeindruckenden DFS und OS Daten von insgesamt 886 eingeschlossenen Patienten erfolgte bereits am ESMO 2023. Im Rahmen des GU ASCO 2024 erfolgte nun die Präsentation bisher nicht veröffentlichter Analysen zu verschiedenen Subgruppen (6). Stratifiziert wurde nach den Subgruppen Cisplatin fit/unfit, PD-L1 Status hoch/niedrig, Lebermetastasen ja/nein und Nierenfunktion. In allen Subgruppen zeigte sich ein konsistenter signifikanter Vorteil in Bezug auf das OS und das progressionsfreie Überleben (PFS) zugunsten der EV+P Therapie, auch in Subgruppen, welche in der Vergangenheit mit einem schlechten Therapieergebnis vergesellschaftet waren. In Bezug auf die Cisplatin “Fitness” bestand in beiden Gruppen ein Vorteil zugunsten der EV+P Therapie (medianes OS Cisplatin-fit EV+P vs. Chemotherapie: 31.5 vs 18.4 Monate; Cisplatin-unfit NR vs. 12.7 Monate). Das Gleiche wurde für die PD-L1 Expression gezeigt (medianes OS, EV+P vs. Chemotherapie, CPS < 10 NR vs. 15.5 Monate, CPS ≥ 10 31.5 vs. 16.6 Monate). Weitere Resultate der Subgruppenanalyse sind in Tabelle 1 dargestellt Die Ergebnisse der Subgruppenanalysen unterstützen die Rolle von EV+P als neuer Standard in der Erstlinienbehandlung des la/mUC.
Cisplatin-unfitte Patienten mit fortgeschrittenem Urothelkarzinom: Kombinationstherapie von Cabozantinib und Pembrolizumab
Die Behandlungsmöglichkeiten für cisplatin-unfitte und insbesondere platin-unfitte Patienten mit la/mUC waren in der Vergangenheit begrenzt. Die FDA-Zulassung für die Pembrolizumab Monotherapie zeigte eine hohe Rate an Progressionen. Tyrosin-Kinase-Inhibitoren wie Cabozantinib zeigten dagegen in präklinischen und klinischen Studien in Kombination mit PD-1 Inhibitoren vielversprechende Resultate (7). In einer “open-label”, Phase II Studie (8) wurde die Tolerabilität und Aktivität der Kombinationstherapie Pembrolizumab + Cabozantinib in Cisplatin-unfitten Patienten untersucht. Im Zeitraum von 12/2018 bis 04/2024 wurden insgesamt 36 Patienten in die Studie eingeschlossen. Ein Therapieansprechen konnte bei 15 Patienten (42.8 %) festgestellt werden. Das mediane DFS betrug 7.6, das mediane OS 17.1 Monate. Unerwünschte Arzneimittelnebenwirkungen traten bei 33 Patienten (91.6 %) auf, wobei es sich in 18 Fällen (50 %) um Nebenwirkungen des Schweregrades 3 oder höher handelte. Biomarker Analysen zur Verbesserung der Patientenselektion sind in Zukunft geplant. Es ist zu bezweifeln, ob sich diese Kombinationstherapie bei der hohen Nebenwirkungsrate und im Hinblick auf die neue Standardtherapie mit EV plus Pembrolizumab behaupten wird.
Copyright Aerzteverlag medinfo AG
Kantonsspital Luzern
Klinik für Urologie
Spitalstrasse
6000 Luzern
Kantonsspital Luzern
Klinik für Urologie
Spitalstrasse
6000 Luzern
Universitätsspital Zürich
Klinik für Medizinische Onkologie und Hämatologie
Rämistrasse 100
8091 Zürich
anja.lorch@usz.ch
FA: keine. CF: Research support (institutional): Gilead, MSD. Speaker (compensated, institutional): Janssen. AL: EAU Guideline Blase, Astellas, Astra Zeneca, Bayer, BMS, Esai, Ipsen, Janssen, Merck, MSD, Novartis, Pfizer, Roche.
- Die ctDNA ist ein potenziell vielversprechender Biomarker, insbesondere bei komplettem molekularen Therapieansprechen.
- Die AMBASSADOR Studie zeigt für die adjuvante Gabe von Pembrolizumab bezüglich des DFS signifikanten Vorteil unabhängig vom PD-L1 Status.
- EV+P behauptet in den Subgruppenanalysen seinen Platz als neuer Standard in der Erstlinientherapie des lokal fortgeschrittenen und metastasierten Urothelkarzinoms.
- Die Kombination Pembrolizumab und Cabozantinib ist bei Cisplatin-unfitten Patienten mit metastasierten Urothelkarzinomen wirksam, ist aber durch die hohe Nebenwirkungsrate umstritten
1. Powles T, Kockx M, Rodriguez-Vida A, Duran I, Crabb SJ, Van Der Heijden MS, u. a. Clinical efficacy and biomarker analysis of neoadjuvant atezolizumab in operable urothelial carcinoma in the ABACUS trial. Nat Med. November 2019;25(11):1706–14.
2. Powles T, Assaf ZJ, Davarpanah N, Banchereau R, Szabados BE, Yuen KC, u. a. ctDNA guiding adjuvant immunotherapy in urothelial carcinoma. Nature. 15. Juli 2021;595(7867):432–7.
3. Young MN, Szabados B, Assaf Z, Jackson-Spence F, Nally E, Wells C, u. a. Predictive value of dynamic changes in ctDNA and baseline biomarkers with neoadjuvant atezolizumab in operable urothelial carcinoma in the ABACUS trial. J Clin Oncol. 1. Februar 2024;42(4_suppl):534–534.
4. Apolo AB, Ballman KV, Sonpavde GP, Berg SA, Kim WY, Parikh RA, u. a. AMBASSADOR Alliance A031501: Phase III randomized adjuvant study of pembrolizumab in muscle-invasive and locally advanced urothelial carcinoma (MIUC) vs observation. J Clin Oncol. 1. Februar 2024;42(4_suppl):LBA531–LBA531.
5. Powles TB, Perez Valderrama B, Gupta S, Bedke J, Kikuchi E, Hoffman-Censits J, u. a. LBA6 EV-302/KEYNOTE-A39: Open-label, randomized phase III study of enfortumab vedotin in combination with pembrolizumab (EV+P) vs chemotherapy (Chemo) in previously untreated locally advanced metastatic urothelial carcinoma (la/mUC). Ann Oncol. Oktober 2023;34:S1340.
6. Van Der Heijden MS, Powles T, Gupta S, Bedke J, Kikuchi E, De Wit R, u. a. Enfortumab vedotin (EV) in combination with pembrolizumab (P) versus chemotherapy in previously untreated locally advanced metastatic urothelial carcinoma (la/mUC): Subgroup analyses results from EV-302, a phase 3 global study. J Clin Oncol. 1. Februar 2024;42(4_suppl):LBA530–LBA530.
7. Apolo AB, Nadal R, Girardi DM, Niglio SA, Ley L, Cordes LM, u. a. Phase I Study of Cabozantinib and Nivolumab Alone or With Ipilimumab for Advanced or Metastatic Urothelial Carcinoma and Other Genitourinary Tumors. J Clin Oncol. 1. November 2020;38(31):3672–84.
8. Jain RK, Swami U, Bilen MA, Boucher KM, Brown JT, Chahoud J, u. a. Cabozantinib plus pembrolizumab as first-line therapy for cisplatin-ineligible advanced urothelial carcinoma (PemCab). J Clin Oncol. 1. Februar 2024;42(4_suppl):539–539.
info@onco-suisse
- Vol. 14
- Ausgabe 4-5
- August 2024