- Will CARs bite the BITEs?
Der diesjährige IO-ESMO-Kongress in Genf begann mit einem Primer, der von der SITC (Society for Immunotherapy of Cancer) und der ESMO gemeinsam organisiert wurde.
Von den Referenten wurde ein sehr guter Überblick über die grundlegenden Mechanismen des Immunsystems sowie dessen Interaktion mit malignen Tumoren gegeben. Bezogen auf die Checkpointblockade wurde aber auch nochmals klar darauf hingewiesen, dass wir nach ca. 10 Jahren der klinischen Anwendung immer noch nicht wissen, wie der Wirkmechanismus im einzelnen Patienten von statten geht. Ausserdem können das Ansprechen und Nicht-Ansprechen nicht vorhergesehen werden. Beide Phänomene lassen sich bis jetzt nicht messen, da nach wie vor die entsprechenden Marker fehlen. Es war beeindruckend zu sehen, wie einig sich alle anwesenden Referenten in Bezug auf das Nicht-Wissen waren.
Diskussion CD19-gerichteter Therapien
Ich war als Referent eingeladen, zum Thema bispezifische Antikörper und chimäre Antigenrezeptoren den Wissensstand zusammenzufassen. Dieses ist eine etwas dankbarere Aufgabe, als die Erklärung der Checkpointblockade, da der mechanistische Ansatz hier doch deutlicher zu erkennen ist. Einschränkend muss aber für diesen therapeutischen Ansatz erwähnt werden, dass bis jetzt nur konklusive klinische Daten für den Einsatz gegen das Zielantigen CD19 vorliegen. Weitere Antigene, vor allem auch bei soliden Tumoren, werden zwar getestet, aber die ersten Ergebnisse sind deutlich weniger beeindruckend als die gegen CD19. Somit hatte ich mich während meines Vortrages aus edukativen Überlegungen auf die Diskussion CD19-gerichteter Therapien fokussiert.
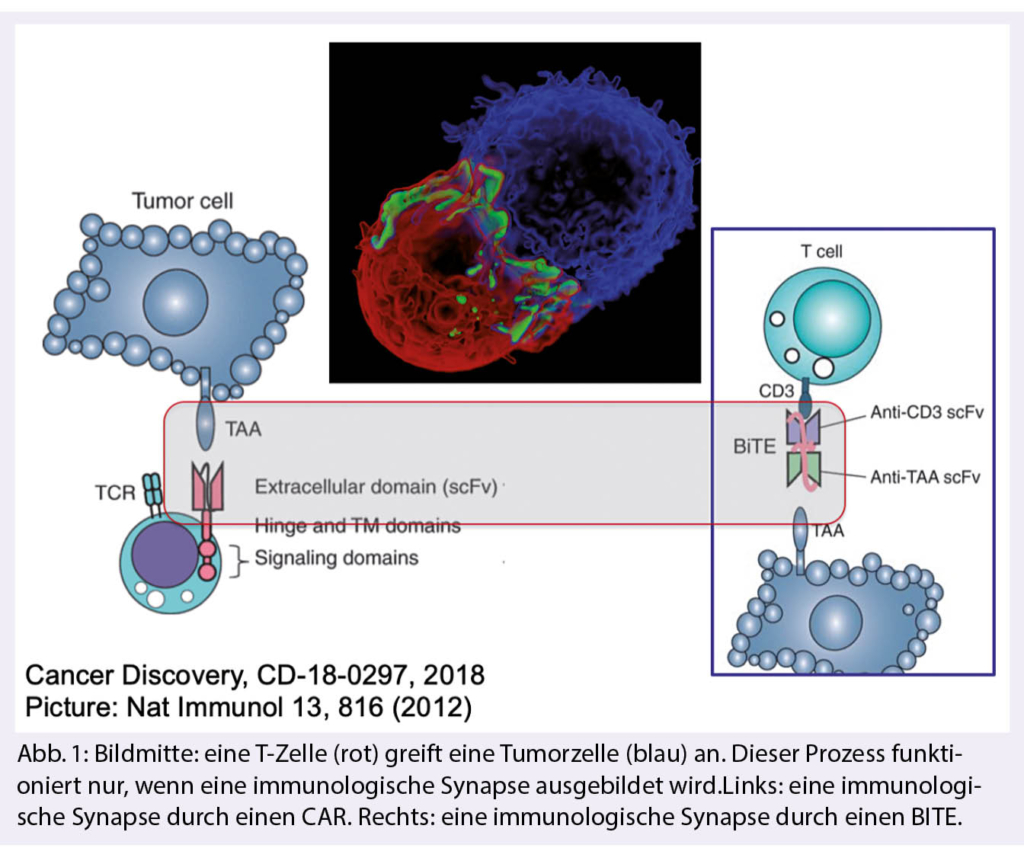
Zunächst hatte ich die strukturellen Unterschiede zwischen bispezifischen Antikörpern und chimären Antigenrezeptoren erklärt, wobei ich bei den bispezifischen Antikörpern exemplarisch auf die BITE (Bi-specific T-cell engager) Technologie eingegangen bin. Ziel beider therapeutischer Ansätze ist die Formation einer artifiziellen immunologischen Synapse zwischen T-Zellen und Tumorzellen, um den T-Zellen die Möglichkeit zu geben, die Tumorzellen abzutöten. Die BITEs sind Antikörper, die aufgrund ihres Designs zwei Strukturen erkennen und binden können. So bindet der klinisch zugelassene und in klinischen Studien getestete Antikörper Blinatumomab an CD19 und CD3 und stellt somit eine Art Brücke zwischen der Tumorzelle (CD19 positiv) und T-Zelle (CD3 positiv) her. Dieses führt dann zur Ausformung der immunologischen Synapse. Chimäre Antigen Rezeptoren (CARs) sind synthetische Rezeptoren, die aus einem Antigen-bindenden Fragment und Signaldomänen bestehen, die T-Zellen aktivieren können. Um diese Rezeptoren zum Einsatz zu bringen, muss die genetische Information der Rezeptoren mittels Gentransfer ausserhalb des Körpers in die T-Zellen des jeweiligen Patienten eingebracht werden. Dieses ist ein technisch und logistisch sehr aufwendiges Verfahren. Derzeit sind zwei gegen CD19 gerichtete CARs in der Schweiz zugelassen und kommerziell erhältlich (Axicabtagene Ciloleucel und Tisagenlecleucel). T-Zellen, die den CAR exprimieren, werden dann mittels einer autologen Transfusion dem Patienten zurückgegeben und können CD19 positive Tumorzellen erkennen und abtöten.
Studienlandschaft
Im Weiteren hatte ich die aktuelle Studienlandschaft diskutiert. Drei grössere Studien konnten klar die Wirksamkeit 3 unterschiedlicher gegen CD19 gerichteter CARs bei Patienten mit rezidivierter ALL und rezidivierten aggressiven Lymphomen demonstrieren (N Engl J Med 2019; 380:45-56, N Engl J Med 2018; 378:449-459, N Engl J Med 2017; 377:2531-2544). In allen Studien tauchten die bekannten Nebenwirkungen einer Therapie gegen CD19 mittels CARs auf. Es ist in 15% der Patienten zu einem höhergradigen Cytokine Release Syndrom und in 25% der Patienten zu höhergradigen neurotoxischen Nebenwirkungen gekommen. Das Cytokine Release Syndrom kann effizient mit Tocilizumab behandelt, die Neurotoxizität mit Steroiden kontrolliert werden. Es zeigt sich, dass die Nebenwirkungen immer besser verstanden und behandelt werden können, so dass diese der weiteren Verbreitung der Therapie in keinster Form im Wege stehen. Als Ausblick auf die CAR Therapie bin ich auf BCMA (B-cell maturation antigen) spezifische CARs eingegangen. Das BCMA Antigen wird auf Myelomzellen exprimiert und ist somit eine attraktive therapeutische Zielstruktur für diese Erkrankung. Eine klinische Studie konnte ein Ansprechen in 85% aller Patienten aufzeigen (N Engl J Med 2019; 380:1726-1737). Um die ersten Schritte und die hiermit verbundenen Probleme bei soliden Tumoren zu demonstrieren, habe ich unsere eigene CAR T-Zell Studie beim malignen Pleuramesotheliom vorgestellt. Hier liegen bis jetzt nur publizierte Daten des ersten Patienten vor (Clin Cancer Res. 2018 Aug 15;24(16):3981-3993, BMC Cancer. 2012 Dec 22;12:615). Das Zielantigen dieser Studie war FAP (Fibroblasten-Aktivierungs-Protein). Ein solches Antigen wird nicht nur in malignen Tumoren exprimiert, sondern auch in entzündeten Geweben. Somit können leicht unkontrollierte Nebenwirkungen entstehen. Dieses Konstrukt könnte sogar eines Tages als Therapie gegen chronisch entzündliche Erkrankungen eingesetzt werden (N Engl J Med 2019; 381:2475-2476), was darauf hinweist wie komplex die biologischen Effekte sein können. Da es hier sehr viel Unwägbarkeiten gibt, wurde der erste Patient nur mit einer sehr geringen Anzahl FAP-spezifischer CAR tragender T-Zellen behandelt, um eine grundsätzliche Machbarkeit zu zeigen.
Spannend aus meiner Sicht war nun der Vergleich dieser aufwendigen zellulären Therapien gegenüber der BITE Technologie. Blinatumomab ist ein relativ kleines Molekül, das als Dauerinfusion verabreicht werden muss, aber in keinster Form so aufwendig in der Herstellung wie autologe CAR-tragende T-Zellen ist. Es wurde eine Studie bei Patienten mit rezidivierter ALL durchgeführt (N Engl J Med 2017; 376:836-847). Hierbei zeigte sich ein signifikant verlängertes Gesamtüberleben und krankheitsfreies Überleben. Aber im Gegensatz zur CAR Therapie kommen weniger Patienten in eine langfristige Remission, so dass die BITE Technologie eher als Brückentherapie zur allogenen Stammzelltransplantation gesehen wird.
Interessant war die zeitliche Überschneidung des ASH-Meetings in Orlando und dem IO-ESMO Meeting. Passend zu meinem Referat wurden weitere Daten zu bispezifischen Antikörpern präsentiert. Zum Beispiel zeigte der CC-93269 Antikörper im IgG Format, welcher CD3 und BCMA bindet, beim Multiplen Myelom ein Ansprechen von 88%. Diese Daten sind sehr vergleichbar mit denen der publizierten BCMA CARs.
Fazit
Aus meiner Sicht wird sich in den nächsten Jahren eine spannende Konkurrenzsituation zwischen bispezifischen Antikörpern und chimären T-Zellrezeptoren ergeben. Ich denke, dass für die Antikörper die einfachere Herstellung, die leichte Applikation und damit grössere allgemeine Nutzbarkeit sprechen. Die zelluläre Therapie bietet aber eventuell grössere immunologische Manipulationen an, wie zum Beispiel der Gentransfer verschiedener CARs in einer T-Zellpopulation an.
Quelle: ESMO Immuno-Oncology Congress, Genf, 11.-14.12.2019
OnkoZentrum Zürich
Seestrasse 259
8038 Zürich