- Aide à la décision algorithmique pour la prise en charge des embolies pulmonaires
Les embolies pulmonaires présentent un spectre clinique très large, ce qui nécessite une approche diagnostique et thérapeutique adaptée. Il est nécessaire d’ adopter une approche thérapeutique adaptée. Diverses aides ont été développées et testées à cet effet, comme par exemple des scores. Bien que validés, ils sont souvent mal utilisés ou ne profitent qu’ à des sous-groupes de patients. Une approche standardisée pour l’ évaluation et la thérapie est donc indispensable.
Pour le peu de temps et l’ abondance d’ informations et de scores, il s’ agit ici de présenter une procédure simple, basée sur des preuves afin d’ éviter des diagnostics inutiles, coûteux en temps et en argent.
The clinical pattern of pulmonary embolism shows a very broad clinical spectrum, on which the determination of diagnostics and therapies are oriented. There are various scores for this purpose, developed, tested and validated, but often not used correctly or giving benefit only to subgroups of patients. A standardized procedure for clarification and therapy is therefore essential.
Given the limited time and abundance of information and scores, we show an evidence-based, streamlined procedure in order to avoid possibly harmful as well as time- and cost-intensive diagnostics.
Key Words: embolie pulmonaire, pulmonary embolism, thrombembolie, thrombembolism, scores, estimation du risque, risk assessment
La plupart des lecteurs de cet article l’ auront déjà rencontrées, diagnostiqués et traitées à plusieurs reprises : Les embolies pulmonaires avec une incidence mondiale d’ environ 10 millions de cas par an, sont l’ une des principales maladies cardiovasculaires. C’ est la troisième maladie cardiovasculaire la plus fréquente après l’ infarctus du myocarde et l’ accident vasculaire cérébral, dont le risque augmenté est nettement plus élevé dès l’ âge de 40 ans et il augmente à partir de 60 ans et double à chaque décennie supplémentaire. Les embolies pulmonaires sont la cause probable de 8 à 13% des arrêts cardiaques inexpliqués (1) et l’ une des principales causes de décès chez les femmes enceintes dans le monde occidental (2).
La procédure en cas de suspicion d’ embolie pulmonaire est adaptée par étapes – en fonction du risque et de la clinique (3). Tout commence par évaluer le risque en fonction du tableau clinique. Un risque élevé se traduit par un choc, une chute de tension ou une nécessité de réanimation.
Non-high risk
Dans les cas (les plus fréquents dans les cabinets de médecins de famille) «stables», les constellations non à haut risque sont suivies d’ une évaluation du risque et immédiatement suivie de la détermination de la probabilité de pré-test (fig. 1). Le score de Wells simplifié (simplified Wells Score, qui comprend les signes cliniques TVP, EP plus probable qu’ un autre diagnostic, EP/TVP antérieurs, pouls, st. après opération/immobilisation, malignité, hémoptysie) ou le Geneva Score révisé simplifié (simplified revised Geneva score; celui-ci prend l’ âge en plus en compte). En outre, il faut toujours tenir compte de la présentation clinique pour déterminer la probabilité de pré-test. Cela peut déjà se faire par exemple au moyen de la simple question : « Une embolie pulmonaire est-elle possible pour moi sur la base de la présentation clinique? »; si la réponse est “oui”, (p. ex. en cas de jambe enflée), une embolie pulmonaire n’ est plus improbable!
Si l’ on parvient, au moyen des scores et de la clinique susmentionnés, à une faible probabilité pré-test de <15% (4) (et seulement dans ce cas !) on peut utiliser la règle PERC (qui comprend: l’âge, le pouls, la saturation en oxygène, le gonflement d’ un seul côté de la jambe, hémoptysie, le st. après trauma/ chirurgie, le st. après thromboembolie veineuse, hormonothérapie) pour les embolies pulmonaires (5). Il faut noter ici la prévalence plutôt faible des études de validation.
Dans le cas contraire, on procède à la détermination des D-dimères. En fonction du résultat et de l’ âge du patient (>50 ans cut off ajusté à l’ âge: âge x 0,01 μg/ml), la nécessité d’ une imagerie est impliquée (6). Il est toutefois important de noter ici que les D-dimères sont surtout significatifs en cas d’ événement aigu! Si l’ événement thrombotique remonte déjà à quelques jours, des taux négatifs des D-diméres ne permettent pas de prendre une décision, même dans les situations à faible risque (pour les situations à haut risque, la sensibilité n’ est de toute façon pas suffisante).
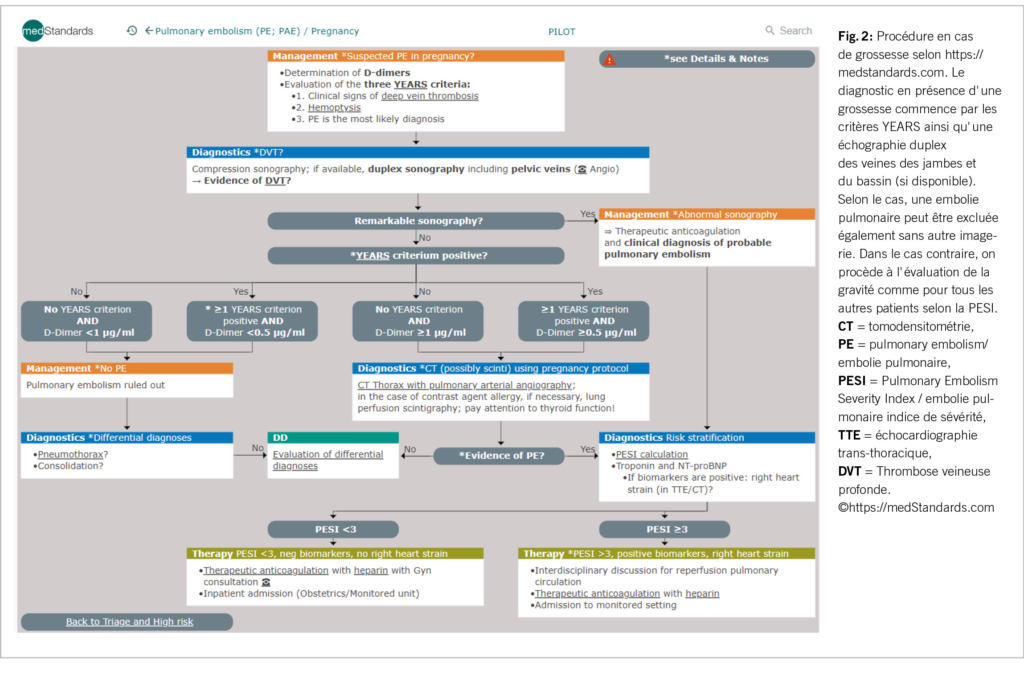
Comme outil de diagnostic simplifié, les critères de Years (2) peuvent éventuellement être pris en compte (comprend : clinique, hémoptysie, probabilité). Ceci surtout en cas de grossesse (fig. 2), ou pour gagner du temps dans d’ autres cas aussi pour obtenir une vue d’ ensemble. Ces critères nécessitent toutefois une évaluation en dehors d’ une grossesse (3).
Risque intermédiaire
En présence de facteurs de risque dans l’ évaluation initiale, respectivement d’ aucune probabilité de pré-test faible et si le diagnostic ultérieur n’ est pas immédiatement disponible, l’ administration d’ Héparine 5.000 UI i.v. doit être effectuée, afin d’ éviter la progression de l’ événement thromboembolique présumée.
Si une embolie pulmonaire est détectée lors de l’ imagerie suivante, et si l’ hémodynamique est stable, l’ interprétation se fait en tenant compte de la clinique et des comorbidités. Pour cela, il faut la répartition des degrés de gravité ou la classification des risques en termes de risque de mortalité en Low Risk, Intermediate-Low Risk, Intermediate-High Risk (et High Risk = instabilité, risque de mortalité élevé). Cela se fait par le calcul du score PESI (simplifié) à l’ aide de facteurs cliniques et anamnestiques (l’ âge, le sexe, les paramètres vitaux, les antécédents).
En plus du score PESI, la décision thérapeutique définitive nécessite la détermination de la troponine et du NT-proBNP et, en cas de biomarqueurs positifs, une échocardiographie transthoracique (ETT) avec la question de signes de stress cardiaque droit ou l’ évaluation de la tomodensitométrie (TDM) pour les signes indirects de charge cardiaque droite ou d’ une pneumonie par infarctus. Une visualisation directe du matériel thrombogène dans l’ ETT est aussi suffisante (3).
Risque élevé
Rapidité et fermeté caractérisent la procédure chez les patients à haut risque (nécessité de réanimation, choc) et l’ absence d’ autres diagnostics différentiels plus probables (fig. 3). Cette constellation plaide en faveur d’ une obstruction importante de la voie artérielle pulmonaire par un thrombus embolisé. En situation de réanimation et de suspicion d’ embolie pulmonaire, il faut immédiatement lyser sans autre diagnostic (50mg d’ altéplase i.v. en bolus sans interrompre la réanimation) afin d’ améliorer le résultat (rétablissement plus rapide d’ une circulation spontanée – ROSC), suivi d’ un bolus de 5.000 U d’ héparine i.v. (1).
Même le cas de dysfonctionnement endogène avec une pression systolique <90mmHg et/ou une hypotension passagère est déjà une situation à haut risque. En présence d’ une telle probabilité d’ une embolie pulmonaire à «haut risque”, mais sans nécessité de réanimation, il faut d’ abord administrer immédiatement de l’ héparine 5.000 UI i.v. Un scanner thoracique avec angiographie n’ est ensuite effectué que s’ il est disponible immédiatement et sans retard significatif par rapport à l’ ETT. Pour la décision thérapeutique, il faut, en plus de la preuve par imagerie médicale d’ une embolie pulmonaire, de signes d’ atteinte du cœur droit ou d’ une pneumonie par infarctus. Une visualisation directe du matériel thrombogène dans l’ ETT est aussi suffisante (3).
Si cela réussit, il faut, dans la situation “à haut risque”, prendre des mesures appropriées pour reperfuser la circulation pulmonaire doivent être envisagées. Dans tous les cas, il faut une surveillance appropriée, par exemple dans une unité de soins intensifs.
La thérapie
Pour la décision thérapeutique, la fragilité (par ex. Clinical Frailty Scale – CFS) doit être prise en compte.
Pour un traitement ambulatoire, outre l’ évaluation des risques, l’ information du patient avant la sortie est également importante (fig. 4).
En cas de PESI III et IV, une hospitalisation est nécessaire, le cas échéant dans une unité de surveillance continue. Le choix du traitement par lyse se décide en fonction de la stabilité et de la disponibilité des procédés (fig. 1). En cas d’ aggravation ou d’ absence d’ amélioration clinique une lyse peut et doit être réévaluée.
Le traitement initial (5-21 jours) est suivi d’ un traitement d’ entretien de 3 mois. En cas d’ embolie pulmonaire non provoquée une évaluation individuelle de l’ anticoagulation est effectuée après 3-6 mois (en tenant compte des avantages, des risques, de la situation du patient) ainsi qu’ un suivi annuel (récidive, hypertension pulmonaire, complications hémorragiques, tumeur maligne?).
Cet article est une traduction de «der informierte arzt» 09_2023.
Copyright Aerzteverlag medinfo AG
medStandards
Universitätsspital Basel
Petersgraben 4
4031 Basel
Les auteurs n’ ont aucun conflit d’ intérêts à declarer en relation avec cet article.
◆ Le but de cet article n’ est pas de présenter de nouvelles avancées diagnostiques ou de présenter des thérapies. Il vaut bien plus la peine, face à une véritable jungle de scores, une approche claire, conforme aux lignes directrices et pragmatique: évaluation du risque (lors du triage/premier contact), probabilité pré-test (dans les situations non à haut risque), degré de gravité et risque de mortalité (après le diagnostic). PERC-Rule et critères YEARS peuvent – mais seulement dans des situations spécifiques – raccourcir l’ algorithme.
1. Sharifi M, Berger J, Beeston P, Bay C, Vajo Z, Javadpoor S; “PEAPETT” investigators. Pulseless electrical activity in pulmonary embolism treated with thrombolysis (from the “PEAPETT” study). Am J Emerg Med. 2016;34(10):1963-1967
2. van der Pol LM, Tromeur C, Bistervels IM, Ni Ainle F, van Bemmel T, Bertoletti L, Couturaud F, van Dooren YPA, Elias A, Faber LM, Hofstee HMA, van der Hulle T, Kruip MJHA, Maignan M, Mairuhu ATA, Middeldorp S, Nijkeuter M, Roy PM, Sanchez O, Schmidt J, Ten Wolde M, Klok FA, Huisman MV; Artemis Study Investigators. Pregnancy-Adapted YEARS Algorithm for Diagnosis of Suspected Pulmonary Embolism. N Engl J Med. 2019;380(12):1139-1149
3. Konstantinides SV, Meyer G, Becattini C, Bueno H, Geersing GJ, Harjola VP, Huisman MV, Humbert M, Jennings CS, Jiménez D, Kucher N, Lang IM, Lankeit M, Lorusso R, Mazzolai L, Meneveau N, Áinle FN, Prandoni P, Pruszczyk P, Righini M, Torbicki A, Van Belle E, Zamorano JL; 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). Eur Respir J. 2019;54(3):1901647
4. Kline JA, Courtney DM, Kabrhel C, Moore CL, Smithline HA, Plewa MC, Richman PB, O’ Neil BJ, Nordenholz K. Prospective multicenter evaluation of the pulmonary embolism rule-out criteria. J Thromb Haemost. 2008;6(5):772-80
5. Malavolta D, Quatela V, Moffat J, Ottolini BB; GrAM (Gruppo di Autoformazione metodologica). Effect of the Pulmonary Embolism Rule-Out Criteria on subsequent thromboembolic events among low-risk emergency department patients: the PROPER randomized clinical trial. Intern Emerg Med. 2019;14(2):309-310
6. Freund Y, Chauvin A, Jimenez S et al. Effect of a Diagnostic Strategy Using an Elevated and Age-Adjusted D-Dimer Threshold on Thromboembolic Events in Emergency Department Patients With Suspected Pulmonary Embolism: A Randomized Clinical Trial. JAMA 2021; 326: 2141–2149 7.
Abbildungen und Algorithmus aus https://medStandards.com. Dank an Dr. med. Lucas Dratz für die erste Version in medStandards.
la gazette médicale
- Vol. 12
- Ausgabe 7
- Dezember 2023