- Anticoagulants oraux directs : Sécurité de la prescription en pratique gériatrique.
L’ histoire des anticoagulants a bénéficié d’ un nouveau tournant au début des années 2000, avec l’ arrivée sur le marché des anticoagulants oraux directs (ACODs). Cette nouvelle classe médicamenteuse permet de palier à certains inconvénients des antivitamines K (AVK) et figure parmi les traitements de première ligne dans la prévention et le traitement de nombreuses maladies cardiovasculaires. Leur utilisation dans la population gériatrique souvent polymédiquée et polymorbide est toutefois susceptible d’ engendrer un risque accru d’ évènements indésirables nécessitant une évaluation attentive de la balance bénéfice/risque lors de la prescription de ces médicaments.
The history of anticoagulants took a new turn in the early 2000s with the arrival on the market of direct oral anticoagulants (DOACs). This new class of drugs overcomes some of the drawbacks of anti-vitamin K drugs (VKAs) and is one of the first-line treatments for the prevention and treatment of many cardiovascular diseases. However, their use in the geriatric population, which is often multi-mediated and polymorbid, is likely to result in an increased risk of adverse events, requiring a careful assessment of the benefit/risk balance when prescribing these drugs.
Key Words: Anticoagulants oraux directs – interactions médicamenteuses – polymédication – sécurité – Personnes âgées
Introduction
Les anticoagulants oraux directs, le dabigatran (inhibiteur de la thrombine), le rivaroxaban, l’ apixaban et l’ édoxaban (inhibiteurs du facteur Xa), sont largement utilisés dans la maladie thromboembolique veineuse (MTEV) et la fibrillation auriculaire non valvulaire (1, 2). L’ arrivée des anticoagulants oraux directs (ACOD) a été perçue comme une avancée en raison de l’ absence de nécessité de suivre l’ activité anticoagulante et des dosages fixes. Les larges études pivots et méta-analyses ont montré une efficacité au moins similaire aux AVK et une baisse de la mortalité liée au saignement en raison principalement d’ une diminution des évènements hémorragiques intracrâniens en comparaison aux coumariniques (3-9), ces avantages étant également préservés chez le patient gériatrique (10). A l’ inverse, les hémorragies gastro-intestinales seraient plus nombreuses sous ACODs par rapport à la warfarine, quoique ce risque pourrait être moindre pour l’ apixaban selon des données rétrospectives (11-13).
La variabilité des concentrations des ACODs, un enjeu de sécurité pour les patients âgés
Bien que ces médicaments bénéficient d’ une plus grande marge thérapeutique que les AVK, des évidences croissantes suggèrent une relation claire entre le niveau d’ exposition aux ACODs et la survenue d’ hémorragies (3, 7, 14). Une telle relation semble aussi exister pour les évènements ischémiques bien que les données soient moins nombreuses (3, 7). Il existe en effet une importante variabilité des concentrations des ACODs dans la population cible recevant ces médicaments, principalement expliquée par l’ insuffisance rénale, les interactions médicamenteuses, le poids et l’ âge (15-17).
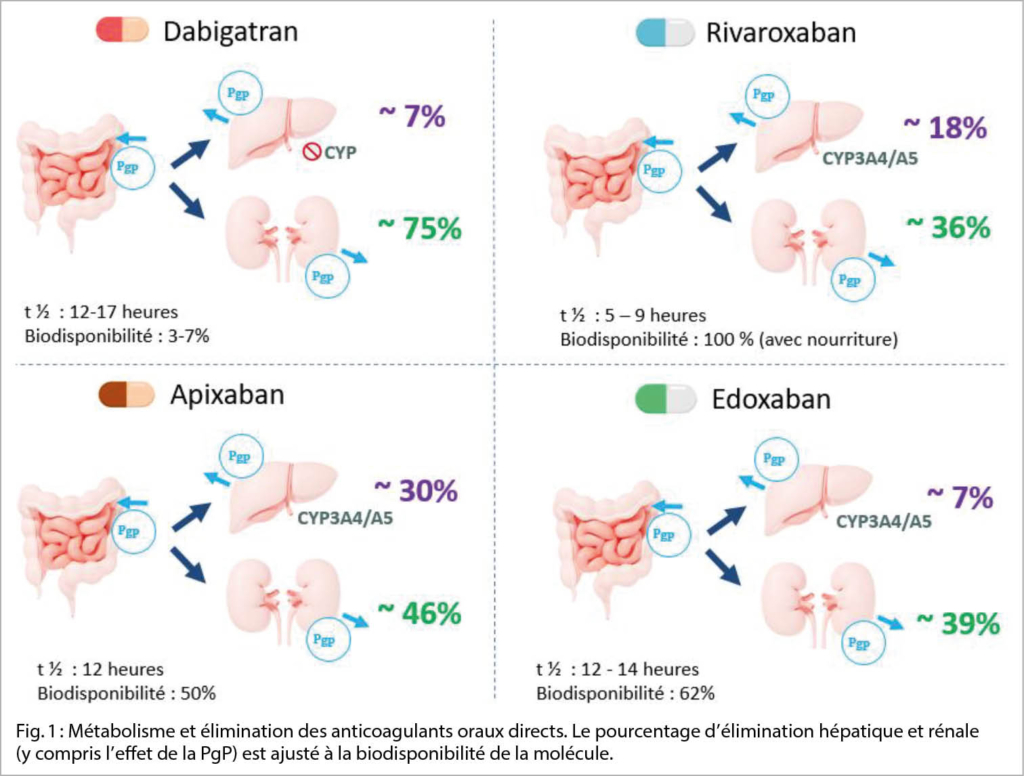
D’ un point de vue pharmacologique, les ACODs se distinguent entre eux par leur métabolisme et leur élimination (Table 1) ; ils sont tous substrats de la P-glycoprotéine (PgP) qui impacte leur biodisponibilité (18, 19). Le principal facteur de risque de surdosage est l’ insuffisance rénale (11, 15, 20, 21). L’ âge avancé ou un poids extrême (<50 kg ou > 120 kg) sont des facteurs de risque dans une moindre mesure (3, 22-24). Une étude de simulation évaluant la contribution de différents facteurs sur les concentrations de médicament indique que chaque facteur pris séparément augmente modérément l’ exposition aux ACOD, et c’ est surtout le cumul de ces facteurs de risque qui peut considérablement augmenter l’ exposition à ces médicaments (23).
Polymédication et gestion des risques
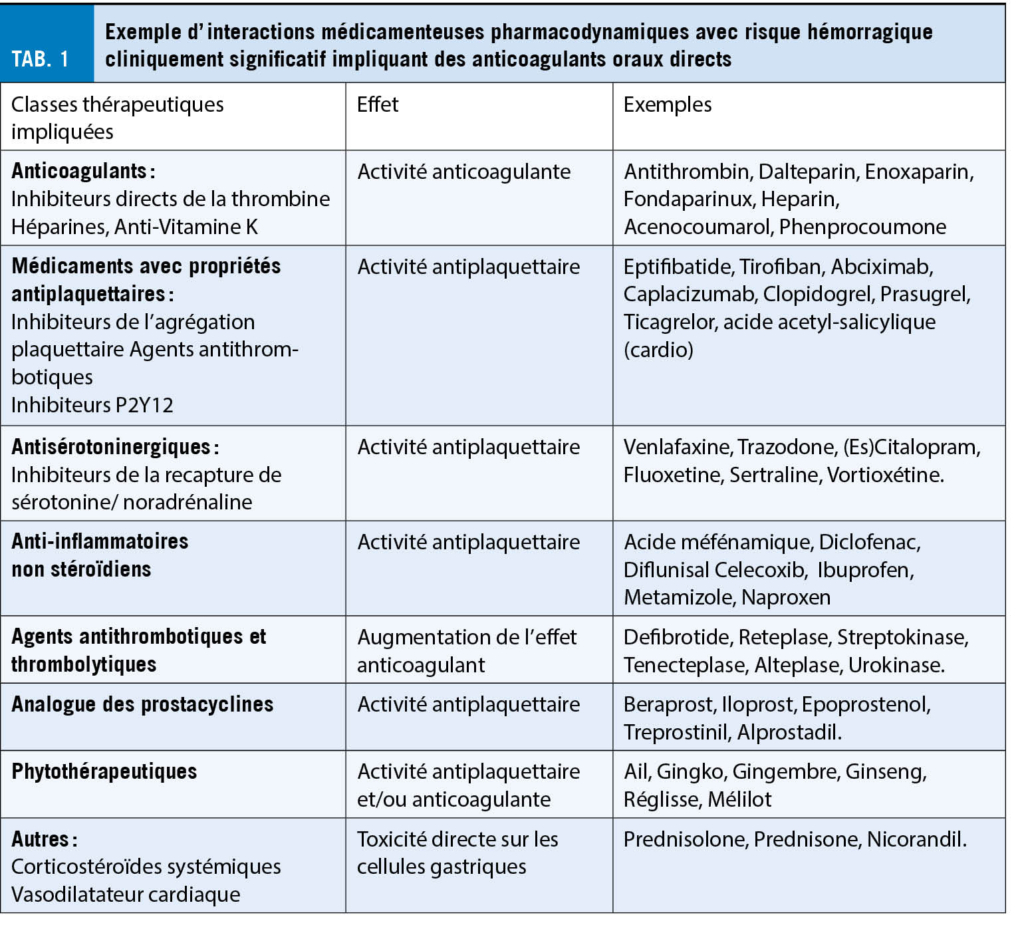
Les interactions médicamenteuses sont un facteur important de variabilité des concentrations, et leur gestion dans une population âgée souvent polymédiquée et polymorbide peut être complexe. Il existe deux types d’ interactions médicamenteuses : les interactions pharmacodynamiques, occasionnées par tout médicament ayant un effet additif ou antagoniste à l’ anticoagulant et modifiant son effet (thérapeutique ou toxique), et les interactions pharmacocinétiques affectant les concentrations de médicament (19, 25). Ces interactions médicamenteuses peuvent provoquer un sur ou sous-dosage et engendrer un potentiel événement indésirable médicamenteux. Une étude de cohorte a démontré une augmentation proportionnelle du risque hémorragique avec le nombre d’ interactions médicamenteuses, indiquant un odds ratio de 1.55 [CI 95 % : 1.46-1.63] lors de la prise concomitante d’ un ACOD avec un seul inhibiteur, et de 2.60 [CI 95 % : 2.44-2.77] avec ≥ 2 inhibiteurs (26). A l’ heure actuelle et à l’ exception de l’ edoxaban, il n’ existe pas d’ adaptation de dose validée pour les ACOD en présence d’ une interaction médicamenteuse.
D’ un point de vue de l’ effet, toute co-médication influençant l’hémostase augmente le risque hémorragique ou thrombotique. Les classes médicamenteuses classiquement impliquées dans ce type d’ interactions dont le risque est considéré comme augmenté sont résumées dans le Tableau 1. De nombreuses situations cliniques justifient la prise simultanée de deux ou plusieurs traitements actifs sur l’ hémostase, pour autant que la balance bénéfice/risque soit favorable. Dans de tels cas, une surveillance rapprochée pour la détection précoce des effets indésirables est recommandée.
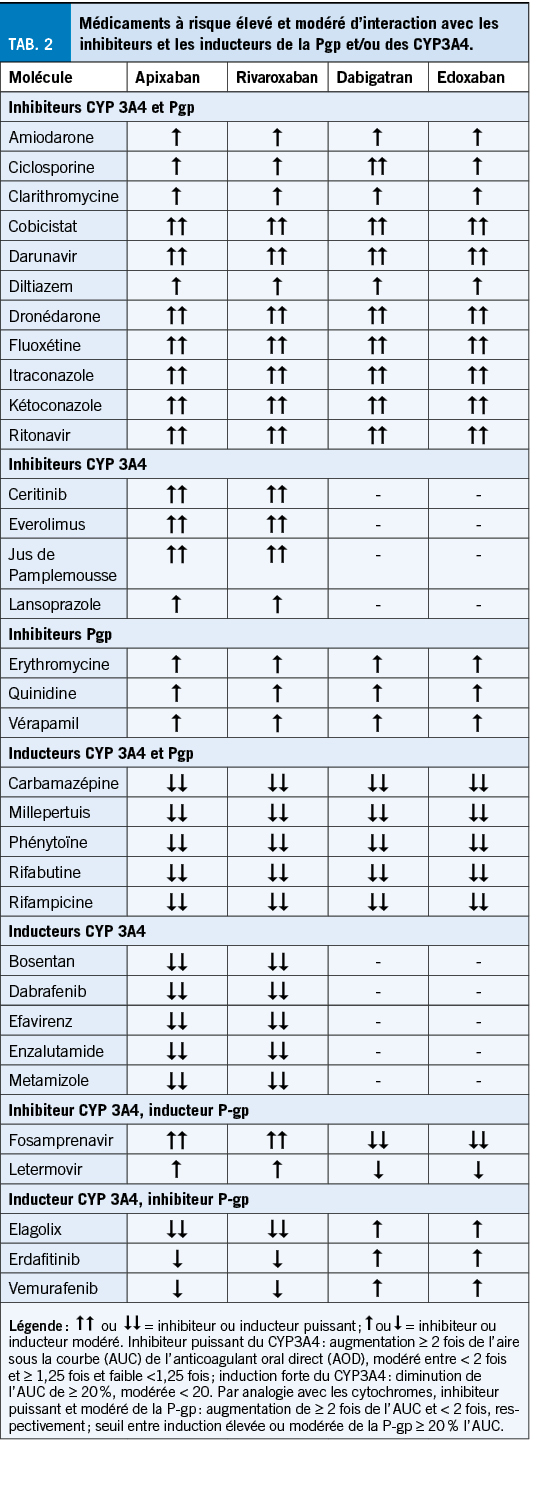
Les interactions pharmacocinétiques impliquent les médicaments modulateurs des cytochromes 3A4 (CYP3A4) et de la PgP. Ceux-ci sont catégorisés par la FDA en inhibiteurs/inducteurs forts, modérés ou faibles selon l’ augmentation ou la diminution de l’ exposition (aire sous la courbe AUC) en présence de l’ inhibiteur ou de l’ inducteur, respectivement (27). En raison de la sévérité des effets indésirables de ces médicaments, des marges plus faibles sont proposées en pratique pour les ACOD. La Table 2 présente quelques médicaments couramment utilisés ayant un risque d’ interaction pharmacocinétique modéré à majeur. D’ une façon générale, le risque d’ interaction est considéré comme majeur par la société européenne de rythmologie (28) et certains autres experts (29) lorsque l’ interaction médicamenteuse cause un doublement de l’ AUC d’ un ACOD dans le cas d’ un inhibiteur, et une diminution de plus de 20 % de l’ AUC dans le cas d’ un inducteur. De principe, il faudrait à chaque fois vérifier s’ il existe des données chez l’ humain (littérature, monographie du médicament) démontrant que de tels seuils sont atteints en présence d’ un inhibiteur/inducteur. Ceci concerne principalement les inhibiteurs/inducteurs puissants de la Pgp et les inducteurs/inhibiteurs modérés à la fois des CYP3A4 et de la PgP. Un inhibiteur puissant du CYP3A4 seul est considéré à risque majeur uniquement pour l’ apixaban et le rivaroxaban, plus largement éliminé par voie hépatique via les CYP.
D’ un point de vue pratique, lors d’ une interaction avec un inhibiteur ou inducteur fort à la fois de la PgP et des CYP3A4, un changement thérapeutique pour un AVK devrait être envisagé d’ autant plus en l’ absence d’ un monitoring sanguin applicable de routine pour les ACOD. En présence d’ une inhibition ou d’ une induction impliquant un inhibiteur/inducteur modéré, les recommandations d’ experts (28, 29) préconisent un changement thérapeutique en présence de deux ou plusieurs facteurs de risque supplémentaires tels qu’ une insuffisance rénale, un poids ou un âge extrême et/ou la présence d’ une autre interaction médicamenteuse.
Perspectives et conclusion
La littérature rapporte des concentrations moyennes populationnelles à cibler pour minimiser le risque de sur- ou sous dosage au travers du suivi thérapeutique des concentrations ; leur utilisation relève toutefois de la responsabilité du prescripteur et de la situation clinique (30). L’ utilisation des ACOD dans la population gériatrique reste sûre et efficace malgré l’ absence de monitoring sanguin validé. Cependant, tous les ACOD sont à risque d’ interaction médicamenteuse pouvant mener à un risque de sous ou surdosage sanguin et donc d’ évènements cliniques indésirables, spécialement dans le contexte de comorbidités telles que l’ insuffisance rénale, la polymédication, l’ âge et les poids extrême. Ceci est particulièrement vrai dans la population gériatrique où le cumul de ces facteurs de risques peut mener le prescripteur à envisager un traitement par AVK en présence d’ un inhibiteur/inducteur des CYP450 3A4 et de la Pgp.
Copyright Aerzteverlag medinfo AG
Centre de Recherche et d’ Innovation en Sciences Pharmaceutiques
Cliniques
Centre Hospitalier Universitaire et Université de Lausanne
Rue du Bugnon 17
1011 Lausanne
Claire.Coumau@chuv.ch
Centre de Recherche et d’ Innovation en Sciences Pharmaceutiques
Cliniques Centre Hospitalier Universitaire et Université de Lausanne
Suisse Rue du Bugnon 19
1011 Lausanne
Frederic.Gaspar@chuv.ch
Centre de Recherche et d’ Innovation en Sciences Pharmaceutiques
cliniques Centre Hospitalier Universitaire et Université de Lausanne
Suisse Rue du Bugnon 19
1011 Lausanne
Chantal.Csajka@chuv.ch
Division de médecine interne générale, Hôpitaux Universitaires de Genève/
Geneva Platelet Group, Faculté de Médecine, Université de Genève/
Service de pharmacologie et de toxicologie clinique, Service d’ anesthésiologie,
de pharmacologie et de soins intensifs, Hôpitaux Universitaires de Genève,
Suisse Centre Médical Universitaire
1211 Genève
Jean.Terrier@hcuge.ch
Les auteurs ont déclaré n’ avoir aucun conflit d’ intérêts en rapport avec cet article.
◆ Les ACOD figurent parmi le traitement de choix de nombreuses maladies cardiovasculaires et leur profil pharmacologique leur confèrent certains bénéfices en comparaison des AVK.
◆ Bien que commercialisé dans l’ esprit d’ une dose unique pour tous, la variabilité interindividuelle marquée des concentrations plasmatiques entraîne des risques hémorragiques et thrombo-emboliques en cas de sur ou sous-dosage chez certains patients.
◆ L’ insuffisance rénale principalement, les interactions médicamenteuses et la prise simultanée de médicaments modifiant l’ hémostase figurent parmi les facteurs les plus largement impliqués dans la survenue d’ effets indésirables de ces médicaments.
◆ Le cumul des facteurs de risque particulièrement présents dans la population gériatrique polymorbide et polymédiquée est susceptible de déplacer le rapport bénéfice / risque en faveur des AVK.
1. Ibáñez L, Sabaté M, Vidal X, Ballarin E, Rottenkolber M, Schmiedl S, et al. Incidence of direct oral anticoagulant use in patients with nonvalvular atrial fibrillation and characteristics of users in 6 European countries (2008-2015): A cross-national drug utilization study. British journal of clinical pharmacology. 2019;85(11):2524-39.
2. Rottenkolber M, Schmiedl S, Ibánez L, Sabaté M, Ballarín E, Vidal X, et al. Prescribers’ compliance with summary of product characteristics of dabigatran, rivaroxaban and apixaban-A European comparative drug utilization study. Basic Clin Pharmacol Toxicol. 2021;128(3):440-54.
3. Reilly PA, Lehr T, Haertter S, Connolly SJ, Yusuf S, Eikelboom JW, et al. The effect of dabigatran plasma concentrations and patient characteristics on the frequency of ischemic stroke and major bleeding in atrial fibrillation patients: the RE-LY Trial (Randomized Evaluation of Long-Term Anticoagulation Therapy). Journal of the American College of Cardiology. 2014;63(4):321-8.
4. Bansilal S, Bloomgarden Z, Halperin JL, Hellkamp AS, Lokhnygina Y, Patel MR, et al. Efficacy and safety of rivaroxaban in patients with diabetes and nonvalvular atrial fibrillation: the Rivaroxaban Once-daily, Oral, Direct Factor Xa Inhibition Compared with Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation (ROCKET AF Trial). Am Heart J. 2015;170(4):675-82.e8.
5. Giugliano RP, Ruff CT, Braunwald E, Murphy SA, Wiviott SD, Halperin JL, et al. Edoxaban versus warfarin in patients with atrial fibrillation. The New England journal of medicine. 2013;369(22):2093-104.
6. Owens RE, Kabra R, Oliphant CS. Direct oral anticoagulant use in nonvalvular atrial fibrillation with valvular heart disease: a systematic review. Clin Cardiol. 2017;40(6):407-12.
7. Eikelboom JW, Quinlan DJ, Hirsh J, Connolly SJ, Weitz JI. Laboratory Monitoring of Non- Vitamin K Antagonist Oral Anticoagulant Use in Patients With Atrial Fibrillation: A Review. JAMA Cardiol. 2017;2(5):566-74.
8. Linkins LA, Choi PT, Douketis JD. Clinical impact of bleeding in patients taking oral anticoagulant therapy for venous thromboembolism: a meta-analysis. Annals of internal medicine. 2003;139(11):893-900.
9. Khan F, Tritschler T, Kimpton M, Wells PS, Kearon C, Weitz JI, et al. Long-Term Risk for Major Bleeding During Extended Oral Anticoagulant Therapy for First Unprovoked Venous Thromboembolism : A Systematic Review and Meta-analysis. Annals of internal medicine. 2021;174(10):1420-9.
10. Sharma M, Cornelius VR, Patel JP, Davies JG, Molokhia M. Efficacy and Harms of Direct Oral Anticoagulants in the Elderly for Stroke Prevention in Atrial Fibrillation and Secondary Prevention of Venous Thromboembolism: Systematic Review and Meta-Analysis. Circulation. 2015;132(3):194-204.
11. Wadsworth D, Sullivan E, Jacky T, Sprague T, Feinman H, Kim J. A review of indications and comorbidities in which warfarin may be the preferred oral anticoagulant. J Clin Pharm Ther. 2021;46(3):560-70.
12. Cuddy S SR, Collis R, Matullah S. 33 Incidence of intracranial haemorrhage associated with antiplatelet and anticoagulant use; referrals to the national neurosurgery referral centre and reports to the health products regulatory authority. Heart (British Cardiac Society) 2015;101:A18-A9.
13. Lip GYH, Keshishian AV, Zhang Y, Kang A, Dhamane AD, Luo X, et al. Oral Anticoagulants for Nonvalvular Atrial Fibrillation in Patients With High Risk of Gastrointestinal Bleeding. JAMA Netw Open. 2021;4(8):e2120064.
14. Ruff CT, Giugliano RP, Braunwald E, Morrow DA, Murphy SA, Kuder JF, et al. Association between edoxaban dose, concentration, anti-Factor Xa activity, and outcomes: an analysis of data from the randomised, double-blind ENGAGE AF-TIMI 48 trial. Lancet (London, England). 2015;385(9984):2288-95.
15. Cirincione B, Kowalski K, Nielsen J, Roy A, Thanneer N, Byon W, et al. Population Pharmacokinetics of Apixaban in Subjects With Nonvalvular Atrial Fibrillation. CPT Pharmacometrics Syst Pharmacol. 2018;7(11):728-38.
16. Liesenfeld KH, Lehr T, Dansirikul C, Reilly PA, Connolly SJ, Ezekowitz MD, et al. Population pharmacokinetic analysis of the oral thrombin inhibitor dabigatran etexilate in patients with non- valvular atrial fibrillation from the RE-LY trial. Journal of thrombosis and haemostasis : JTH. 2011;9(11):2168-75.
17. Willmann S, Zhang L, Frede M, Kubitza D, Mueck W, Schmidt S, et al. Integrated Population Pharmacokinetic Analysis of Rivaroxaban Across Multiple Patient Populations. CPT Pharmacometrics Syst Pharmacol. 2018;7(5):309-20.
18. Heidbuchel H, Verhamme P, Alings M, Antz M, Diener H-C, Hacke W, et al. Updated European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. EP Europace. 2015;17(10):1467-507.
19. Foerster KI, Hermann S, Mikus G, Haefeli WE. Drug-Drug Interactions with Direct Oral Anticoagulants. Clinical pharmacokinetics. 2020;59(8):967-80.
20. Mavrakanas TA, Charytan DM, Winkelmayer WC. Direct oral anticoagulants in chronic kidney disease: an update. Curr Opin Nephrol Hypertens. 2020;29(5):489-96.
21. Kumar S, Lim E, Covic A, Verhamme P, Gale CP, Camm AJ, et al. Anticoagulation in Concomitant Chronic Kidney Disease and Atrial Fibrillation: JACC Review Topic of the Week. Journal of the American College of Cardiology. 2019;74(17):2204-15.
22. Eikelboom JW, Wallentin L, Connolly SJ, Ezekowitz M, Healey JS, Oldgren J, et al. Risk of bleeding with 2 doses of dabigatran compared with warfarin in older and younger patients with atrial fibrillation: an analysis of the randomized evaluation of long-term anticoagulant therapy (RE-LY) trial. Circulation. 2011;123(21):2363-72.
23. Terrier J, Gaspar F, Guidi M, Fontana P, Daali Y, Csajka C, et al. Population Pharmacokinetic Models for Direct Oral Anticoagulants: A Systematic Review and Clinical Appraisal Using Exposure Simulation. Clinical pharmacology and therapeutics. 2022;112(2):353-63.
24. Gong IY, Kim RB. Importance of pharmacokinetic profile and variability as determinants of dose and response to dabigatran, rivaroxaban, and apixaban. Can J Cardiol. 2013;29(7 Suppl):S24-33.
25. Stöllberger C, Finsterer J. Update on drug interactions with non-vitamin-K-antagonist oral anticoagulants for stroke prevention in elderly patients. Expert review of clinical pharmacology. 2021;14(5):569-81.
26. Lee JY, Oh IY, Lee JH, Kim SY, Kwon SS, Yang HJ, et al. The increased risk of bleeding due to drug-drug interactions in patients administered direct oral anticoagulants. Thromb Res. 2020;195:243-9.
27. FDA. Drug Development and Drug Interactions | Table of Substrates, Inhibitors and Inducers 2020 [12.01.2022]. Available from: https://www.fda.gov/drugs/drug-interactions-labeling/drug- development-and-drug-interactions-table-substrates-inhibitors-and-inducers.
28. Steffel J, Collins R, Antz M, Cornu P, Desteghe L, Haeusler KG, et al. 2021 European Heart Rhythm Association Practical Guide on the Use of Non-Vitamin K Antagonist Oral Anticoagulants in Patients with Atrial Fibrillation. Europace : European pacing, arrhythmias, and cardiac electrophysiology : journal of the working groups on cardiac pacing, arrhythmias, and cardiac cellular electrophysiology of the European Society of Cardiology. 2021;23(10):1612-76.
29. Terrier J, Gaspar F, Fontana P, Youssef D, Reny JL, Csajka C, et al. Drug-Drug Interactions with Direct Oral Anticoagulants: Practical Recommendations for Clinicians. Am J Med. 2021;134(8):939-42.
30. Moner-Banet T, Alberio L, Bart PA. Does One Dose Really Fit All? On the Monitoring of Direct Oral Anticoagulants: A Review of the Literature. Hamostaseologie. 2020;40(2):184-200.
la gazette médicale
- Vol. 11
- Ausgabe 5
- September 2022