- Assistance ventriculaire en cabinet de médecine générale
Le traitement des patients insuffisants cardiaques a vu une énorme évolution ces dernières années et il existe aujourd’ hui un nombre croissant de patient-e-s qui vivent en dehors de l’ hôpital et bénéficient d’ un système d’ assistance ventriculaire chronique ou Ventricular Assist Device (VAD), d’ un système de pompe supportant un cœur gauche insuffisant, en d’ autres termes.
La plupart des patients supportés par VAD ont une vie (presque) normale à domicile. Ils peuvent pratiquer des activités sportives (légères) (1), certains peuvent même reprendre le travail (2). Aussi bien pour le suivi de leur insuffisance cardiaque que pour des problèmes non cardiaques, ces patients sont et doivent absolument être suivis par leur médecin de premier recours (3).
L’ implantation d’ un VAD est indiquée dans l’ insuffisance cardiaque terminale réfractaire au traitement médicamenteux, pour permettre la survie des patients jusqu’ à la greffe (4) ou lorsqu’ une greffe ne peut pas être envisagée. Bien qu’ il s’ agisse d’ une thérapie coûteuse, elle permet une amélioration significative de la qualité de vie (5, 6). L’ implantation d’ un VAD peut être associée à d’ autres procédures chirurgicales, par exemple une intervention valvulaire ou une opération de pontage aorto-coronarien (7).
Aspects techniques du système de support ventriculaire (VAD)
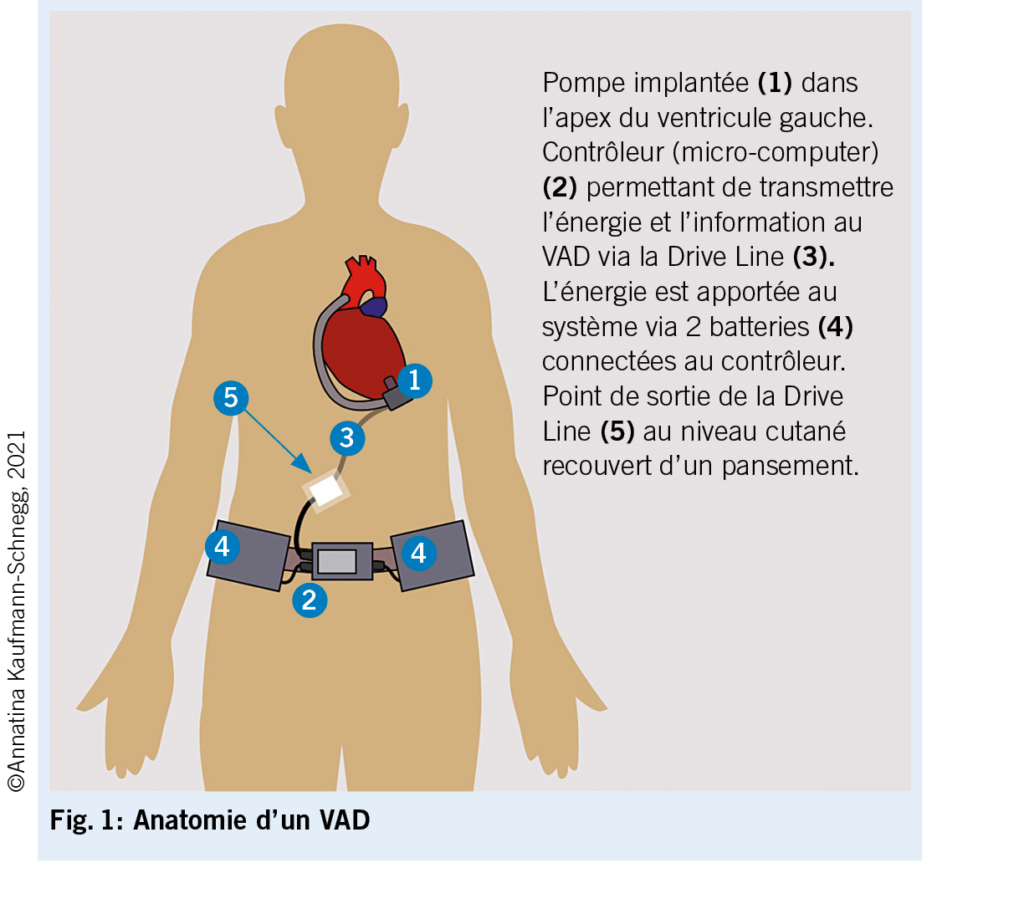
La pièce centrale du VAD est une pompe constituée d’ un rotor en métal aspirant le sang à travers une canule implantée dans le ventricule gauche et l’ éjectant par un conduit en Goretex dans l’ aorte ascendante, parallèlement à l’ action ventriculaire gauche restante (8). La pompe est alimentée en courant et contrôlée par un câble tunnelisé à la peau, lui-même connecté à un moniteur externe. Le courant est fourni par 2 batteries (fig. 1). Le patient dispose à domicile d’ une station de recharge de ses batteries et de divers câbles dont un câble de secours qui permet de remplacer l’ une des batteries par le courant délivré par l’ allume-cigare d’ une voiture.
La « programmation » de la pompe est effectuée au bloc opératoire puis adaptée au cours de l’ hospitalisation. Le réglage le plus important est celui de la vitesse de rotation de la pompe. D’ autres paramètres non essentiels pour le médecin traitant sont programmés. Les besoins du patient évoluant au cours du traitement, la vitesse de rotation peut être adaptée par le cardiologue spécialisée sur la base d’ examens fonctionnels, tels que l’ échocardiographie (9), l’ étude hémodynamique par cathéter droit ou la combinaison de ces deux méthodes (10).
Suivi cardiologique des patients assistés par VAD
Le suivi cardiologique des patients porteurs d’ un VAD se fait dans l’ institution qui a implanté ces dispositifs. Il a lieu à intervalle régulier, a minima tous les 3 mois. Le suivi médical non spécialisé peut se poursuivre de manière inchangée auprès du médecin généraliste (3). Les problèmes techniques (problèmes de batterie, de chargeur ou du dispositif porteur), doivent être résolus par le centre spécialisé, et ne sont pas sous la responsabilité du médecin généraliste. Les patients reçoivent une formation sur la manière de prendre en charge leur appareil au quotidien (11).
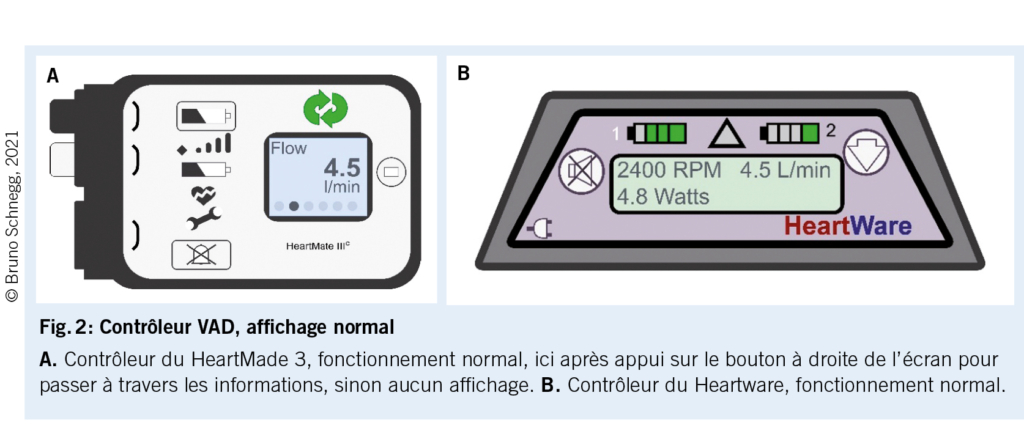
La consultation en cabinet de médecine générale se déroule de manière normale. Le médecin traitant doit cependant savoir qu’ en raison du flux continuel généré par la pompe, il n’ y a pas de pouls mesurable (pas de systole/diastole) mais une pression de débit relativement constante. La tension artérielle est difficile à mesurer et la saturation en oxygène souvent impossible à capter. Lors de l’ auscultation cardiaque et pulmonaire le bruit de ronflement de la machine prédomine. L’ examen abdominal peut être effectué de manière habituelle, toutefois en prenant garde à l’ orifice de la Drive Line (DL).
Situations typiques au cabinet de médecine générale
Les patients porteurs de VAD sont dépendants de leur système d’ assistance et ont indiscutablement un risque non négligeable de complications résultant de ce traitement : un problème technique du système peut rapidement déboucher sur une situation d’ urgence. En plus, ces patients ont un risque infectieux élevé parce que le système est un corps étranger complexe avec une porte d’ entrée potentielle permanente au niveau de la sortie du câble de contrôle, et enfin ils doivent être continuellement anticoagulés, ce qui implique le risque de saignements et de thromboses.
Les urgences
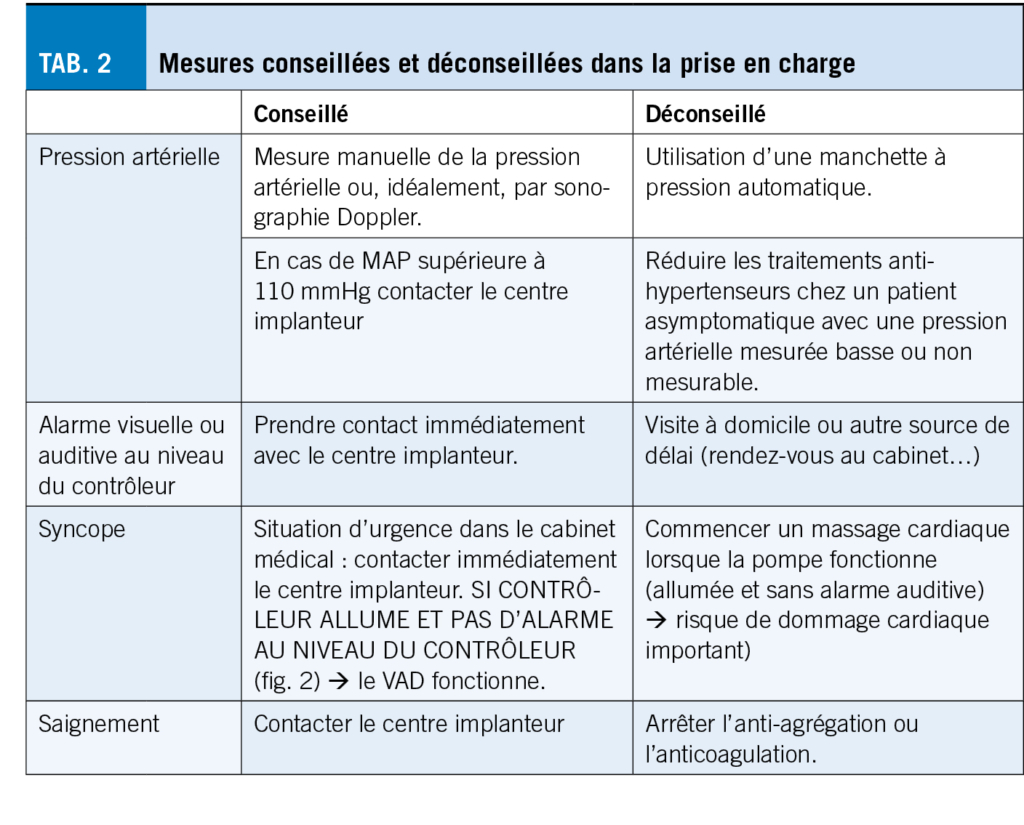
Les situations les plus menaçantes résultent généralement d’ une dysfonction du système, d’ un accident vasculaire cérébral ou d’ une complication hémorragique. Pour le médecin généraliste quatre thèmes spécifiques aux porteurs de VAD devraient être connus (tab. 1) :
Le contrôle des conditions de fonctionnement optimales de la pompe (VAD) :
Les patients porteurs d’ un VAD doivent être anticoagulés de manière stricte et bien contrôlée avec des anti-vitamines K, parce que le contact du sang avec les parties constituantes du système (métal, titane) entraîne une activation du système de coagulation (12). Le monitoring régulier de l’ anticoagulation et la communication sans délai avec le centre implanteur si la valeur d’ INR sort des intervalles prédéfinis (habituellement entre 2.0-3.0) est probablement le point le plus crucial de la prise en charge de ces patients par la ou le généraliste au cabinet de médecine générale.
La tension artérielle joue un rôle prépondérant dans la performance de la pompe. Plus exactement, la différentielle de pression entre le ventricule gauche (peu modifiable) et la pression régnant dans l’ aorte (la pression artérielle). Plus la différentielle est importante (plus le patient est « hypertendu ») moins la pompe pourra produire de débit (13). Idéalement, la pression moyenne (MAP) est maintenue autour de 80-90 mmHg (14). Cette pression doit être mesurée au moyen d’ une manchette manuelle et d’ une sonographie Doppler (3). L’ absence de pulsatilité rend la mesure avec un appareil de mesure automatique souvent impossible. Une MAP inhabituelle et/ou supérieure à 110 mmHg doit être communiquée au centre implanteur.
Les complications associées à la thérapie
La complication la plus fréquente est l’ infection avec une situation septique éventuelle (15). Elle touche entre 10 et 50 % des patients (16, 17). Une infection prend généralement son origine au point de sortie cutané de la DL. Localement, le patient se plaindra de douleur, éventuellement aiguë (souvent le signe d’ un abcès), mais l’ infection peut aussi se manifester par une démangeaison locale associée à une augmentation de l’ écoulement au niveau du pansement. Un examen local est nécessaire sans toutefois retirer le pansement, à la recherche de signes locaux d’ infection et pour obtenir tôt des cultures bactériologiques. Le laboratoire inflammatoire habituel (CRP, répartitions) est indiqué. Une antibiothérapie empirique ou guidée par un antibiogramme n’ est à débuter qu’ après discussion avec le centre implanteur.
Des complications redoutées sont celles liées à l’ anticoagulation et l’ anti-agrégation, avec la survenue aussi bien de thromboses que de saignements. Hormis les symptômes neurologiques classiques (AVC et AIT), un signe « subtil » de thrombose est la présence d’ une macro-hémoglobinurie (urine « coca-cola »). Celle-ci peut être le signe d’ une déstabilisation de l’ hélice au niveau de la pompe, provoquant une hémolyse massive et peut être associée à une auscultation typique avec ton rugueux. De nouvelles céphalées doivent également être agressivement explorées, dans la mesure où les saignements, particulièrement les hématomes sous-duraux, peuvent se manifester de manière atypique. L’ anticoagulation ne doit toutefois jamais être arrêtée sans prise de contact avec le centre spécialisé.
L’ insuffisance cardiaque droite, reflétée en général par une surcharge volémique et parfois par une insuffisance rénale ou hépatique est fréquente. Si les œdèmes des membres inférieurs sont quasiment ubiquitaires et souvent multifactoriels (insuffisance veineuse, effet secondaire des anticalciques), un signe inquiétant est la diminution des besoins en antivitamine K pour maintenir le même INR, la perte d’ appétit et/ou la tension sous-diaphragmatique droite (bendopnée). Le poids est à surveiller très régulièrement. Si possible, le patient doit être impliqué dans la gestion de son poids.
L’ état général du patient
Que les patients munis d’ un VAD soient en attente ou pas d’ une transplantation, leur qualité de vie, leur capacité à être transplantés et leur survie après la transplantation sont liées à leur condition physique globale (19). Une optimisation de l’ hygiène de vie et du poids est donc cruciale. Ici aussi, la collaboration avec le médecin traitant pour assurer une coordination efficace entre les soins hospitaliers et ambulatoires (diététicien, physiothérapeute, ergothérapeute, psychiatre) est importante.
Les comorbidités du patient
Pour que les patients porteurs d’ un VAD puissent profiter du traitement, il est important de continuer à traiter d’ éventuelles comorbidités. Une attention particulière doit être portée aux troubles dépressifs (20), la bronchopathie obstructive chronique et le diabète (21).
Ces comorbidités peuvent être abordées de manière classique au cabinet du ou de la généraliste, avec toutefois quelques limitations dues à l’ anticoagulation ou la présence d’ un système mécanique (pas d’ interruption de l’ anticoagulation sauf hémorragie fatale, donc par exemple impossibilité de pratiquer une biopsie lors de colonoscopies, remplacement agressif des « déficits » en fer, etc…). En cas de doute il faut toujours coordonner avec le centre implanteur.
En raison de l’ interaction entre le système immunitaire et les surfaces métalliques de la pompe (22), mais aussi à cause de l’ insuffisance cardiaque elle-même (23), les défenses immunitaires de ces patients sont amoindries. Il est donc important que les vaccinations soient mises à jour au cabinet médical (pneumocoques, hépatite A et B,…) et que le rappel du vaccin contre la grippe soit effectué annuellement, sachant qu’ en cas d’ immunosuppression (Listing pour une transplantation) certains vaccins ne peuvent pas être administrés.
Copyright Aerzteverlag medinfo AG
Clinique Universitaire de Cardiologie
Inselspital, Freiburgstrasse 18,
3010 Berne
Bruno.schnegg@insel.ch
Cabinet médical du Chauderon
Chemin du Chauderon 1
1071 Chexbres
Clinique Universitaire de Cardiologie
Inselspital
Freiburgstrasse 18
3010 Berne
Les auteurs ont déclaré n’ avoir aucun conflit
d’ intérêts en relation avec cet article.
◆ Les patients supportés par VAD sont aujourd’ hui une réalité en médecine ambulatoire.
◆ Ils peuvent aspirer à une bonne qualité de vie, mais ils ont besoin d’ un soutien systématique de l’ ensemble de leur réseau de soins après la sortie de l’ hôpital.
◆ Ces patients peuvent et doivent être suivis par leur médecins de premier recours. Mais il faut que ces derniers connaissent les aspects particuliers de ce type de traitement, car ces patients sont dépendants d’ un appareillage compliqué et peuvent être difficiles à examiner.
◆ De plus, les généralistes connaissent normalement bien leur patient et son entourage ainsi que son histoire, ce qui facilite entre autres la détection précoce de complications.
◆ Enfin, la médecine préventive (vaccination, optimisation de l’ état général du patient) est très importante (3).
◆ Le ou la patiente porteur/euse d’ un VAD illustre donc par excellence l’ importance de réseaux de soins bien organisés impliquant une bonne communication entre médecins hospitaliers et médecins généralistes dans le traitement des patients présentant des comorbidités complexes.
1. Fresiello L, Jacobs S, Timmermans P, et al.: Limiting factors of peak and submaximal exercise capacity in LVAD patients PLoS One 15: e0235684, 2020
2. Overgaard D, Grufstedt Kjeldgaard H, Egerod I: Life in Transition: A Qualitative Study of the Illness Experience and Vocational Adjustment of Patients With Left Ventricular Assist Device Journal of Cardiovascular Nursing 27: 394–402, 2012
3. Estep JD, Trachtenberg BH, Loza LP, Bruckner BA: Continuous flow left ventricular assist devices: shared care goals of monitoring and treating patients Methodist Debakey Cardiovasc J 11: 33–44, 2015
4. Rose EA, Gelijns AC, Moskowitz AJ, et al.: Long-term use of a left ventricular assist device for end-stage heart failure N Engl J Med 345: 1435–1443, 2001
5. MacIver Jane, Ross Heather J.: Quality of Life and Left Ventricular Assist Device Support Circulation 126: 866–874, 2012
6. Stehlik Josef, Estep Jerry D., Selzman Craig H., et al.: Patient-Reported Health-Related Quality of Life Is a Predictor of Outcomes in Ambulatory Heart Failure Patients Treated With Left Ventricular Assist Device Compared With Medical Management Circulation: Heart Failure 10: e003910, 2017
7. Mehta P, Imamura T, Juricek C, et al.: Combined Left Ventricular Assist Device and Coronary Artery Bypass Grafting Surgery: Should We Bypass the Bypass? ASAIO J 66: 32–37, 2020
8. Miera O, Potapov EV, Redlin M, et al.: First Experiences With the HeartWare Ventricular Assist System in Children The Annals of Thoracic Surgery 91: 1256–1260, 2011
9. Couperus LE, Delgado V, Khidir MJH, et al.: Pump Speed Optimization in Stable Patients with a Left Ventricular Assist Device ASAIO J 63: 266–272, 2017
10. Uriel N, Sayer G, Addetia K, et al.: Hemodynamic Ramp Tests in Patients With Left Ventricular Assist Devices JACC Heart Fail 4: 208–217, 2016
11. Cook JL, Colvin M, Francis GS, et al.: Recommendations for the Use of Mechanical Circulatory Support: Ambulatory and Community Patient Care: A Scientific Statement From the American Heart Association Circulation 135, 2017
12. Hulander M, Hong J, Andersson M, et al.: Blood interactions with noble metals: coagulation and immune complement activation ACS Appl Mater Interfaces 1: 1053–1062, 2009
13. Salamonsen RF, Mason DG, Ayre PJ: Response of rotary blood pumps to changes in preload and afterload at a fixed speed setting are unphysiological when compared with the natural heart Artif Organs 35: E47-53, 2011
14. Bennett MK, Adatya S: Blood pressure management in mechanical circulatory support J Thorac Dis 7: 2125–2128, 2015
15. Ahmed AR, Nikolaus P, Achim K, et al.: Survival analysis and postoperative complications after ventricular assist device implantation; prognostic value of INTERMACS scale Annals of Cardiovascular and Thoracic Surgery 1, 2018
16. Zinoviev R, Lippincott CK, Keller SC, Gilotra NA: In Full Flow: Left Ventricular Assist Device Infections in the Modern Era Open Forum Infectious Diseases 7, 2020
17. Topkara VK, Kondareddy S, Malik F, et al.: Infectious complications in patients with left ventricular assist device: etiology and outcomes in the continuous-flow era Ann Thorac Surg 90: 1270–1277, 2010
18. Kamboj M, Kazory A: Left Ventricular Assist Device and the Kidney: Getting to the Heart of the Matter BPU 48: 289–298, 2019
19. Healy AH, Stehlik J, Edwards LB, McKellar SH, Drakos SG, Selzman CH: Predictors of 30-day post-transplant mortality in patients bridged to transplantation with continuous-flow left ventricular assist devices—An analysis of the International Society for Heart and Lung Transplantation Transplant Registry The Journal of Heart and Lung Transplantation 35: 34–39, 2016
20. Cascino Thomas M., Kittleson Michelle M., Lala Anuradha, et al.: Comorbid Conditions and Health-Related Quality of Life in Ambulatory Heart Failure Patients Circulation: Heart Failure 13: e006858, 2020
21. Tao J, Bannister W, Wu C, Irwin FD: Impact of Patient Comorbidities on Post-Implant Outcomes Among Patients Receiving Ventricular Assist Devices in a Commercially Insured Population Journal of Cardiac Failure 21: S32, 2015
22. Itescu S, John R: Interactions between the recipient immune system and the left ventricular assist device surface: immunological and clinical implications The Annals of Thoracic Surgery 75: S58–S65, 2003
23. The activated immune system in congestive heart failure – from dropsy to the cytokine paradigm: Journal of Internal Medicine 243: 87–92, 1998
la gazette médicale
- Vol. 10
- Ausgabe 5
- September 2021