- Avancées dans le traitement de l’ hyperuricémie et de la goutte
La goutte est un rhumatisme inflammatoire microcristallin souvent associé à des maladies chroniques telles que l’insuffisance rénale chronique (IRC), l’hypertension, les maladies coronariennes et le syndrome métabolique. Par conséquent, la prise en charge de la goutte (traitement des crises et prise en charge de l’hyperuricémie) doit tenir compte des co-morbidités du patient. Des données récentes ont démontré l’efficacité de traitements émergents et confirmé celles de traitements plus anciens dans la prise en charge de la goutte. Nous discuterons dans cet article des thérapies que nous considérons comme ayant le plus grand impact sur notre pratique clinique.
Gout is an inflammatory arthritis that is often associated with chronic diseases such as chronic kidney disease (CKD), hypertension, coronary heart disease and metabolic syndrome. Consequently, the management of gout (treatment of the acute rash, reduction in serum urea [SUT]) must take account of these co-morbid conditions. Recent advances in the treatment of gout have demonstrated the efficacy of new and existing therapies in the management of gout and in this article we will summarise those that we consider to have the greatest impact on our clinical practice.
Keywords: hyperuricemia, gout, inflammatory arthritis, co-morbidity, pharmacotherapy
Introduction
L’impact de la goutte à l’échelle mondiale est important faisant de cette maladie la forme la plus courante d’arthrite inflammatoire dans le monde (1). Les principes d’une prise en charge efficace sont bien connus et ont été publiés récemment sous forme de lignes directrices actualisées (2, 3); ils reposent sur le contrôle rapide de la poussée inflammatoire, l’abaissement de l’urate sérique jusqu’au taux cible, associé à une éducation thérapeutique du patient. De nouveaux traitements pharmacologiques aideront le clinicien à atteindre ces objectifs, car l’intolérance aux thérapies existantes et les effets secondaires potentiels chez les patients présentant des comorbidités sont fréquents. Outre la thérapie pharmacologique, l’importance de la participation et de l’éducation des patients est reconnue et des stratégies visant à impliquer le patient dans sa prise en charge ont également été étudiées. Cette revue mettra en lumière les avancées thérapeutiques récentes dans le domaine de la goutte, en insistant sur les traitements récemment développés ainsi que sur les nouvelles perspectives d’utilisation des thérapies existantes.
Avancées dans le traitement de la goutte aiguë
Colchicine et prévention cardiovasculaire dans la goutte
De plus en plus de données démontrent que l’inflammation est un acteur crucial dans le développement de l’athérosclérose. Plusieurs études ont examiné l’effet protecteur potentiel de divers médicaments anti-inflammatoires sur les événements cardiovasculaires (CV), y compris la colchicine (4).
Une étude rétrospective de cohorte monocentrique appariée a inclus 501 patients atteints de goutte qui ont commencé un traitement de colchicine qui ont été appariés (sur la base de l’âge et du sexe) à 501 patients non traités à la colchicine (5). Les patients atteints de goutte inclus dans les deux groupes étaient principalement des hommes blancs (64 %) avec un âge moyen de 72-73 ans. Les patients ont été suivis jusqu’à 4 ans (durée moyenne du suivi : 1 an) et les événements CV ont été enregistrés. Dans l’analyse ajustée, les auteurs ont observé une réduction de 49 % (HR 0,51, 95 % CI 0,30 à 0,88) du risque de présenter un événement CV (accident vasculaire cérébral, accident ischémique transitoire, infarctus du myocarde [IM]) chez les utilisateurs de colchicine. Une diminution de la mortalité toutes causes confondues a également été observée dans ce même groupe (HR 0,27, 95 % CI 0,17 à 0,43).
Un vaste essai randomisé contrôlé par placebo (étude COLCOT) a inclus 4 745 patients dans les 30 jours suivant un infarctus. Ces derniers ont été traités par la colchicine 0,5 mg une fois par jour ou par placebo. La durée médiane du suivi était de 23 mois. Une réduction significative (5,5 % contre 7,1 %, HR 0,77, 95 % CI 0,61 à 0,96) du risque d’événements CV ischémiques a été observée dans le groupe colchicine par rapport au groupe placebo. Les effets indésirables ont été globalement similaires dans les deux groupes. Des diarrhées ont été signalées chez 9,7 % des patients traités par la colchicine (groupe placebo : 8,9 %) (6). Récemment, une étude post hoc de l’essai COLCOT incluant uniquement des patients atteints de diabète de type 2 a rapporté une réduction similaire (HR 0,65, 95 % CI 0,44 à 0,96) du risque d’événements CV ischémiques (7).
Un autre essai randomisé contrôlé par placebo (essai LoDoCo2) a étudié l’effet de la colchicine sur le risque d’événements CV chez des patients atteints de maladie coronarienne chronique. 5522 patients ont été traités par colchicine 0,5 mg une fois par jour ou par placebo après une phase d’introduction d’un mois de traitement par colchicine (en ouvert) pour tous. La durée moyenne du suivi était de 29 mois. Une réduction du risque de survenue du critère composite d’événements CV a été observée (6,8 % contre 9,6 %, HR 0,69, 95 % CI 0,57 à 0,83). La goutte est survenue moins fréquemment dans le groupe colchicine (1,4 % contre 3,4 %), mais des myalgies ont été signalées plus souvent par les patients traités par la colchicine (21,2 % contre 18,5 %) (8).
Il existe aujourd’hui des preuves solides démontrant que la colchicine peut réduire le risque d’événements cardiovasculaires en association avec les médicaments de prévention CV utilisés en routine dans diverses populations présentant un risque CV accru, telles que les patients souffrant de goutte, de diabète de type 2, d’antécédents d’infarctus du myocarde ou de maladie coronarienne chronique.
Ainsi, la colchicine, qui est utilisée depuis de nombreuses années pour traiter l’arthrite goutteuse aiguë et prévenir les poussées de goutte induites par les traitements hypo-uricémiants, pourrait avoir sa place dans l’arsenal thérapeutique de prévention CV à l’avenir.
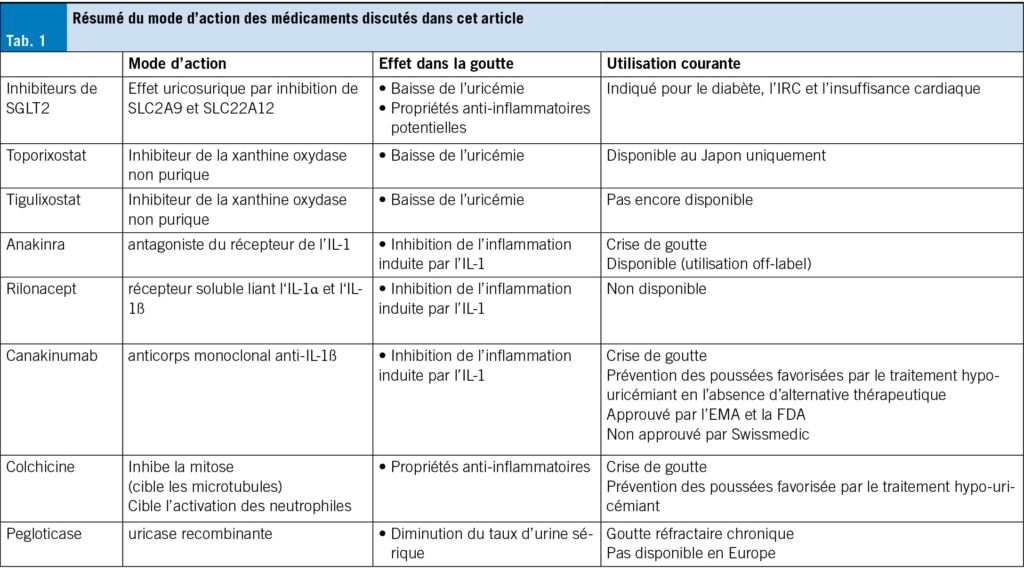
Inhibition des cytokines
Depuis que nous avons découvert la capacité des cristaux d’acide urique à activer l’inflammasome NLRP3 responsable du déclenchement d’une cascade intracellulaire complexe conduisant finalement au clivage et à l’activation de pro-IL-1β en IL-1β, cette cytokine pro-inflammatoire est devenue une cible thérapeutique pour traiter la goutte aiguë (9).
L’anakinra, un antagoniste du récepteur de l’IL-1, a été le premier agent bloquant de l’IL-1 disponible.
Après une étude ouverte et plusieurs études rétrospectives qui ont rapporté une bonne efficacité de ce médicament dans le traitement de la crise de goutte, y compris chez les patients hospitalisés présentant des comorbidités, deux essais contrôlés randomisés ont été publiés en 2019 et 2021 avec des comparateurs différents. Dans la première étude, 88 patients souffrant d’une poussée aiguë d’arthrite goutteuse ont été traités par anakinra 100 mg une fois par jour pendant 5 jours ou par traitement conventionnel (naproxène, colchicine, prednisone). Les auteurs ont montré la non-infériorité de l’anakinra par rapport au traitement conventionnel avec une amélioration clinique similaire (10). Dans la seconde étude (étude anaGO), 165 patients souffrant d’une mono- ou oligo-arthrite aiguë liée à la goutte, chez qui les AINS ou la colchicine étaient contre-indiqués, ont été traités par 100 mg ou 200 mg d’anakinra une fois par jour pendant 5 jours ou par une injection intramusculaire unique de 40 mg de triamcinolone. Tous les groupes de traitement ont montré une réduction similaire de l’intensité de la douleur (11).
Le rilonacept, une protéine de fusion agissant comme un récepteur soluble liant l’IL-1α et l’IL-1β, a montré son efficacité dans le traitement de la crise de goutte dans un essai contrôlé randomisé de phase 3 portant sur 225 patients (12). Trois essais randomisés ont étudié l’utilisation du rilonacept pour prévenir les poussées de goutte pendant l’instauration d’un traitement hypo-uricémiant et ont observé une diminution du nombre de poussées chez les patients du groupe rilonacept par rapport au groupe placebo (13-15). Cependant, le rilonacept n’est plus disponible pour des raisons commerciales.
Le canakinumab, un anticorps monoclonal anti-IL-1β dont la demi-vie terminale est de 26 jours, a montré son efficacité dans le traitement de la crise de goutte dans deux essais randomisés de phase 3. Ces derniers ont inclus 456 patients traités par une dose unique de 150 mg de canakinumab ou par une injection intramusculaire unique de 40 mg de triamcinolone. Une différence significative de l’intensité moyenne de la douleur (95 % CI) sur l’échelle visuelle analogique (EVA, 0-100 mm) à 72 heures a été observée (-9,8, -16,3 à -3,2 mm) (16). Un essai contrôlé randomisé de phase 2 a étudié l’efficacité du canakinumab dans la prévention des crises de goutte lors de l’instauration d’un hypo-uricémiant et a rapporté une diminution du nombre moyen de poussées dans le groupe canakinumab par rapport au groupe colchicine (17). En outre, une analyse post hoc de l’essai CANTOS, un vaste essai randomisé (1 059 patients) portant sur les conséquences cardiovasculaires chez les patients traités par le canakinumab pendant plusieurs années, a montré une réduction du risque de crises de goutte (HR 0,4-0,48 en fonction des différents taux d’urate sériques) sans effet sur les taux d’urate sérique (18). Le canakinumab a été approuvé par l’Agence européenne des médicaments (EMA) en 2013 et par la Food and Drug Administration américaine (FDA) en 2023 pour traiter les patients adultes atteints de crises de goutte fréquentes chez qui il existe une contre-indication à l’utilisation de la colchicine, les AINS ou les stéroïdes.
Outre l’IL-1β, d’autres cytokines pro-inflammatoires sont libérées au cours de la crise de goutte, notamment le TNFα et l’IL-6. Certains auteurs ont essayé de bloquer le TNFα ou l’IL-6 pour traiter l’arthrite goutteuse tophacée réfractaire polyarticulaire. Quelques rapports de cas ont fait état d’une bonne efficacité des inhibiteurs du TNFα (infliximab, etanercept) et de l’anticorps anti-IL6R tocilizumab (sous-cutané et intraveineux) chez ces patients (19, 20). Cependant, le niveau de preuve est faible et il n’existe pas d’essais contrôlés publiés, d’études d’observation ou même de séries de cas pour étayer leur utilisation dans la goutte.
Avancées dans la gestion de l’hyperuricémie
Pégloticase
La pégloticase est une uricase recombinante administrée par voie intraveineuse qui dégrade l’urate en allantoïne, un métabolite soluble.
Deux essais randomisés contrôlés publiés en 2011 ont inclus 225 patients souffrant de goutte sévère réfractaire à l’allopurinol ou présentant une intolérance au traitement. Ces derniers ont été traités par pegloticase ou par placebo pendant 6 mois. Dans le groupe pegloticase, 38 % des patients ont répondu (taux d’urate sérique < 360 µmol/l pendant ≥ 80 % du temps entre les mois 3 et 6) contre 0 % dans le groupe placebo (21). Cependant, l’utilisation de la pegloticase a été entravée par un taux significatif de réactions liées à la perfusion (> 25 %) et une perte d’efficacité liée au développement d’anticorps anti-médicaments responsables de la neutralisation du traitement(22).
Par conséquent, après une étude ouverte encourageante, un essai contrôlé randomisé (étude MIRROR) a été mené auprès de 152 patients souffrant de goutte non contrôlée et d’échec ou d’intolérance aux hypo-uricémiants conventionnels. Les patients ont été traités par pegloticase et méthotrexate oral (MTX) 15 mg/semaine ou par pegloticase et placebo pendant un an (23). Ceux traités par MTX et pegloticase ont présenté un taux de réponse plus élevé (60 % contre 31 %) à un an, et moins de réactions liées aux perfusions (4 % contre 31 %, tous sont survenus au cours des 6 premiers mois). Parmi les patients présentant des tophi au départ, la proportion de ceux ayant une résolution de ≥ 1 tophi était de 54 % (contre 31 %) après un an de traitement (24).
La FDA a approuvé la pegloticase dans le traitement de la goutte chronique chez les patients réfractaires au traitement conventionnel depuis 2010. L’EMA a également approuvé la pegloticase mais l’a retirée à la demande du fabricant en 2013.
Nouveaux inhibiteurs de la xanthine oxydase (XOI)
L’allopurinol et le fébuxostat sont des inhibiteurs de la xanthine oxydase bien établis et efficaces pour abaisser le taux d’urate. Cependant, des problèmes de tolérance dans des situations spécifiques (syndrome d’hypersensibilité à l’allopurinol pour l’allopurinol et tolérance cardiovasculaire pour le fébuxostat) ainsi que l’intolérance au médicament limitent parfois leur utilisation. Des alternatives à ces traitements sont donc bienvenues. Le topiroxostat et le tigulixostat ont été développés récemment. Tous deux sont des inhibiteurs non puriques de la xanthine oxydase.
Le topiroxostat est disponible depuis 2013 au Japon (25, 26), mais n’est pas encore commercialisé dans l’Union européenne ou aux États-Unis. Le tigulixostat a montré une efficacité dose-dépendante dans la réduction de l’urate dans des études de phase 2, mais n’a pas encore été comparé aux XOI déjà utilisés (27).
Inhibiteurs du SGLT2
Les inhibiteurs du SGLT2 (canagliflozine, dapagliflozine, empaglifozine et autres) sont des médicaments qui favorisent l’excrétion rénale du glucose, réduisant ainsi la glycémie. Leur utilisation a révolutionné la prise en charge du diabète, de l’insuffisance cardiaque et de l’insuffisance rénale chronique (IRC). Le principal mode d’action est l’inhibition de la réabsorption du glucose par le SGLT2 (sodium-glucose cotransporter 2) dans le tubule rénal proximal. D’autres mécanismes d’action (inhibition du transport du sodium, inhibition du stress oxydatif et de l’inflammation et pression glomérulaire) peuvent expliquer leurs effets bénéfiques dans l’insuffisance cardiaque et l’IRC. Les maladies métaboliques, rénales et cardiaques étant des comorbidités fréquemment retrouvéees dans la population goutteuse, les médicaments qui agissent sur plusieurs cibles cliniques dans la même maladie sont d’un intérêt considérable. Une revue récente a résumé succinctement les données disponibles sur les effets des inhibiteurs du SGLT2 en relation avec la goutte (28).
Les inhibiteurs du SGLT2 sont capables d’abaisser le taux d’urate sérique; dans une méta-analyse de 62 essais d’inhibiteurs du SGLT2, l’abaissement moyen de l’urate sérique observé était de -37 umol/L (des variations dans l’importance de la diminution de l’urate sérique ont été observées entre les classes de médicaments) et cet effet semble être indépendant des niveaux de sucre dans le sang (29). La diminution de l’uricémie semble également être indépendante de la sévérité de l’insuffisance rénale pour la dapagliflozine et l’empagliflozine (examiné dans (28)) et de la prise concomitante de différents médicaments réduisant l’urate (30). Il n’existe pas d’études spécifiques ciblant la population goutteuse, mais des patients goutteux ont été inclus dans un certain nombre d’essais sur les inhibiteurs du SGLT2 et des analyses secondaires des données ont montré que l’incidence des poussées de goutte était réduite d’environ 50 % chez les patients sous inhibiteurs du SGLT2 (28), et des études de cohorte portant sur des bases de données de soins de santé ont également montré que l’incidence de la goutte était également réduite dans une proportion similaire. Le mécanisme de réduction de l’urate des inhibiteurs du SGLT2 serait secondaire à une augmentation de l’excrétion urinaire de glucose, qui entre en compétition avec l’urate pour sa réabsorption par le transporteur rénal SLC2A9 (Glut 9); un autre mécanisme pourrait être un effet inhibiteur sur le transporteur d’urate SLC22A12 (URAT1) (31).
Les données accumulées suggèrent que les inhibiteurs du SGLT2 peuvent être un complément utile aux hypo-uricémiants conventionnels dans la goutte, en particulier chez les patients présentant des comorbidités cardio-métaboliques. Il n’y a pas de données actuelles pour soutenir leur utilisation en tant qu’hypouricémiant primaire.
Prophylaxie par la colchicine à l’instauration d’un hypouricémiant
Lorsque les patients débutent un traitement hypo-uricémiant, la fréquence des poussées de goutte augmente et atteint un pic au cours des 6 premiers mois avant de diminuer progressivement en fréquence (32). Ces «poussées paradoxales» ont incité les cliniciens à recommander une prophylaxie des poussées pendant une période allant jusqu’à 6 mois au début du traitement hypo-uricémiant dans les recommandations thérapeutiques. Une étude récente a étudié si une titration progressive lente de l’hypo-uricémiant (en utilisant l’allopurinol) peut éviter la nécessité d’une prophylaxie par la colchicine. Stamp et ses collègues ont réalisé un essai contrôlé randomisé comparant la colchicine à faible dose (0,5 mg par jour) à un placebo pendant les six premiers mois de traitement par l’allopurinol. La dose d’allopurinol a été augmentée de 50 mg par mois jusqu’à ce que le niveau cible d’urates de <360 umol/L soit atteint (33). Ils ont constaté que les patients sous placebo présentaient davantage de poussées au cours des 6 premiers mois que ceux du groupe traité, mais qu’au bout de 12 mois, les deux groupes présentaient une fréquence de poussées similaire (réduite). Sur la base de ces résultats, la recommandation d’une prophylaxie par la colchicine est maintenue lors de l’instauration de l’hypo-uricémiant.
Information et éducation thérapeutique des patients
Doherty et al ont montré dans un essai contrôlé randomisé que les résultats de la prise en charge de la goutte (atteinte des taux cibles d’acide urique, réduction du nombre de poussées) sont significativement meilleurs lorsque le traitement médicamenteux est accompagné d’un programme d’éducation thérapeutique et d’un suivi clinique réalisé par une infirmière, par rapport aux soins habituels (34, 35). Des analyses ultérieures ont également montré que le groupe ayant bénéficié de soins infirmiers était plus satisfait, mieux informé sur la goutte et présentait un taux de poussée plus faible que le groupe témoin. Toutefois, ces résultats dépendent de l’organisation du système de santé, car l’essai décrit a été réalisé au Royaume-Uni. Il est probable que d’autres approches puissent influencer les résultats du traitement. Aux États-Unis, un essai comparant l’intervention d’un pharmacien (information sur la maladie, suivi téléphonique et ajustement de la dose d’allopurinol) a montré que l’observance (> 80 % des jours de traitement) et l’atteinte de l’objectif de 6 mg/dL d’uricémie étaient significativement plus élevés dans le groupe en contact avec le pharmacien que dans le groupe recevant les soins habituels (36). Enfin, un essai réalisé en Écosse, dans lequel les patients ont été randomisés pour bénéficier d’un programme visant à améliorer l’autogestion de la goutte (sous la forme d’un lecteur des taux sériques d’acide urique pour le monitoring de l’uricémie à domicile, associé à une application sur smartphone pour améliorer les connaissances concernant les objectifs de traitement) vs prise en charge classique, a démontré une fréquence plus élevée d’atteinte des taux cible d’acide urique à 6 mois dans le groupe intervention par rapport au groupe contrôle (70 % contre 15 %) à 6 mois (37). Ces études montrent que différentes stratégies peuvent être efficaces pour améliorer l’adhérence thérapeutique et les taux sériques d’acide urique, et que l’approche choisie doit tenir compte des facteurs locaux.
Copyright Aerzteverlag medinfo AG
Service de Rhumatologie,
Département de l’Appareil Locomoteur
Centre hospitalier universitaire vaudois
Av. Pierre Decker
1005 Lausanne
Service de Rhumatologie,
Département de l’Appareil Locomoteur
Centre hospitalier universitaire vaudois
Av. Pierre Decker
1005 Lausanne
Les auteurs n’ ont pas déclaré de conflit d’ intérêts en rapport avec cet article.
1. Dehlin M, Jacobsson L, Roddy E. Global epidemiology of gout: prevalence, incidence, treatment patterns and risk factors. Nat Rev Rheumatol. 2020 Jul;16(7):380-90.
2. Richette P, Doherty M, Pascual E, Barskova V, Becce F, Castaneda J, et al. 2018 updated European League Against Rheumatism evidence-based recommendations for the diagnosis of gout. Ann Rheum Dis. 2020 Jan;79(1):31-8.
3. FitzGerald JD, Dalbeth N, Mikuls T, Brignardello-Petersen R, Guyatt G, Abeles AM, et al. 2020 American College of Rheumatology Guideline for the Management of Gout. Arthrite et rhumatologie. 2020 Jun 1;72(6):879-95.
4. Hansson GK. Inflammation, athérosclérose et maladie artérielle coronaire. N Engl J Med. 2005 avr 21;352(16):1685-95.
5. Solomon DH, Liu CC, Kuo IH, Zak A, Kim SC. Effets de la colchicine sur le risque d’ événements cardiovasculaires et de mortalité chez les patients atteints de goutte: une étude de cohorte utilisant les dossiers médicaux électroniques liés aux réclamations de Medicare. Ann Rheum Dis. 2016 Sep;75(9):1674-9.
6. Tardif JC, Kouz S, Waters DD, Bertrand OF, Diaz R, Maggioni AP, et al. Efficacy and Safety of Low-Dose Colchicine after Myocardial Infarction. N Engl J Med. 2019 Dec 26;381(26):2497-505.
7. Roubille F, Bouabdallaoui N, Kouz S, Waters DD, Diaz R, Maggioni AP, et al. Low-Dose Colchicine in Patients With Type 2 Diabetes and Recent Myocardial Infarction in the Colchicine Cardiovascular Outcomes Trial (COLCOT). Soins du diabète. 2024 Mar 1;47(3):467-70.
8. Nidorf SM, Fiolet ATL, Mosterd A, Eikelboom JW, Schut A, Opstal TSJ, et al. Colchicine in Patients with Chronic Coronary Disease. N Engl J Med. 2020 Nov 5;383(19):1838-47.
9. So A, Dumusc A, Nasi S. The role of IL-1 in gout: from bench to bedside. Rhumatologie (Oxford, Angleterre). 2018;57(1).
10. Janssen CA, Oude Voshaar MAH, Vonkeman HE, Jansen TLTA, Janssen M, Kok MR, et al. Anakinra for the treatment of acute gout flares: a rando- mized, double-blind, placebo-controlled, active-comparator, non-inferiority trial. Rheumatology (Oxford, Angleterre) [Internet]. 2019 Jan 2; Disponible à partir de: http://www.ncbi.nlm.nih.gov/pubmed/30602035
11. Saag KG, Khanna PP, Keenan RT, Ohlman S, Osterling Koskinen L, Sparve E, et al. A Randomized, Phase II Study Evaluating the Efficacy and Safety of Anakinra in the Treatment of Gout Flares. Arthritis Rheumatol. 2021 août;73(8):1533-42.
12. Terkeltaub R a, Schumacher HR, Carter JD, Baraf HSB, Evans RR, Wang J, et al. Rilonacept in the treatment of acute gouty arthritis: a randomized, controlled clinical trial using indomethacin as the active comparator. Arthri- tis research & therapy. 2013 Jan;15(1):R25.
13. Mitha E, Schumacher HR, Fouche L, Luo SF, Weinstein SP, Yancopoulos GD, et al. Rilonacept for gout flare prevention during initiation of uric
acid-lowering therapy: results from the PRESURGE-2 international, phase 3, randomized, placebo-controlled trial. Rheumatology (Oxford, Angleterre). 2013 juillet;52(7):1285-92.
14. Schumacher HR, Sundy JS, Terkeltaub R, Knapp HR, Mellis SJ, Stahl N, et al. Rilonacept (piège à interleukine-1) dans la prévention des flambées de goutte aiguës
lors de l’ initiation d’ un traitement réducteur d’ urate: résultats d’ un essai de phase II randomisé, en double aveugle, contrôlé par placebo. Arthrite et rhumatisme. 2012 Mar;64(3):876-84.
15. Schumacher HR, Evans RR, Saag KG, Clower J, Jennings W, Weinstein SP, et al. Rilonacept (piège à interleukine-1) pour la prévention des flambées de goutte pendant la grossesse.
initiation d’ un traitement réduisant l’ acidité urique: résultats d’ une étude de phase III randomisée, en double aveugle, contrôlée par placebo, confirmant l’ efficacité. Arthritis care & research. 2012 Oct;64(10):1462-70.
16. Schlesinger N, Alten RE, Bardin T, Schumacher HR, Bloch M, Gimona A, et al. Canakinumab for acute gouty arthritis in patients with limited treat- ment options: results from two randomised, multicentre, active-controlled, double-blind trials and their initial extensions. Annales des maladies rhumatismales. 2012 Nov;71(11):1839-48.
17. Schlesinger N, Mysler E, Lin HY, De Meulemeester M, Rovensky J, Arulma- ni U, et al. Canakinumab reduces the risk of acute gouty arthritis flares du- ring initiation of allopurinol treatment: results of a double-blind, randomised study. Annales des maladies rhumatismales. 2011 juillet;70(7):1264-71.
18. Solomon DH, Glynn RJ, MacFadyen JG, Libby P, Thuren T, Everett BM, et al. Relationship of Interleukin-1 Beta Blockade With Incident Gout and Serum Uric Acid Levels: Exploratory Analysis of a Randomized Controlled Trial. Annals of internal medicine. 2018 oct 16;169(8):535-42.
19. Tausche AK, Richter K, Grässler A, Hänsel S, Roch B, Schröder HE. Arthrite goutteuse sévère réfractaire aux médicaments anti-inflammatoires: traitement par anti-tu- mour necrosis factor alpha comme nouvelle option thérapeutique. Ann Rheum Dis. 2004 Oct;63(10):1351-2.
20. Calvo-Aranda E, Sanchez-Aranda FM. Efficacité du tocilizu- mab sous-cutané chez un patient souffrant d’ une grave goutte réfractaire à l’ anakinra. Rhumatologie (Oxford). 2021 Nov 3;60(11):e375-7.
21. Sundy JS, Baraf HSB, Yood RA, Edwards NL, Gutierrez-Urena SR, Treadwell EL, et al. Efficacité et tolérance de la pegloticase pour le traitement de la goutte chronique chez les patients réfractaires au traitement conventionnel: deux essais rando- mized contrôlés. JAMA. 2011 Aug 17;306(7):711-20.
22. Lipsky PE, Calabrese LH, Kavanaugh A, Sundy JS, Wright D, Wolfson M, et al. Pegloticase immunogenicity: the relationship between efficacy and an- tibody development in patients treated for refractory chronic gout. Arthritis Res Ther. 2014 Mar 4;16(2):R60.
23. Botson JK, Saag K, Peterson J, Parikh N, Ong S, La D, et al. A Ran- domized, Placebo-Controlled Study of Methotrexate to Increase Res- ponse Rates in Patients with Uncontrolled Gout Receiving Pegloticase: Primary Efficacy and Safety Findings. Arthrite et rhumatologie. 2023 Feb;75(2):293-304.
24. Botson JK, Saag K, Peterson J, Obermeyer K, Xin Y, LaMoreaux B, et al. A Randomized, Double-Blind, Placebo-Controlled Multicenter Efficacy and Safety Study of Methotrexate to Increase Response Rates in Patients With Uncontrolled Gout Receiving Pegloticase: 12-Month Findings. ACR Open Rheumatology. 2023;5(8):407-18.
25. Hosoya T, Ogawa Y, Hashimoto H, Ohashi T, Sakamoto R. Comparaison du topiroxostat et de l’ allopurinol chez les patients japonais hyperuricémiques avec ou sans goutte: une phase 3, multicentrique, randomisée, en double aveugle,
double-dummy, active-controlled, parallel-group study. J Clin Pharm Ther. 2016 Jun;41(3):290-7.
26. Hosoya T, Sasaki T, Hashimoto H, Sakamoto R, Ohashi T. Efficacité clinique et sécurité du topiroxostat chez les patients hyperuricémiques masculins japonais avec ou sans goutte: une étude exploratoire, phase 2a, multicentrique, randomisée, en double aveugle, contrôlée par placebo. J Clin Pharm Ther. 2016 Jun;41(3):298- 305.
27. Terkeltaub R, Lee J, Min J, Shin S, Saag KG. Efficacité et sécurité du tigulixostat dans la réduction de l’ urate sérique chez les patients atteints d’ hyperuricémie: essai randomisé, en double aveugle, contrôlé par placebo et à doses fixes. Arthritis Rheumatol. 2023 Jul;75(7):1275-84.
28. Yokose C, McCormick N, Abhishek A, Dalbeth N, Pascart T, Lioté F, et al. The clinical benefits of sodium-glucose cotransporter type 2 inhibitors in people with gout. Nat Rev Rheumatol. 2024 avr;20(4):216-31.
29. Zhao Y, Xu L, Tian D, Xia P, Zheng H, Wang L, et al. Effects of sodium- glucose co-transporter 2 (SGLT2) inhibitors on serum uric acid level: A meta-analysis of randomized controlled trials. Diabetes Obes Metab. 2018 Feb;20(2):458-62.
30. McDowell K, Welsh P, Docherty KF, Morrow DA, Jhund PS, de Boer RA, et al. Dapagliflozin reduces uric acid concentration, an independent predictor of adverse outcomes in DAPA-HF. Eur J Heart Fail. 2022 Jun;24(6):1066- 76.
31. Novikov A, Fu Y, Huang W, Freeman B, Patel R, van Ginkel C, et al. SGLT2 inhibition and renal urate excretion: role of luminal glucose, GLUT9, and URAT1. Am J Physiol Renal Physiol. 2019 Jan 1;316(1):F173-85.
32. Becker MA, Schumacher HR, Wortmann RL, MacDonald PA, Eustace D, Palo WA, et al. Febuxostat comparé à l’ allopurinol chez des patients atteints d’ hyperuricémie et de goutte. N Engl J Med. 2005 Dec 8;353(23):2450-61.
33. Stamp L, Horne A, Mihov B, Drake J, Haslett J, Chapman PT, et al. Is col- chicine prophylaxis required with start-low go-slow allopurinol dose escala- tion in gout ? A non-inferiority randomised double-blind placebo-controlled trial. Ann Rheum Dis. 2023 Dec;82(12):1626-34.
34. Doherty M, Jenkins W, Richardson H, Sarmanova A, Abhishek A, Ashton D, et al. Efficacy and cost-effectiveness of nurse-led care involving education and engagement of patients and a treat-to-target urate-lowering strategy versus usual care for gout: a randomised controlled trial. Lancet. 2018 Oct 20;392(10156):1403–12.
35. Fuller A, Jenkins W, Doherty M, Abhishek A. Nurse-led care is preferred over GP-led care of gout and improves gout outcomes: results of Nottingham Gout Treatment Trial follow-up study. Rheumatology (Oxford). 2020 Mar 1;59(3):575–9.
36. Mikuls TR, Cheetham TC, Levy GD, Rashid N, Kerimian A, Low KJ, et al. Adherence and Outcomes with Urate-Lowering Therapy: A Site-Randomized Trial. Am J Med. 2019 Mar;132(3):354–61.
37. Riches PL, Alexander D, Hauser B, Kuske B, Krause A. Evaluation of supported self-management in gout (GoutSMART): a randomised controlled feasibility trial. Lancet Rheumatol. 2022 May;4(5):e320–8.
la gazette médicale
- Vol. 14
- Ausgabe 1
- Januar 2025









