- « Chemins vers le pancréas artificiel »
pancréas artificiel».
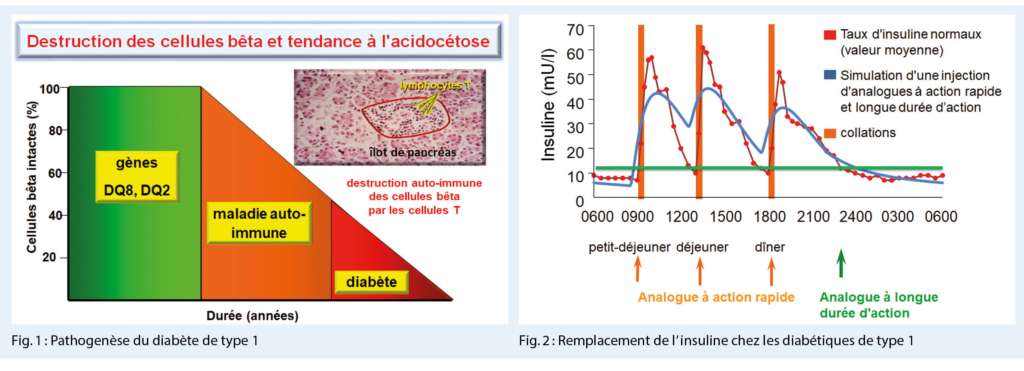
Que manque-t-il dans le diabète de type 1 ? Dans le pancréas, il y a 1 million d’ îlots pancréatiques entourés de tissu pancréatique exocrine. Le poids total s’ élève à 2 g, le poids total des cellules bêta est quant à lui de 1 g. Ceux-ci sont détruits avec le diabète ayant une tendance à l’ acidocétose. Pathogénétiquement, la charge génétique est faible. Cependant, une maladie auto-immune apparaît par la suite – même si l’ on ne sait pas encore exactement ce qui la déclenche aujourd’ hui – ce qui entraîne la destruction des cellules T de la masse totale des cellules bêta (Fig. 1).
Par conséquent, le diabète de type 1 manque de glucosenseur et d’ insuline ainsi que de sécrétion d’ insuline dans la veine portale. Ces facteurs sont nécessaires pour un contrôle normal de la glycémie.
Diverses stratégies sont disponibles pour le traitement moderne du diabète de type 1. En effet, le diabète de type 1 peut être traité par le remplacement de l’ insuline, des capteurs de glucose artificiels, le remplacement des cellules bêta sous forme de greffes d’ îlots ou de pancréas ainsi que par un pancréas artificiel. Les stratégies visant à influencer l’ auto-immunité ainsi que les thérapies à base de cellules souches et de gènes sont des objectifs de la recherche future.
La thérapie moderne de remplacement de l’ insuline tente d’ imiter le schéma physiologique de sécrétion de l’ insuline, d’ une part, avec une insuline basale à action prolongée et, d’ autre part, avec des analogues de l’ insuline à action brève au moment des repas (Fig. 2).
Le plus grand problème dans le traitement d’ un diabétique par l’ insuline est le risque de développer une hypoglycémie, dont l’ incidence atteint environ 50 % avec l’ augmentation de la durée du traitement à l’ insuline après plus de 15 ans. L’ hypoglycémie est dangereuse. En effet, elle entraîne des arythmies cardiaques, des arrêts cardiaques et donc le décès du patient. De plus, elle entraîne des événements vasculaires et le décès par des mécanismes inflammatoires ainsi qu’ un dysfonctionnement endothélial. Sur la base d’ un homme de 50 ans atteint de diabète de type 1 sans complications depuis 27 ans, l’ orateur détaille le calcul des besoins en insuline.
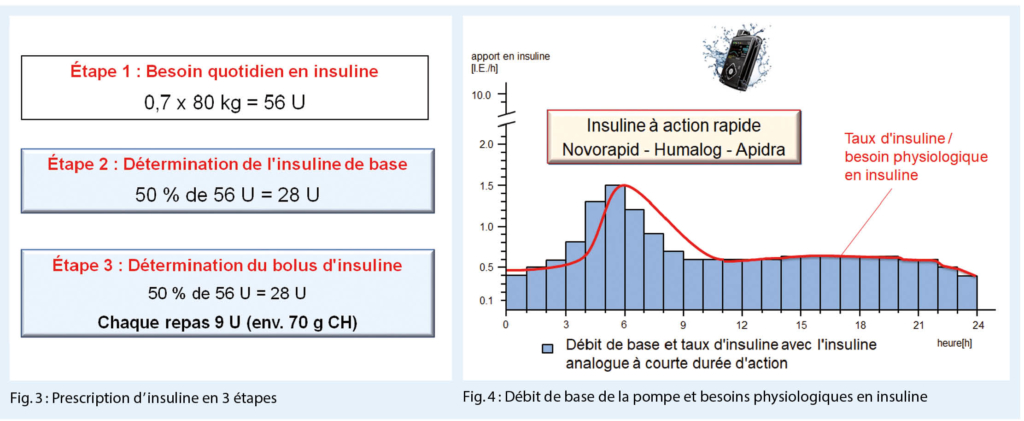
Le médecin traitant doit se demander quelle distribution de l’ insuline basale / insuline alimentaire, et quelle quantité de glucides est recommandée. Comment mesurer la glycémie ? Comment appliquer l’ insuline ? La régulation de l’ insuline se déroule en 3 étapes. Tout d’ abord le besoin quotidien en insuline doit être calculé. Dans la plupart des cas, il se situe entre 0,6-0,8 U/ kg et par jour, avec un diabète nouvellement découvert 0,5 U. À la puberté, le besoin est beaucoup plus élevé à 1,0-1,4 U en raison de l’ augmentation de l’ hormone de croissance (Fig. 3).
Dans l’ exemple d’ un patient de 50 ans, le besoin quotidien en insuline serait de 56 U. La 2ème étape est de déterminer le besoin en l’ insuline de base, qui est de 50 % soit 28 unités. La 3ème étape est la détermination du bolus d’ insuline, 28 autres unités soit environ 9 unités par repas. A chaque repas, le patient souhaite consommer environ 70 g de glucides. Pour ce faire, le patient doit être en mesure d’estimer correctement la teneur en glucides des différents composants alimentaires. 10 g de glucides augmentent la glycémie d’ environ 2,0 mmol/l. Le sang contient 4 g de glucose. Un bon contrôle glycémique est impossible sans peser ou estimer correctement les glucides. Dans
l’ exemple mentionné, 28 U d’ insuline alimentaire sont nécessaires pour 210 g de glucides. A partir de là, nous pouvons calculer le facteur glucidique : 210 / 28 = 7,5 g de glucides par unité d’ insuline. Au début d’ un traitement, nous pouvons prévoir 10 g de glucides par unité d’ insuline. L’ insuline corrective abaisse la glycémie à un niveau normal. Elle est calculée selon la formule : 100-150 / insuline totale = 125 / 56 = 2,25 mmol / U, en tenant compte du fait que l’ insuline de correction abaisse la glycémie pendant la journée de manière moins intensive que pendant la nuit, de sorte que le patient peut abaisser spécifiquement la glycémie de 2 mmol pendant la journée et de 3-4 mmol la nuit avec une unité d’ insuline.
Avec les pompes à insuline conventionnelles, le besoin physiologique en insuline peut être défini individuellement en programmant l’ administration horaire d’ insuline (insuline à action rapide)
(Fig. 4).
L’ entraînement à l’ utilisation correcte de la thérapie par pompe classique comprend des instructions sur le débit de base : le facteur glucidique, le facteur de correction, le taux de glycémie cible, la durée d’ insuline et les ajustements nécessaires en cas de sport ou de maladie. Pour les pompes supportées par un capteur de glucose, les fonctions basales (pompe à insuline de base : débit basal, bolus, bolus de correction), les fonctions postprandiales du glucose (bolus expert avec facteur glucidique et facteur de correction) et les fonctions avancées avec surveillance glycémique continue peuvent être utilisées en plus des fonctions de base (pompe à insuline de base : débit basal, bolus, bolus de correction).
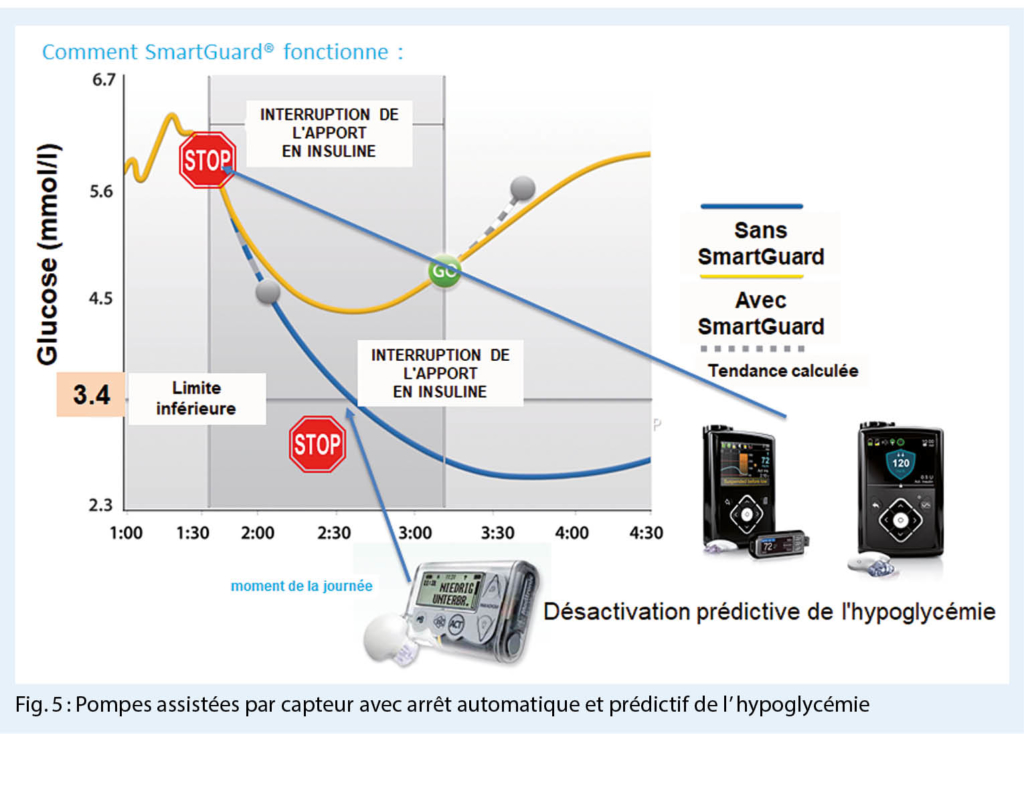
Qu’ est-ce qu’ un pancréas artificiel ? Il se compose d’ une pompe à insuline, d’ un capteur de glucose et d’ un ordinateur. Pour la mesure continue du glucose, un cathéter métallique fin est inséré dans le tissu sous-cutané. La mesure a lieu dans le tissu interstitiel. Il en résulte un certain retard par rapport à une mesure effectuée directement dans le vaisseau sanguin. Aujourd’ hui, il existe des systèmes qui mesurent la glycémie période par période ou en continu. Les systèmes plus récents peuvent être couplés à une pompe, devant être obligatoirement calibrés. En outre, il existe des systèmes implantables qui n’ ont pas encore fait leurs preuves. Les pompes modernes assistées par capteur avec désactivation prédictive de l’ hypoglycémie permettent d’ éviter largement
l’ hypoglycémie (Fig. 5).
Les pompes semi-automatiques les plus récentes, approuvées pour les patients atteints de diabète de type 1 âgés de plus de 14 ans, ne nécessitent pas de débit de base défini. Le capteur de glucose mesure et l’ ordinateur calcule la quantité d’ insuline nécessaire pour maintenir un taux de glycémie normal. Avec ce système, il est possible d’ atteindre l’ objectif de 3,9-10 mmol / l dans 3/4 de cas contre 2 / 3 avec les anciens systèmes de pompage. L’ hypoglycémie a été réduite de 1,0 % à 0,6 %. Chez 75 % de tous les patients traités, l’ HbA1c s’ est améliorée, de sorte que plus de la moitié
d’ entre eux avaient une HbA1c inférieure à 7 %, contre environ un tiers avec les anciens systèmes. La manipulation de ces nouvelles pompes semi-automatiques est fondamentalement plus facile. Cependant, la connaissance des facteurs glucidiques est cruciale. Sous la devise «Pas de contrôle de la glycémie sans connaître la quantité de glucides», le patient doit pouvoir mesurer avec précision la teneur en glucides de ses repas. Il est donc essentiel de connaître la teneur en glucides de chaque aliment. Muesli, farine et flocons d’ avoine se composent de 2/3 glucides, pain 1/2, riz et pâtes cuites 1/4, pommes de terre 1/7, fruits 1/10, lait, yaourt 1/20, légumes, viande, graisse 0. Des projets comme GoCarb sont actuellement en développement. Ils permettraient une reconnaissance automatique des glucides, par exemple avec la photographie des aliments sous 2 angles, puis la segmentation, la reconnaissance des aliments et la reconstruction 3D du volume avec calcul de la quantité de glucides (Fig. 6).
Etant donné que la libération totale d’ insuline dépend de la détermination correcte de la glycémie, le capteur doit également être calibré 2 ou 3 fois. Pour finir, l’ orateur souligne les points suivants : la technologie peut toujours échouer, c’ est pourquoi une formation détaillée est nécessaire pour être en mesure d’ agir correctement en cas d’ urgence. De nos jours, l’ empathie ainsi que la motivation et
l’ individualisation sont de la plus haute importance. Les conditions de base pour le traitement du diabète dans le futur sont, d’ une part, l’ ouverture d’ esprit à la technologie et, d’ autre part, la compréhension.
Dans une perspective d’ avenir, le professeur Lehmann présente la découverte révolutionnaire d’ une sous-population de lymphocytes chez des patients atteints de diabète de type 1, qui présentent à la fois des récepteurs des lymphocytes B et T. Ces cellules codent pour un peptide qui se lie aux cellules présentant l’ antigène avec une affinité 1000 fois plus élevée que l’ insuline. Par conséquence, celles-ci se multiplient et détruisent les cellules bêta. Si une approche thérapeutique était découverte ici, l’ auto-immunité pourrait également être traitée.
UniversitätsSpital Zürich
Rämistrasse 100
8091 Zurich
Roger.Lehmann@usz.ch