- Colite microscopique
La colite microscopique (CM) est une cause importante de diarrhées chroniques traitables de la population âgée. Considérée comme appartenant à la famille des maladies inflammatoires de l’ intestin, qui comprend principalement la maladie de Crohn et la colite ulcéreuse, la CM tire son nom du fait que, contrairement aux autres affections précitées, elle n’ est pas visible endoscopiquement. En effet, l’ aspect de la muqueuse colique est normal à la coloscopie. Son diagnostic repose sur l’ étude histologique de biopsies de muqueuse colique apparemment saine. Deux sous-types de CM sont reconnus sur la base de l’ histologie : la colite lymphocytaire (CL), la colite collagène (CC) (1, 2). Malgré des différences physiopathologiques, la prise en charge des deux sous-types est identique. Cet article décrit les aspects pratiques du diagnostic, des facteurs de risques, de l’ histoire naturelle et du traitement de cette entité, qu’ il convient de distinguer du syndrome de l’ intestin irritable.
Une étude systématique avec méta-analyse récente a trouvé une incidence cumulée de CC de 4.14 par 100 000 personne-années (95% intervalle de confidence (CI) 2.89-5.40) et de 4.85 (95% CI, 3.45-6.25) pour la forme LC. L’ intervalle d’ âge médian au début de la maladie était de 50-70 ans avec un ratio femme : homme de 3 : 1 (3, 4). La même méta-analyse a montré que l’ incidence et la prévalence de la CM augmente dans certains pays pour se rapprocher de celle de la maladie de Crohn (5).
Pathophysiologie
La pathophysiologie de la CM n’ est pas bien élucidée. Plusieurs mécanismes ont été proposés. Le fait que la dérivation fécale peut résoudre la CM suggère que cette maladie se développe, comme la maladie de Crohn, du fait de l’ activation inappropriée d’ une réponse immunitaire déréglée face à un ou plusieurs antigène(s) luminaux (6-8). Bien que des cas familiaux aient été décrits dans la littérature, très peu de travaux génétiques ont été conduits, mais pointent vers une association avec des groupes HLA. Une étude suédoise récente a démontré un chevauchement génétique avec les groupes HLA impliqués dans la maladie cœliaque (9). Bien que la CM soit observée plus fréquemment chez les femmes ménopausées, un lien clair au niveau hormonal fait également encore défaut.
Facteurs de risque
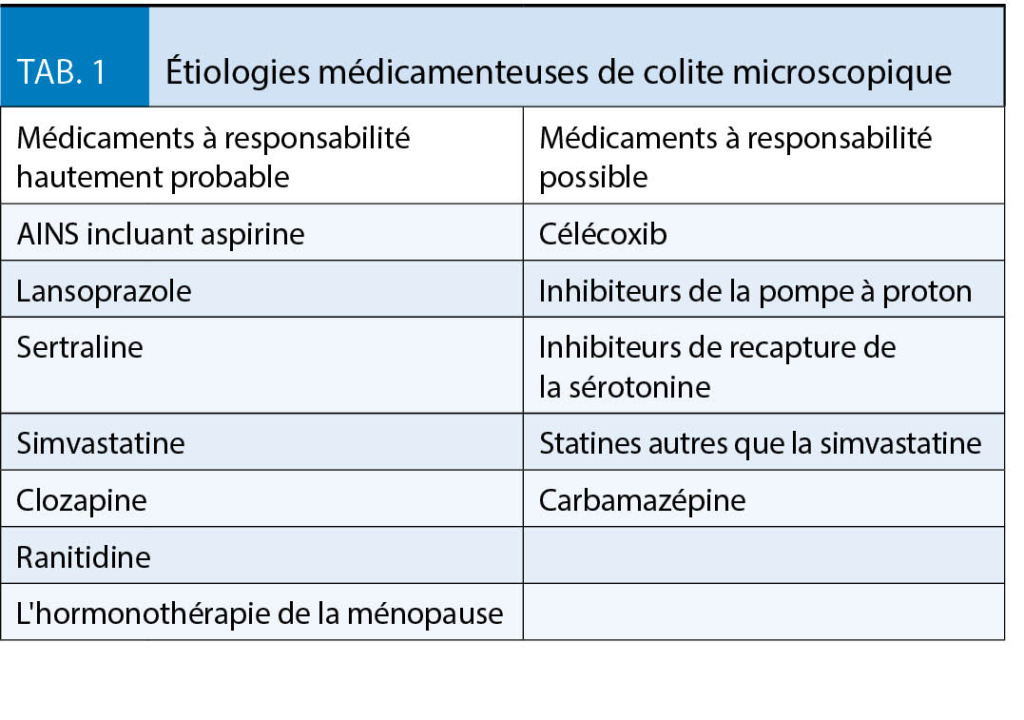
Plusieurs maladies auto-immunes telles que thyroïdite, maladie cœliaque (10), diabète de type 1, polyarthrite rhumatoïde ont été associées avec la CM (11-13). De plus, certains médicaments ont été identifiés comme facteurs de risque de CM, et classés comme basse probabilité, probabilité intermédiaire ou haute d’ entraîner une CM (14). Les inhibiteurs de pompes à protons (5), les inhibiteurs sélectifs de la recapture de la sérotonine et les anti-inflammatoires non-stéroïdiens sont les médicaments les plus fréquemment impliqués (15).
Une étude britannique contrôlée par cas a démontré que l’ utilisation prolongée d’ IPP, d’ AINS et de SSRIS était associée à la MC. La même étude a démontré que si la diarrhée persistait 3 mois après l’ arrêt du médicament ou commençait ≥12 mois après le début de la thérapie médicamenteuse, la diarrhée était moins susceptible d’ être liée au médicament (16).
Compte tenu de la prédominance des femmes post-ménopausées dans la population atteinte de la maladie, une association avec les hormones féminines a été suggérée.
Dans une étude, le risque de colite microscopique a été multiplié par 2,6 chez les femmes post-ménopausées utilisant un traitement hormonal substitutif (17). Le tabagisme a aussi été décrit comme un facteur de risqué de CM (18).
Présentation clinique
La MC est caractérisée par une histoire de plus de 4 semaines de diarrhées aqueuses non-sanglantes, avec évacuations nocturnes, douleurs abdominales, perte de poids et fatigue (19). Les diarrhées peuvent entraîner des troubles électrolytiques, une insuffisance rénale pré-rénale et une hypotension. L’ évolution naturelle de la colite microscopique est variable. L’ apparition des symptômes est soudaine chez jusqu’ à 42 % des patients, et des épisodes intermittents de diarrhée sont observés chez 65 à 89 % des patients. Une rémission spontanée a été signalée chez environ 15 % des patients, mais la plupart des patients ont des périodes de rémission clinique avec des rechutes avant d’obtenir une rémission clinique durable (8, 17). La qualité de vie peut être altérée.
Diagnostic
Le diagnostic est établi au moyen de biopsies coliques obtenues par sigmoïdoscopie ou coloscopie. Une coloscopie complète avec des biopsies du colon ascendant, transverse, descendant et du rectum est recommandée car le diagnostic peut être manqué dans près d’ un quart des cas (23%) si seul le sigmoïde et le rectum sont biopsiés (20). La calprotectine est < 100 μg/g dans 50% des patients avec CM (21).
Les biopsies peuvent montrer une plaque collagène sous-épithéliale épaissie dans la CC (>10 μm) ou un infiltrat lymphocytaire intra-épithélial (IEL) dans la CL (> 20 IEL par 100 cellules épithéliales), dans un côlon d’ aspect macroscopiquement normal ou quasi-normal. Des sous-types incomplets de CM ont été décrit, dits colites incomplètes (CI), dans lesquelles les biopsies ont des caractéristiques de de CM mais ne remplissent pas les critères histologiques (2). Les valeurs seuil sont de 10 IELs pour la CL incomplète et une épaisseur de collagène de 5 μm pour une CC incomplète.
Prise en charge clinique
Le but du traitement, défini par différents groupes d’ experts internationaux, est d’ obtenir une rémission clinique et d’ améliorer la qualité de vie (1, 22). Un index MCDAI (pour Microscopic Colitis Activity Index) a également été proposé comme critère d’ évaluation (23) qui incorpore plusieurs symptômes et est en relation avec la qualité de vie.
Le budésonide oral, un corticostéroïde avec un important effet de premier passage hépatique (90%) et donc une biodisponibilité systémique basse (23), est le traitement de première ligne de la CM recommandé par l’ Association de Gastroentérologie Américaine et par le Microscopic Colitis Group (1, 22).
Des études randomisées et une méta-analyse ont démontré l’ efficacité du budésonide contre le placebo et la mesalasine dans le traitement de la MC (24). Après 6-8 semaines de budésonide 9 mg/jour, un taux de rémission clinique entre 73 et 100% a été obtenu dès la 2ème semaine avec normalisation de la qualité de vie à la 6ème (8, 25-30). Malheureusement, 61% des patients rechutent dans les 3 mois après l’ arrêt du traitement (31). La prednisone orale est moins efficace que le budésonide dans le traitement de la CM (8, 2).
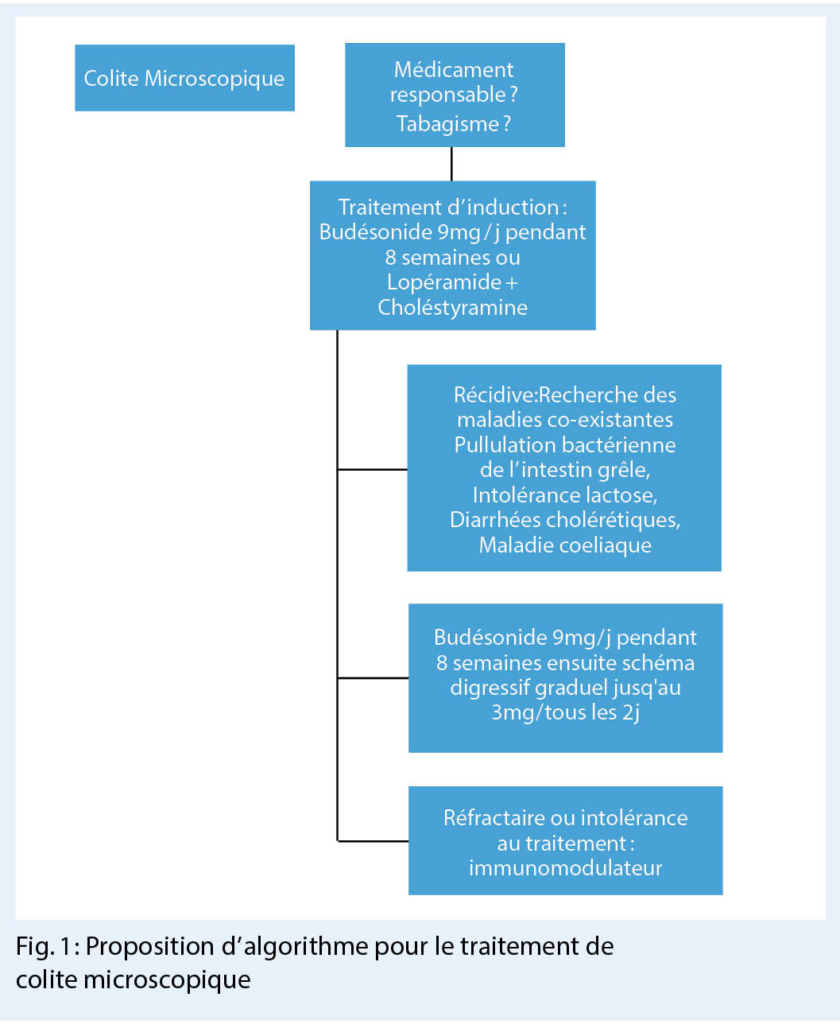
Les autres options thérapeutiques dans les CM légères incluent le lopéramide, la cholestyramine, les sels de bismuth et la mesalasine (26, 33, 34). Un algorithme pour le traitement de colite microscopique est proposé dans la figure 1.
Il est également important de faire une anamnèse détaillée des prises de médicaments afin d’ interrompre tous ceux qui pourraient être associés avec la CM et d’ encourager l’ arrêt du tabagisme.
Rechute ou non-réponse
En absence de réponse thérapeutique, mais également chez les patients qui rechutent, il convient d’ exclure des pathologies concomitantes telles que des diarrhées médicamenteuses, une maladie cœliaque, des diarrhées cholérétiques, une pullulation bactérienne de l’ intestin grêle ainsi qu’ une intolérance au lactose ou au fructose.
Une fois que ces causes ont été exclues, le traitement de budésonide est repris et graduellement diminué jusqu’ à la dose minimale effective (35). Un traitement de budésonide de 4,5mg à 6mg/jour pour 12 mois a été associé avec un taux de rémission à long terme chez 60 à 75% des patients avec une très bonne tolérance (35-37). Un traitement d’ entretien à la plus petite dose possible de budésonide avec prescription de suppléments de calcium et de vitamine D est une option, avec un suivi des effets secondaires au long cours, notamment le développement d’ une ostéoporose (38). Dans la pratique une ré-induction par 6mg/jour de budésonide avec un traitement d’ entretien de 3mg/jour ou tous les 2 jours est souvent possible. Un traitement de cholestyramine au coucher peut être ajouté pour contrôler une malabsorption associée des sels biliaires.
Sécurité d’ emploi du budésonide
Un profil de sécurité comparable à celui du placebo a été montré dans les études randomisées (25, 35). Une récente étude cas-contrôle cohorte danoise de patients avec CM (2004-2012) n’ a pas mis en évidence de relation entre la prise de budésonide et la survenue de fractures ostéoporotiques (hanches, poignets ou vertèbres). Malgré cela un suivi régulier est recommandé pour détecter la survenue d’ effets secondaires cortisoniques tels qu’ une hypertension, un diabète, des troubles métaboliques osseux ou une dépression, ainsi qu’ une ré-évaluation de la nécessité du traitement de budésonide après 12 mois (38). De plus, la prudence est de mise si un traitement concomitant d’ un inhibiteur du cytochrome P45 est prescrit (39). De même, les patients devraient être informés d’ éviter le jus de pamplemousse qui est un inhibiteur du cytochrome P450.
Traitement immuno-modulateur
Chez les patients réfractaires ou dépendant au budésonide (> 6mg/jour) ou intolérants à ce médicament, des immuno-modulateurs tels que le méthotrexate, l’ azathioprine ou des médicaments biologiques comme l’ infliximab ont été prescrits avec des succès variables (40-43). Ces informations sont issues de séries cliniques mais aucune étude randomisée n’ a été effectuée avec ces agents. Dans une cohorte de 73 patients américains avec CM, 49 personnes ont été traitées par azathioprine avec une efficacité de 43% dans la CC et 22% dans la CL (42). Dans la même cohorte, un anti-TNF a été utilisé chez 10 patients avec une rémission clinique chez 4 d’ entre eux et une réponse partielle chez 4 autres (42). Des 12 patients traités par méthotrexate, 58% sont entrés en rémission tandis que 17% ont présentés une réponse partielle. Toutefois, un traitement de budésonide a été poursuivi chez 9/12 des patients sous méthotrexate. Une récente série clinique internationale a décrit l’ utilisation du vedolizumab chez 11 patients avec CM réfractaire avec une rémission obtenue chez 5 d’ entre eux (44).
Histoire naturelle de la CM
L’ histoire naturelle de la CM est considérée comme bégnine, sans évidence de risque accru de cancer colorectal, de risque de colectomie ou de mortalité excessive à long terme. Après le diagnostic, deux tiers des patients vont être en rémission clinique sur une période de suivi moyenne de 9,5 ans (45).
PD Dr Michel H. Maillard 1,2
Dr Christian Felley 1,3
1Centre Crohn et Colite, Gastroentérologie Beaulieu, Lausanne
2Service de Gastroentérologie et Hépatologie, CHUV, Lausanne
3Service d’ Hépato-gastro-entérologie, HUG, Genève
Centre Crohn et Colite, Gastroentérologie Beaulieu
Avenue Jomini 8, 1004 Lausanne
Copyright Aerzteverlag medinfo AG
Centre Crohn et Colite, Gastroentérologie Beaulieu, Lausanne
Avenue Jomini 8
1004 Lausanne
Centre Crohn et Colite, Gastroentérologie Beaulieu, Lausanne
Service de Gastroentérologie et Hépatologie, CHUV, Lausanne
Avenue Jomini 8
1004 Lausanne
pmichetti@gesb.ch
CF: Aucun; MV: Lectures Takeda et Vifor Pharma; MM: Consulting Vifor, AbbVie, UCB, MSD, Lilly, Janssen, Takeda, Lectures Vifor, Janssen, AbbVie, MSD, Pfizer, UCB, Takeda, Grants UCB, AbbVie, Vifor, MSD, Takeda; PM: Consulting AstraZeneca, AbbVie, Ferring Pharmaceuticals, Janssen, Merck Serono, MSD, Nestlé Health Sciences, Pfizer, Takeda, UCB Pharma et Vifor, Lectures AbbVie, Ferring Pharmaceuticals, Janssen, Hospira, MSD, Pfizer, Takeda, UCB Pharma et Vifor Pharma, Grants MSD, Takeda, UCB pharma, iQone.
- La CM est fréquemment manquée lors de diarrhées chroniques, car la calprotectine peut être normale et elle n’ a pas de traduction endoscopique.
- La distinction avec son diagnostic différentiel principal qu’ est le syndrome de l’ intestin irritable est cruciale dans la prise en charge de ces patients avec diarrhées inexpliquées.
- Il convient de stopper les traitements pouvant causer des diarrhées, d’ effectuer une coloscopie avec biopsies multiples et de rechercher les pathologies associées et de traiter la CM en première intention par budésonide 9mg/j pour 8 semaines.
1. Munch A, Aust D, Bohr J, Bonderup O, Fernandez Banares F, Hjortswang H, et al. Microscopic colitis: Current status, present and future challenges: statements of the European Microscopic Colitis Group. J Crohns Colitis. 2012;6(9):932-45.
2. Langner C, Aust D, Ensari A, Villanacci V, Becheanu G, Miehlke S, et al. Histology of microscopic colitis-review with a practical approach for pathologists. Histopathology. 2015;66(5):613-26.
3. Gentile NM, Khanna S, Loftus EV, Jr., Smyrk TC, Tremaine WJ, Harmsen WS, et al. The epidemiology of microscopic colitis in Olmsted County from 2002 to 2010: a population-based study. Clin Gastroenterol Hepatol. 2014;12(5):838-42.
4. Tong J, Zheng Q, Zhang C, Lo R, Shen J, Ran Z. Incidence, prevalence, and temporal trends of microscopic colitis: a systematic review and meta-analysis. Am J Gastroenterol. 2015;110(2):265-76; quiz 77.
5. Bonderup OK, Wigh T, Nielsen GL, Pedersen L, Fenger-Gron M. The epidemiology of microscopic colitis: a 10-year pathology-based nationwide Danish cohort study. Scand J Gastroenterol. 2015;50(4):393-8.
6. Daferera N, Kumawat AK, Hultgren-Hornquist E, Ignatova S, Strom M, Munch A. Fecal stream diversion and mucosal cytokine levels in collagenous colitis: A case report. World J Gastroenterol. 2015;21(19):6065-71.
7. Jarnerot G, Tysk C, Bohr J, Eriksson S. Collagenous colitis and fecal stream diversion. Gastroenterology. 1995;109(2):449-55.
8. Miehlke S, Verhaegh B, Tontini GE, Madisch A, Langner C, Munch A. Microscopic colitis: pathophysiology and clinical management. Lancet Gastroenterol Hepatol. 2019;4(4):305-14.
9. Westerlind H, Mellander MR, Bresso F, Munch A, Bonfiglio F, Assadi G, et al. Dense genotyping of immune-related loci identifies HLA variants associated with increased risk of collagenous colitis. Gut. 2017;66(3):421-8.
10. Green PH, Yang J, Cheng J, Lee AR, Harper JW, Bhagat G. An association between microscopic colitis and celiac disease. Clin Gastroenterol Hepatol. 2009;7(11):1210-6.
11. Macaigne G, Lahmek P, Locher C, Lesgourgues B, Costes L, Nicolas MP, et al. Microscopic colitis or functional bowel disease with diarrhea: a French prospective multicenter study. Am J Gastroenterol. 2014;109(9):1461-70.
12. Olesen M, Eriksson S, Bohr J, Jarnerot G, Tysk C. Lymphocytic colitis: a retrospective clinical study of 199 Swedish patients. Gut. 2004;53(4):536-41.
13. Fernandez-Banares F, de Sousa MR, Salas A, Beltran B, Piqueras M, Iglesias E, et al. Epidemiological risk factors in microscopic colitis: a prospective case-control study. Inflamm Bowel Dis. 2013;19(2):411-7.
14. Beaugerie L, Pardi DS. Review article: drug-induced microscopic colitis – proposal for a scoring system and review of the literature. Aliment Pharmacol Ther. 2005;22(4):277-84.
15. Lucendo AJ. Drug Exposure and the Risk of Microscopic Colitis: A Critical Update. Drugs R D. 2017;17(1):79-89.
16. Verhaegh BP, de Vries F, Masclee AA, Keshavarzian A, de Boer A, Souverein PC, et al. High risk of drug-induced microscopic colitis with concomitant use of NSAIDs and proton pump inhibitors. Aliment Pharmacol Ther. 2016;43(9):1004-13.
17. Burke KE, Ananthakrishnan AN, Lochhead P, Liu PH, Olen O, Ludvigsson JF, et al. Identification of Menopausal and Reproductive Risk Factors for Microscopic Colitis-Results From the Nurses’ Health Study. Gastroenterology. 2018;155(6):1764-75 e2.
18. Vigren L, Sjoberg K, Benoni C, Tysk C, Bohr J, Kilander A, et al. Is smoking a risk factor for collagenous colitis? Scand J Gastroenterol. 2011;46(11):1334-9.
19. Bohr J, Tysk C, Eriksson S, Abrahamsson H, Jarnerot G. Collagenous colitis: a retrospective study of clinical presentation and treatment in 163 patients. Gut. 1996;39(6):846-51.
20. Thijs WJ, van Baarlen J, Kleibeuker JH, Kolkman JJ. Microscopic colitis: prevalence and distribution throughout the colon in patients with chronic diarrhoea. Neth J Med. 2005;63(4):137-40.
21. Wildt S, Nordgaard-Lassen I, Bendtsen F, Rumessen JJ. Metabolic and inflammatory faecal markers in collagenous colitis. Eur J Gastroenterol Hepatol. 2007;19(7):567-74.
22. Nguyen GC, Smalley WE, Vege SS, Carrasco-Labra A, Clinical Guidelines C. American Gastroenterological Association Institute Guideline on the Medical Management of Microscopic Colitis. Gastroenterology. 2016;150(1):242-6; quiz e17-8.
23. Cotter TG, Binder M, Loftus EV, Jr., Abboud R, McNally MA, Smyrk TC, et al. Development of a Microscopic Colitis Disease Activity Index: a prospective cohort study. Gut. 2018;67(3):441-6.
24. Chande N, Al Yatama N, Bhanji T, Nguyen TM, McDonald JW, MacDonald JK. Interventions for treating lymphocytic colitis. Cochrane Database Syst Rev. 2017;7:CD006096.
25. Miehlke S, Aust D, Mihaly E, Armerding P, Bohm G, Bonderup O, et al. Efficacy and Safety of Budesonide, vs Mesalazine or Placebo, as Induction Therapy for Lymphocytic Colitis. Gastroenterology. 2018;155(6):1795-804 e3.
26. Miehlke S, Madisch A, Kupcinskas L, Petrauskas D, Bohm G, Marks HJ, et al. Budesonide is more effective than mesalamine or placebo in short-term treatment of collagenous colitis. Gastroenterology. 2014;146(5):1222-30 e1-2.
27. Baert F, Schmit A, D’Haens G, Dedeurwaerdere F, Louis E, Cabooter M, et al. Budesonide in collagenous colitis: a double-blind placebo-controlled trial with histologic follow-up. Gastroenterology. 2002;122(1):20-5.
28. Miehlke S, Heymer P, Bethke B, Bastlein E, Meier E, Bartram HP, et al. Budesonide treatment for collagenous colitis: a randomized, double-blind, placebo-controlled, multicenter trial. Gastroenterology. 2002;123(4):978-84.
29. Bonderup OK, Hansen JB, Birket-Smith L, Vestergaard V, Teglbjaerg PS, Fallingborg J. Budesonide treatment of collagenous colitis: a randomised, double blind, placebo controlled trial with morphometric analysis. Gut. 2003;52(2):248-51.
30. Pardi DS, Ramnath VR, Loftus EV, Jr., Tremaine WJ, Sandborn WJ. Lymphocytic colitis: clinical features, treatment, and outcomes. Am J Gastroenterol. 2002;97(11):2829-33.
31. Miehlke S, Madisch A, Voss C, Morgner A, Heymer P, Kuhlisch E, et al. Long-term follow-up of collagenous colitis after induction of clinical remission with budesonide. Aliment Pharmacol Ther. 2005;22(11-12):1115-9.
32. Stewart MJ, Seow CH, Storr MA. Prednisolone and budesonide for short- and long-term treatment of microscopic colitis: systematic review and meta-analysis. Clin Gastroenterol Hepatol. 2011;9(10):881-90.
33. Calabrese C, Fabbri A, Areni A, Zahlane D, Scialpi C, Di Febo G. Mesalazine with or without cholestyramine in the treatment of microscopic colitis: randomized controlled trial. J Gastroenterol Hepatol. 2007;22(6):809-14.
34. Fine KD, Lee EL. Efficacy of open-label bismuth subsalicylate for the treatment of microscopic colitis. Gastroenterology. 1998;114(1):29-36.
35. Munch A, Bohr J, Miehlke S, Benoni C, Olesen M, Ost A, et al. Low-dose budesonide for maintenance of clinical remission in collagenous colitis: a randomised, placebo-controlled, 12-month trial. Gut. 2016;65(1):47-56.
36. Bonderup OK, Hansen JB, Teglbjaerg PS, Christensen LA, Fallingborg JF. Long-term budesonide treatment of collagenous colitis: a randomised, double-blind, placebo-controlled trial. Gut. 2009;58(1):68-72.
37. Sebastian S, Wilhelm A, Jessica L, Myers S, Veysey M. Budesonide treatment for microscopic colitis: systematic review and meta-analysis. Eur J Gastroenterol Hepatol. 2019;31(8):919-27.
38. Wildt S, Munck LK, Becker S, Brockstedt H, Bonderup OK, Hitz MF. Risk of osteoporosis in microscopic colitis. Postgrad Med. 2018;130(3):348-54.
39. Edsbacker S, Andersson T. Pharmacokinetics of budesonide (Entocort EC) capsules for Crohn’s disease. Clin Pharmacokinet. 2004;43(12):803-21.
40. Munch A, Fernandez-Banares F, Munck LK. Azathioprine and mercaptopurine in the management of patients with chronic, active microscopic colitis. Aliment Pharmacol Ther. 2013;37(8):795-8.
41. Munch A, Bohr J, Vigren L, Tysk C, Strom M. Lack of effect of methotrexate in budesonide-refractory collagenous colitis. Clin Exp Gastroenterol. 2013;6:149-52.
42. Cotter TG, Kamboj AK, Hicks SB, Tremaine WJ, Loftus EV, Pardi DS. Immune modulator therapy for microscopic colitis in a case series of 73 patients. Aliment Pharmacol Ther. 2017;46(2):169-74.
43. Esteve M, Mahadevan U, Sainz E, Rodriguez E, Salas A, Fernandez-Banares F. Efficacy of anti-TNF therapies in refractory severe microscopic colitis. J Crohns Colitis. 2011;5(6):612-8.
44. Riviere P, Munch A, Michetti P, Chande N, de Hertogh G, Schoeters P, et al. Vedolizumab in Refractory Microscopic Colitis: An International Case Series. J Crohns Colitis. 2019;13(3):337-40.
45. Loreau J, Duricova D, Gower-Rousseau C, Savoye G, Ganry O, Ben Khadhra H, et al. Long-Term Natural History of Microscopic Colitis: A Population-Based Cohort. Clin Transl Gastroenterol. 2019;10(9):e00071.
la gazette médicale
- Vol. 9
- Ausgabe 4
- September 2020